新型厚朴酚2-甲亚胺衍生物的合成及其生物活性
2016-05-09娄兆文
梅 帆, 翟 婷, 郑 念, 李 艳, 陈 勇, 娄兆文*
(1. 湖北大学 a. 有机化工新材料湖北省协同创新中心; b. 化学化工学院; c. 生命科学学院,湖北 武汉 430062)
·研究论文·
新型厚朴酚2-甲亚胺衍生物的合成及其生物活性
梅 帆1a,1b, 翟 婷1a,1b, 郑 念1a,1b, 李 艳1a,1b, 陈 勇1a,1c, 娄兆文1a,1b*
(1. 湖北大学 a. 有机化工新材料湖北省协同创新中心; b. 化学化工学院; c. 生命科学学院,湖北 武汉 430062)
以厚朴酚为原料,通过Reimer-Tiemann法,在其苯环羟基邻位引入甲酰基后,分别与甘氨酸、谷氨酸、精氨酸及对氨基苯磺酰胺反应合成了4个单取代、1个二取代新型厚朴酚2-甲亚胺衍生物(3a~3d和4),其结构经UV-Vis,1H NMR, IR, MS和元素分析表征。生物活性研究结果表明: 2-(N-甘氨酸)-厚朴酚甲亚胺(3a)对成肌细胞的毒性较大;2-[N-(4-氨磺酰苯基)]-厚朴酚甲亚胺(3d)浓度为64 μmol·L-1时,对CYP2D6和CYP1A2的抑制率分别为42.9%和36.8%。
厚朴酚; 氨基酸; Reimer-Tiemann法; 甲亚胺衍生物; 合成; 生物活性; 成肌细胞; CYPs
厚朴酚(5′,5-二烯丙基-2,2′-联苯二酚)是我国传统中药材厚朴的主要活性成分之一,具有抗氧化、镇静中枢神经系统和抗溃疡等药理作用,可以抑制新生血管及肿瘤的生长,应用前景十分广阔[1]。甘氨酸、谷氨酸和精氨酸分别是中性、酸性和碱性氨基酸[2],是生物体重要的组成与功能物质。对氨基苯磺酰胺是磺胺药物的基本结构[3],在医学上可直接作为药物使用,具有预防和治疗细菌感染性疾病及抑制细胞增殖等作用[4]。亚胺亦称为希夫碱,可作为螯合剂、稳定剂及生物活性试剂等,广泛应用于生产及研究[5]。和厚朴酚作为厚朴酚的异构体,由于结构有利,有关其研究报道较多[6]。
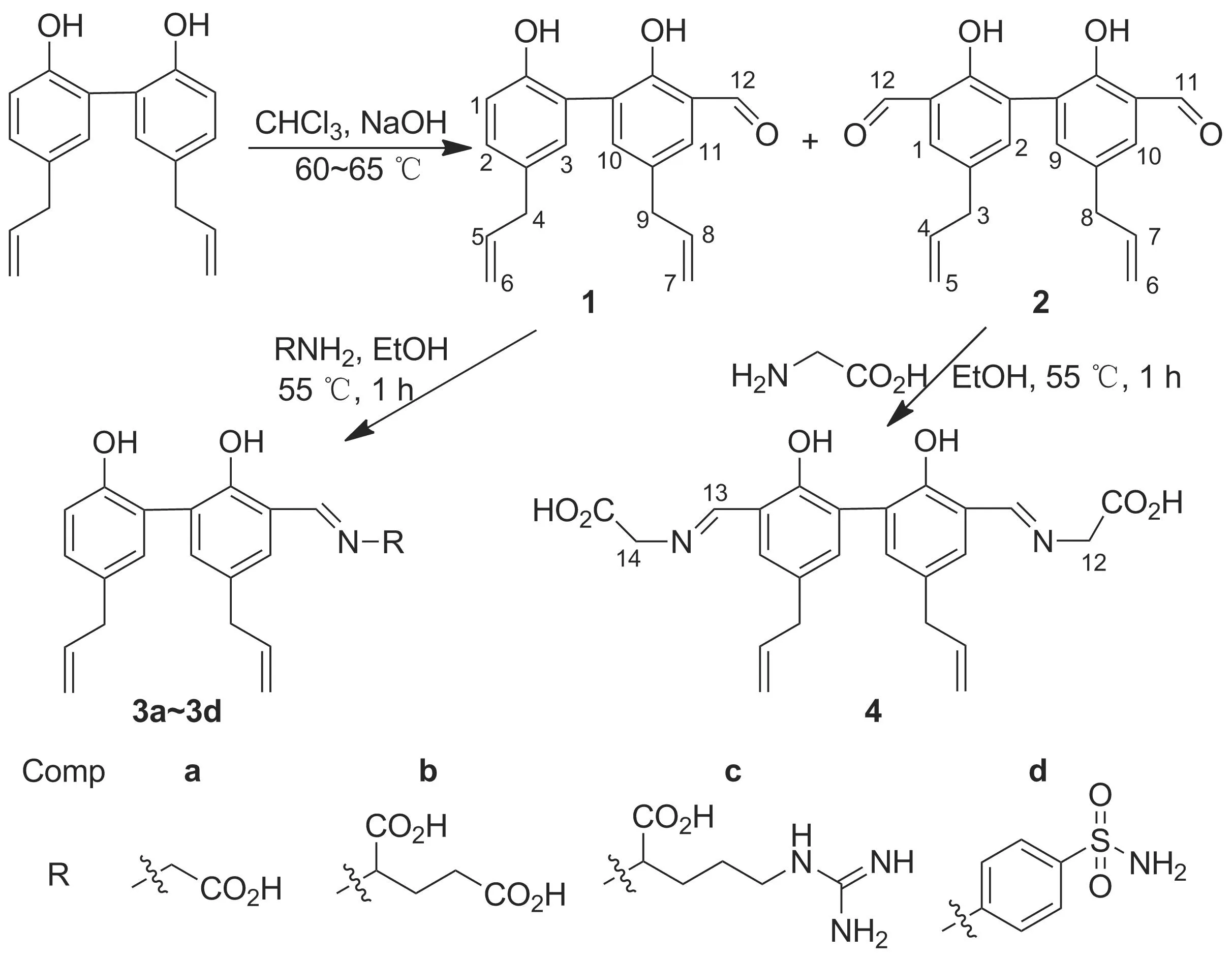
Scheme 1
本文根据上述几类化合物抗氧化等生理作用与作用位点的差异性,设计将具有一定生物活性的氨基酸、磺胺引入到厚朴酚结构中,以期通过协同作用机制,或同时在不同靶点发挥相应作用,获得具有更高生物活性的修饰物。以厚朴酚为原料,通过Reimer-Tiemann法[7],在其苯环羟基邻位引入甲酰基后,分别与甘氨酸、谷氨酸、精氨酸及对氨基苯磺酰胺反应合成了4个单取代、1个二取代新型厚朴酚2-甲亚胺衍生物(3a~3d和4, Scheme 1),其结构经UV-Vis,1H NMR, IR, MS和元素分析表征。并研究了3a和3d对成肌细胞的毒性和对体外人肝微粒体中CYPs的影响。
1 实验部分
1.1 仪器与试剂
Perkin-Elmer Lambda 35型紫外分光光度计(乙醇为溶剂);INOVA 600 MHz型核磁共振仪(CD3OD为溶剂,TMS为内标);Perkin-Elmer Spectrum one型红外光谱仪(KBr压片);LCMS-8040型三重四极杆液相色谱质谱联用仪;Elementar-Vario Micro Cube型元素分析仪。
成肌细胞,自行培养;混合人肝微粒体(Human Liver microsome, HLM), BD Gentest;厚朴酚,含量≥98%,武汉泰凯塞科技有限公司;甘氨酸(分析纯)和L-谷氨酸(生物试剂),国药集团化学试剂有限公司;精氨酸,生物试剂,天津博迪化工;其余所用试剂均为分析纯。
1.2 合成
(1) 1和2的合成
在反应瓶中依次加入厚朴酚2.66 g(0.01 mol), 35%NaOH溶液20 mL和四丁基溴化铵0.1 g,搅拌下升温至50 ℃,缓慢滴加氯仿5 mL,滴毕,于60~65 ℃反应3 h。用1 ∶1的HCl溶液调至pH 2,用氯仿萃取,合并萃取液,浓缩后经硅胶柱层析(洗脱剂:二氯甲烷)纯化得白色固体1 0.70 g和2 0.05 g。
1: 产率24%;1H NMR(CDCl3)δ: 9.916(s, 1H, 12-H), 7.430(d,J=5.4 Hz, 2H, 10,11-H), 7.329(s, 1H, 3-H), 7.117(d,J=8.4 Hz, 1H, 2-H), 6.970(d,J=8.4 Hz, 1H, 1-H), 5.988~5.891(m, 2H, 5,8-H), 5.123~5.026(m, 4H, 6,7-H), 3.414(d,J=6.6 Hz, 2H, 9-H), 3.349(d,J=6.6 Hz, 2H, 4-H); IRν: 3 401(OH), 1 651(CH=O) cm-1; MSm/z: 293.13[M-]。
2: 产率1.6%;1H NMR(CDCl3)δ: 9.922(s, 2H, 11,12-H), 7.449(s, 2H, 1,10-H), 7.379(s, 2H, 2,9-H), 6.088~5.991(m, 2H, 4,7-H), 5.163~5.126(m, 4H, 5,6-H), 3.412(d,J=4.2 Hz, 2H, 3-H), 3.253(d,J=4.2 Hz, 2H, 8-H); IRν: 1 650(CH=O) cm-1; MSm/z: 322.13[M-]。
(2) 3a~3d和4的合成(以3a为例)
在反应瓶中依次加入1 204 mg(1 mmol),甘氨酸83 mg(1.1 mmol)和乙醇5 mL,搅拌使其溶解;于55 ℃反应1 h。减压蒸除部分溶剂,冷却,结晶,粗产品用无水乙醇重结晶得3a。
用类似方法合成3b~3d和4(2与甘氨酸投料比为1 ∶2.1)。
2-(N-甘氨酸)-厚朴酚甲亚胺(3a): 黄色固体,产率58%; UV-Visλmax: 220, 296, 426 nm;1H NMRδ: 8.458(s, 1H, 12-H), 7.445(s, 1H, 11-H), 7.223(s, 1H, 10-H), 7.150(s, 1H, 3-H), 7.074(d,J=12.6 Hz, 1H, 2-H), 6.872(d,J=12.6 Hz, 1H, 1-H), 6.096~5.978(m, 2H, 5,8-H), 5.160~5.047(m, 4H, 6, 7-H), 4.333(s, 2H, 13-H), 3.386(d,J=9.6 Hz, 4H, 4,9-H); IRν: 3 417(OH), 1 638(CH=N), 1 402(OH) cm-1; MSm/z: 351.40[M-]。
2-(N-谷氨酸)-厚朴酚甲亚胺(3b): 黄色固体,产率48%; UV-Visλmax: 220, 297, 427 nm;1H NMRδ: 8.469(s, 1H, 12-H), 7.366(s, 1H, 11-H), 7.184(s, 1H, 10-H), 7.081(s, 1H, 3-H), 7.014(d,J=7.8 Hz, 1H, 2-H), 6.818(d,J=7.8 Hz, 1H, 1-H), 6.019~5.936(m, 2H, 5,8-H), 5.101~4.994(m, 4H, 6,7-H), 4.235~4.214(m, 1H, 13-H), 3.334(d,J=1.8 Hz, 4H, 4,9-H), 2.419~2.014(m, 4H, 14,15-H); IRν: 3 430(OH), 1 708(COO), 1 650(CH=N), 1 392(OH) cm-1; MSm/z: 422.17[M-]。
2-(N-精氨酸)-厚朴酚甲亚胺(3c): 黄褐色固体,产率42%; UV-Visλmax: 220, 297, 427, 517, 547 nm;1H NMRδ: 8.495(s, 1H, 12-H), 7.432(s, 1H, 11-H), 7.217(s, 1H, 10-H), 7.136(s, 1H, 3-H), 7.097(d,J=12.0 Hz, 1H, 2-H), 6.893(d,J=12 Hz, 1H, 1-H), 6.072~5.989(m, 2H, 5,8-H), 5.158~5.046(m, 4H, 6,7-H), 4.265(t,J=22.8 Hz, 1H, 13-H), 3.481~3.453(m, 4H, 4,9-H), 2.253(t,J=22.8 Hz, 2H, 16-H), 1.762~1.629(m, 4H, 14,15-H); IRν: 3 368(OH), 1 643(CH=N) cm-1; Anal calcd for C25H30N4O4: C 66.67, H 6.67, N 12.44; found C 66.60, H 6.49, N 12.20。
2-[N-(4-氨磺酰苯基)]-厚朴酚甲亚胺(3d): 深红色固体,产率58%; UV-Visλmax: 222, 254, 291, 449 nm;1H NMRδ: 8.756(s, 1H, 12-H), 8.066(d,J=12.6 Hz, 2H, 14,16-H), 7.457(d,J=12.6 Hz, 2H, 13,15-H), 7.377(s, 1H, 11-H), 7.218(s, 1H, 10-H), 7.197(s, 1H, 3-H), 7.155(d,J=7.8 Hz, 1H, 2-H), 7.087(d,J=12 Hz, 1H, 1-H), 6.096~5.981(m, 2H, 5,8-H), 5.201~5.101(m, 4H, 6,7-H), 3.499(d,J=10.2 Hz, 2H, 4-H), 3.455(d,J=9 Hz, 2H, 9-H); IRν: 3 365(OH), 1 620(CH=N), 1 333(S=O), 1 157(S=O) cm-1; MSm/z: 447.16[M-]。
2,2-二(N-甘氨酸)-厚朴酚甲亚胺(4): 黄色固体,产率55%; UV-Visλmax: 215, 296, 423 nm;1H NMRδ: 8.432(s, 2H, 11,13-H), 7.267(s, 2H, 1,10-H), 7.209(s, 2H, 2,9-H), 6.076~5.976(m, 2H, 4,7-H), 5.152~5.067(m, 4H, 5,6-H), 4.284(s, 4H, 12,14-H), 3.392(s, 4H, 3,8-H); IRν: 3 422(OH), 1 634(CH=N) cm-1; MSm/z: 434.15[M2-]。
1.3 生物活性测试
(1) 配制不同浓度的3a DMSO溶液,按文献[8]方法测试其对成肌细胞的毒性。
(2) 分别配制不同浓度的厚朴酚和3d DMSO溶液,运用HPLC与LS/MS检测其同各个酶特异探针底物温孵反应[9]后代谢产物的改变,评价其对人源性CYP1A2, CYP2E1, CYP3A4, CYP2C9和CYP2D6的酶活性影响变化[10]。
2 结果与讨论
2.1 厚朴酚的Reimer-Tiemann反应
一般认为,Reimer-Tiemann法是酚类在相转移等催化剂及氢氧化钠存在下,氯仿生成 ∶CCl2,进而进攻酚负离子,再发生质子位移,中间体水解后得邻位取代甲酰基的反应,产率一般在50%~70%[11]。厚朴酚通过R-T法合成1的产率只有24%,转化率较低。经过仔细分析,我们认为这是因为在厚朴酚的结构中有相邻的两个羟基(OH)存在,当二氯卡宾进攻酚负离子时,易形成原三酯类化合物A和B(Chart 1)。该类物质不易水解,aμmol·L-1,b非那西丁为底物,c氯唑沙宗为底物,d睾酮为底物,e甲苯磺丁脲为底物,f右美沙芬为底物。

表1 3a对成肌细胞的毒性实验结果
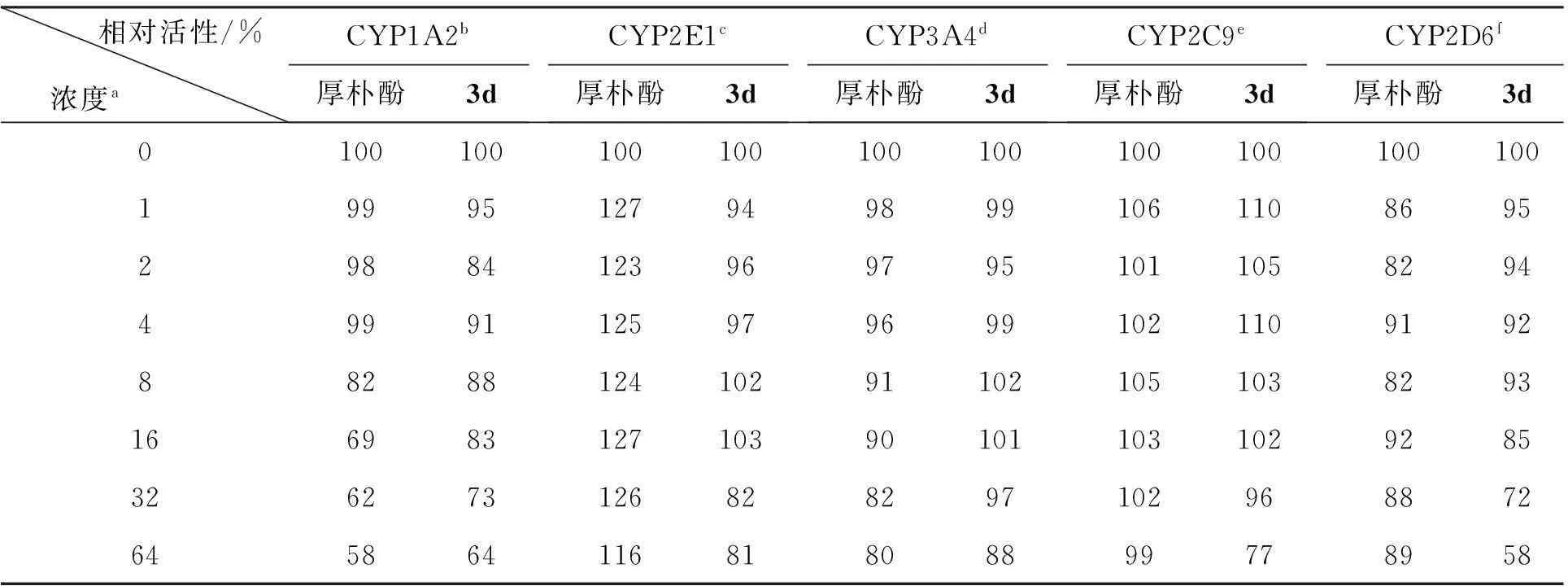
表2 厚朴酚和3d对CYP450酶系活性影响
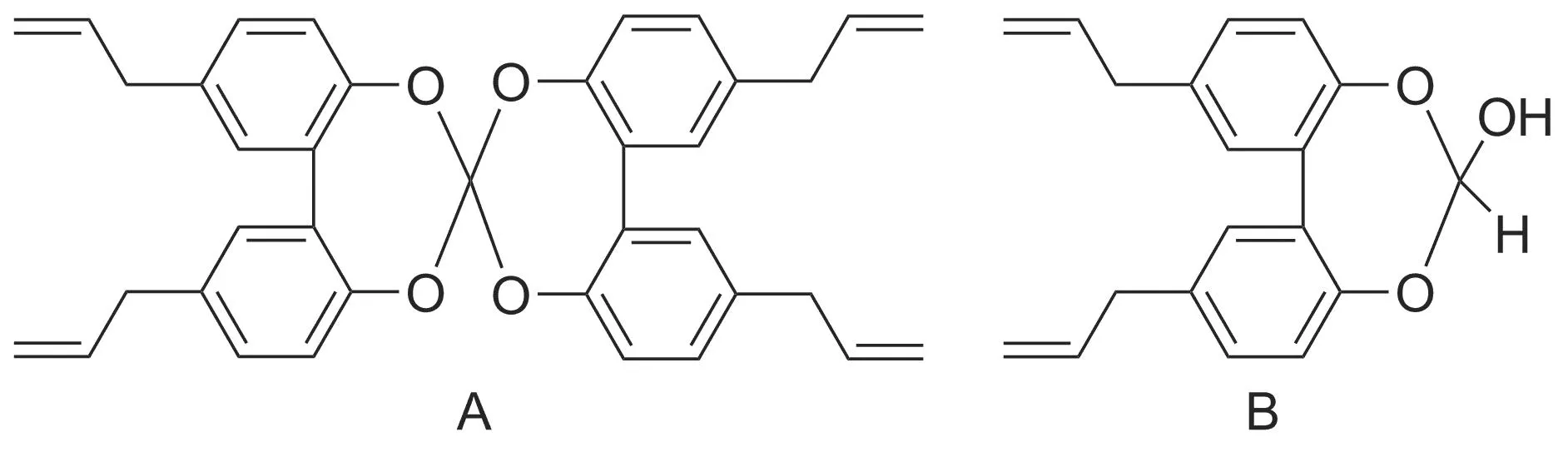
Chart 1
且阻止了Reimer-Tiemann反应在酚羟基邻位作用的中间体形成,降低了甲酰化的转化率,甚至得不到目标产物。而在和厚朴酚的分子结构中,不同苯环上的羟基相隔较远,不能形成类似A和B型化合物,能较顺利进行Reimer-Tiemann反应[6]。这也可能是和厚朴酚报道多却难见厚朴酚相关产物的一个原因。
另外,在实验过程中,NaOH溶液的浓度及反应结束时酸化条件对1的产率有较大影响。在碱浓度较低或酸化时pH过低,也会使副产物原甲酸三酚醛大量增加[12],并降低1的转化率。
2.2 生物活性
3a对成肌细胞的毒性实验结果[8]见表1。由表1可见,当3a浓度为10 μmol·L-1时,细胞存活率仅1/3,表明3a对成肌细胞的毒性较大。
在相同条件下,以厚朴酚为对照组,依次以特定的探针底物为观测对象,研究3d在不同浓度下对人肝脏CYP450酶系活性的影响[13],实验结果见表2。由表2可以看出,随着厚朴酚和3d浓度增大,CYP1A2, CYP2E1, CYP3A4, CYP2C9和CYP2D6的酶活性整体呈降低趋势,表明随着浓度提高,厚朴酚和3d酶活性抑制率逐渐加大。其中,3d对CYP2E1酶的活性抑制率明显强于厚朴酚;两者对于CYP3A4和CYP2C9酶的活性抑制率整体上较接近;在低浓度条件下(1 μmol·L-1, 2 μmol·L-1, 4 μmol·L-1), 3d对CYP1A2酶活性抑制率要强于厚朴酚,但在高浓度(8 μmol·L-1, 16 μmol·L-1, 32 μmol·L-1, 64 μmol·L-1)时则相反;但CYP2D6酶的情况却正好与CYP1A2酶相反。该研究结果表明,在厚朴酚结构中引入相应基团后,对其生物活性有明显影响。
3 结论
以厚朴酚为起始原料合成了4个单取代、1个二取代新型厚朴酚2-甲亚胺衍生物(3a~3d和4)。生物活性研究结果表明: 2-(N-甘氨酸)-厚朴酚甲亚胺(3a)对成肌细胞的毒性较大;2-[N-(4-氨磺酰苯基)]-厚朴酚甲亚胺(3d)浓度为64 μmol·L-1时,对CYP2D6和CYP1A2的抑制率分别为42.9%和36.8%。
[1] 陈笈,王伯初. 厚朴的药理研究进展[J].重庆大学学报:自然科学版,2005,28(9):136-139.
[2] 古练权. 生物化学[M].北京:高等教育出版社,2002,33-43.
[3] 崔艳华,张海玲. 磺胺类药物母核人工抗原的制备研究[J].卫生研究,2009,38(6):87-89.
[4] 马强,王超. 化妆品中21种磺胺类药物的高效液相色谱检测及质谱确证[J].分析测试学报,2008,27(z1):211-214.
[5] Zhao X J, Zhang L Y, Jin L M,etal. Synthesis and properties of the amino acid Schiff base[J].Chinese Jonmal of Organic Chemistry,2011,31(9)1516-1521.
[6] Luo Y F. Preparative purification of anti-tumor derivatives of honokiol by high-speed counter-current chromatography[J].Journal of Chromatography A,1178(2008):160-165.
[7] Ding X T, Zhang L, Ge Y. An abnormal Reimer-Tiemann reaction[J].Science Bulletin,1987,32(12):860-863.
[8] 张力,范明. 改良法体外培养大鼠成肌细胞的实验研究[J].军事医学科学院院刊,2007,31(1):62-65.
[9] Tassaneeyakul W, Birkett D J, Veronese M E,etal. Specificity of substrate and inhibitor probes for human cytochromes P450 1A1 and 1A2[J].J Pharmacol Exp Ther,1993,265:401-407.
[10] Daly A K, King B P. Pharmacogenetics of oral anticoagulants[J].Pharmacogenetics,2003,13(5):247-252.
[11] 段辉,张俊璠. 对Reimer-Tiemann反应的改进[J].海军工程大学学报,2000,5(94):99-101.
[12] 邬国英.水杨醛合成工艺改进[J].化学工程师,1988,(4):21-23.
[13] Distlerath L M,Reilly P E,Martin M V,etal.Purification and characterization of the human liver cytochromes P-450 involved in debrisoquine 4-hydroxylation and phenacetinO-deethylation,two prototypes for genetic polymorphism in oxidative drug metabolism[J].J Biol Chem,1985,260(15):9057-9067.
Synthesis and Biologial Activities of Novel Magnolol 2-Azomethine Derivatives
MEI Fan1a,1b, ZHAI Ting1a,1b, ZHENG Nian1a,1b,LI Yan1a,1b, CHEN Yong1a,1c, LOU Zhao-wen1a,1b*
(a. Organic Chemical Materials Collaborative Innovation Center in Hubei;b. Chemistry and Chemical Engineering; c. College of Life Sciences, 1. Hubei University, Wuhan 430062, China)
The formoxyl was introduced into the ortho-position of magnolol hydroxy by the Reimer-Tiemann method using magnolol as the raw material. Four novel mono-substituted and one bis substituted magnolol 2-azomethine derivatives were synthesized by reaction of the formylated magnolol with glycine, glutamic acid, arginine and sulfanilamide, respectively. The structures were characterized by UV-Vis,1H NMR, IR, MS and elemental analysis. The myoblast cell toxicity and the effects on CYPs in liver microsomesinvitrohuman were investigated. The results showed that 2-(N-glycine)-magnolol azomethine(3a) exhibited certain tomyoblasts toxicity. At 64 μmol·L-1, the inhibition rate of 2-[N-(4-sulfamoyl-phenyl)]-magnolol azomethine(3d) on CYP2D6 and CYP1A2 was 42.9% and 36.8%, respectively.
magnolol; amino acid; Reimer-Tiemann method; azomethine derivative; synthesis; biologial activity; myoblast; CYPs
2015-04-09; 修订日期: 2016-01-28
梅帆(1988-),男,汉族,湖北麻城人,硕士研究生,主要从事有机小分子的合成研究。 E-mail: 744955309@qq.com
娄兆文,教授, E-mail: 438208880@qq.com
O625.41
A
10.15952/j.cnki.cjsc.1005-1511.2016.04.15145
