帕金森病患者血清β-淀粉样蛋白1-42水平及其与病情的关系研究
2016-05-09梁若冰张小宁
梁若冰,雷 晶,张小宁
·论著·
帕金森病患者血清β-淀粉样蛋白1-42水平及其与病情的关系研究
梁若冰,雷 晶,张小宁
目的 了解帕金森病(PD)患者的血清β-淀粉样蛋白1-42(Aβ1-42)水平,并探讨其与病情的关系。方法 选取2014年5月—2015年5月到新疆医科大学第一附属医院神经内科就诊的PD患者108例为病例组;另选取同时期在本院体检中心进行体检的健康成年人108例为对照组。收集两组的一般资料,并检测其血清Aβ1-42水平。以病程、统一帕金森病评定量表(UPDRS)评分及Hoehn-Yahr(H-Y)分级判断PD患者的病情严重程度,分析血清Aβ1-42水平与病情的相关关系。结果 两组血清Aβ1-42水平比较,差异有统计学意义(P<0.05)。以性别分层,两组男性受试者的血清Aβ1-42水平比较,差异有统计学意义(P<0.05);而两组女性受试者的血清Aβ1-42水平比较,差异无统计学意义(P>0.05)。以年龄分层,两组≤60岁受试者的血清Aβ1-42水平比较,差异无统计学意义(P>0.05);两组>60岁受试者的血清Aβ1-42水平比较,差异有统计学意义(P<0.05)。以民族分层,两组汉族受试者的血清Aβ1-42水平比较,差异有统计学意义(P<0.05);两组维吾尔族受试者的血清Aβ1-42水平比较,差异无统计学意义(P>0.05)。早期和中晚期患者的血清Aβ1-42水平比较,差异无统计学意义(P>0.05)。Spearman秩相关分析显示,血清Aβ1-42水平与PD患者病程无相关性(rs=0.06,P>0.05);与UPDRS第Ⅰ部分评分(rs=-0.11,P>0.05)、第Ⅱ部分评分(rs=-0.09,P>0.05)、第Ⅲ部分评分(rs=0.10,P>0.05)无相关性;与H-Y分级呈负相关(rs=-0.25,P<0.05)。结论 PD患者血清Aβ1-42水平较低,血清Aβ1-42水平可能为PD临床诊断中的新型生物学指标,但尚不能作为病情严重程度的判断指标。
帕金森病;淀粉样蛋白;病情
梁若冰,雷晶,张小宁.帕金森病患者血清β-淀粉样蛋白1-42水平及其与病情的关系研究[J].中国全科医学,2016,19(10):1165-1169.[www.chinagp.net]
Liang RB,Lei J,Zhang XN.Level of serum β-amyloid protein 1-42 and its relationship with the disease severity of patients with Parkinson disease[J].Chinese General Practice,2016,19(10):1165-1169.
帕金森病(PD)是一种多发于中老年人,进展较为缓慢的神经系统退变性病变。截至2005年,我国的PD总患病人数已超过172万[1];预计到2050年将增加至近800万[2]。PD患者不仅会出现静止性震颤、肌肉强直、运动迟缓、姿势步态异常等运动症状,也常常会出现嗅觉减退、精神异常、认知功能减退等非运动症状。目前,临床上对于PD的诊断主要根据典型临床症状及对左旋多巴治疗有效,存在一定的诊断错误率,且当PD患者出现特异性临床症状时其脑内退行性病变已不可逆转。PD患者的病程较长,当前治疗多为改善患者的临床症状,尚不能治愈,因此PD的临床治疗一直是国内外相关领域的研究热点。有研究显示,检测患者的脑脊液(cerebrospinal fluid,CSF)β-淀粉样蛋白1-42 (Aβ1-42)水平有利于PD诊断[3-4],但国内关于Aβ1-42水平与PD关系的研究较少。本研究旨在了解PD患者的血清Aβ1-42水平,并探讨其与患者病情的相关关系,以期为寻找与PD诊断有关的生物学指标及PD的早期干预提供依据。
1 对象与方法
1.1 研究对象 选取2014年5月—2015年5月到新疆医科大学第一附属医院神经内科就诊的PD患者108例为病例组。诊断标准参照英国帕金森病协会制定的《脑库帕金森病临床诊断标准》[5]。纳入标准:(1)病历资料完整;(2)无PD家族史。排除标准:(1)脑血管病、脑炎、创伤及药物等导致的PD综合征、PD叠加综合征患者;(2)阿尔茨海默病、血管性痴呆等其他智能障碍综合征患者。另选取同时期在本院体检中心进行体检的健康成年人108例为对照组。研究通过了新疆医科大学第一附属医院伦理中心的批准,研究前患者及其家属均签署知情同意书。
1.2 研究方法 收集两组的一般资料,并检测其血清Aβ1-42水平。以病程、统一帕金森病评定量表(UPDRS)[6]评分及Hoehn-Yahr(H-Y)分级判断PD患者的病情严重程度,分析血清Aβ1-42水平与病情的相关关系。
1.2.1 一般资料收集 通过查阅电子病历和体检档案,收集两组的一般资料,包括性别、年龄、民族及病例组患者的病程。
1.2.2 血清Aβ1-42水平检测 分别于病例组入院次日和对照组体检当日的清晨,抽取两组空腹外周静脉血5 ml。采用HC-2518高速离心机(科大创新股份有限公司中佳分公司生产),在4 ℃下,以3 000 r/min离心10 min。分离上清液,分装于0.5 ml离心管中,置于-80 ℃冰箱中保存。待样本收集齐后,统一解冻。采用人血清Aβ1-42 ELISA检测试剂盒(武汉华美公司生产),严格按照产品说明书进行Aβ1-42检测的预试验和正式试验。采用BIO-RAD全波长酶标仪在450 nm波长处读取标准样品的相应光密度(OD)值,代入Curve Expert 1.3软件得出标准曲线方程,根据样本OD值获得相应Aβ1-42水平。
1.2.3 UPDRS评分 由经过统一培训的神经内科医务人员,在PD患者处于安静状态下的“开期(症状缓解)”,对其进行UPDRS评分。UPDRS共分为6部分,本研究主要选用其中的第Ⅰ、Ⅱ、Ⅲ、Ⅴ部分。(1)第Ⅰ部分为精神、行为及情绪,用于判断PD患者的精神活动和情感障碍;第Ⅱ部分为日常生活活动,用于判断PD患者的日常生活能力;第Ⅲ部分为运动检查,用于判断PD患者的运动功能。各项目均分为5个等级,计分为0~4分,其中0分表示正常,分数越高表示症状越重。(2)第Ⅴ部分为H-Y分级,用于判断PD患者的疾病发展程度。0级=无疾病体征;1级=单侧肢体症状;1.5级=单侧肢体+躯干症状;2级=双侧肢体症状,无平衡障碍;2.5级=轻度双侧肢体症状,后拉试验可恢复;3级=轻至中度双侧肢体症状,平衡障碍,保留独立能力;4级=严重障碍,在无协助的情况下仍能行走或站立;5级=患者限制在轮椅或床上,需人照料。以H-Y分级<3级为疾病早期,以H-Y分级≥3级为疾病中晚期。
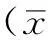
2 结果
2.1 两组一般资料比较 两组性别、年龄及民族比较,差异无统计学意义(P>0.05,见表1)。
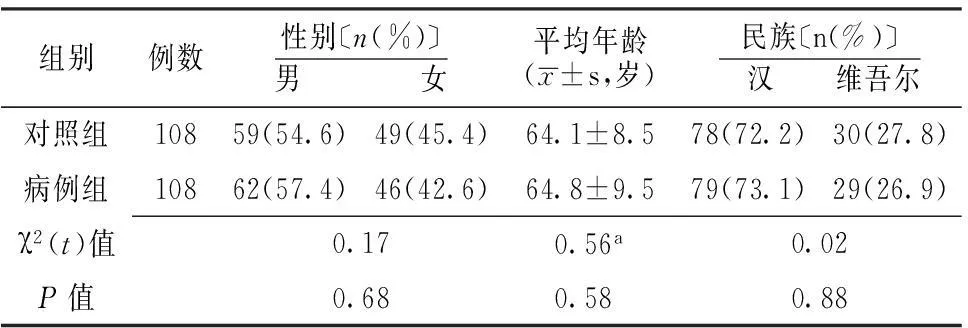
表1 两组一般资料比较
注:a为t值
2.2 两组血清Aβ1-42水平比较 对照组和病例组的血清Aβ1-42水平分别为(1.18±0.45)和(1.02±0.47) μg/L,两组比较,差异有统计学意义(t=2.56,P<0.05)。以性别分层,两组男性受试者的血清Aβ1-42水平比较,差异有统计学意义(P<0.05);两组女性受试者的血清Aβ1-42水平比较,差异无统计学意义(P>0.05)。以年龄分层,两组≤60岁受试者的血清Aβ1-42水平比较,差异无统计学意义(P>0.05);两组>60岁受试者的血清Aβ1-42水平比较,差异有统计学意义(P<0.05)。以民族分层,两组汉族受试者的血清Aβ1-42水平比较,差异有统计学意义(P<0.05);两组维吾尔族受试者的血清Aβ1-42水平比较,差异无统计学意义(P>0.05,见表2)。
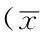
Table2ComparisonofserumAβ1-42levelamongsubjectswithdifferentdemographicdata

一般资料例数对照组病例组t值P值性别 男1211.23±0.531.05±0.442.030.04 女951.12±0.330.98±0.511.630.11年龄 ≤60岁691.07±0.311.18±0.660.370.71 >60岁1471.24±0.500.95±0.354.14<0.01民族 汉1571.05±0.360.90±0.322.860.01 维吾尔591.50±0.511.34±0.641.070.29
注:Aβ1-42=β-淀粉样蛋白1-42
2.3 PD患者的病情 PD患者的平均病程为(3.85±3.97)年;UPDRS第Ⅰ部分平均评分为(2.31±1.88)分,第Ⅱ部分平均评分为(16.89±7.62)分,第Ⅲ部分平均评分为(36.54±16.12)分;H-Y分级显示为早期患者50例(46.3%),中晚期患者58例(53.7%)。
2.4 PD患者血清Aβ1-42水平与病情的关系 早期患者的血清Aβ1-42水平为(1.04±0.45) μg/L,中晚期患者的血清Aβ1-42水平为(0.99±0.50) μg/L,两者比较,差异无统计学意义(t=0.51,P>0.05)。Spearman秩相关分析显示,血清Aβ1-42水平与PD患者病程无相关性(rs=0.06,P>0.05);与UPDRS第Ⅰ部分评分(rs=-0.11,P>0.05)、第Ⅱ部分评分(rs=-0.09,P>0.05)、第Ⅲ部分评分(rs=0.10,P>0.05)无相关性;与H-Y分级呈负相关(rs=-0.25,P<0.05)。
3 讨论
淀粉样前体蛋白(APP)是β-淀粉样蛋白(Aβ)的前体蛋白。该蛋白基因主要在大脑中表达,外周多种细胞中也均有表达,如血管内皮细胞和血小板[7]。生理情况下,脑内Aβ的生成和降解处于动态平衡,主要依靠β-分泌酶途径生成胰岛素降解酶和脑啡肽酶。同时,血-脑脊液屏障上Aβ可以通过内向转运和外向转运维持脑与外周血的Aβ水平平衡,其中起重要作用的是低密度脂蛋白受体相关蛋白1和高级糖基化终产物受体(RAGE)。前者负责将Aβ外向转运至血液,后者进行内向转运至脑内,当两者转运和表达失衡时,可引起Aβ的异常聚集和沉淀。当编码APP的基因发生突变或其他原因导致β-分泌酶活性异常增高时,APP则容易被β-分泌酶与γ-分泌酶共同切割产生Aβ,主要生成Aβ1-40和Aβ1-42两种形式,Aβ1-42亚型虽含量远低于Aβ1-40,但其更容易聚集,且神经毒性更强。
PD的典型病理特征为中脑黑质致密部多巴胺(dopamine,DA)能神经元变性缺失,张巍等[8]通过研究发现,Aβ可以导致DA能神经元进行性变性,明显改变DA能神经元形态,呈剂量依赖性。体外细胞培养显示,一定浓度的Aβ1-42可以诱导产生一氧化氮(NO),从而诱导炎性级联反应和氧化应激反应,损伤蛋白质及膜性结构,导致神经元坏死或凋亡,这一结论符合PD的神经炎性学说[9]。这些研究均提示,Aβ1-42参与了PD的病理变化。
近年来,Aβ1-42成为国内外关于神经系统退变性疾病生物学标志物的研究热点,尤其是在PD方面。国际研究结果显示,PD患者CSF中的Aβ1-42水平低于健康对照者[3,10-11];但也有研究结果显示,并未发现PD患者和健康对照者的CSF中的Aβ1-42水平存在差异[12]。Maetzler等[13]发现,在13名PD伴阿尔茨海默病患者的血清中,Aβ1-42天然自身抗体的水平高于对照组,但两者间差异无统计学意义[14]。本研究结果显示,病例组患者的血清Aβ1-42水平低于对照组。由于Aβ1-42可引起血-脑脊液屏障渗透性增强,紧密连接蛋白损伤,上调RAGE作用[15],使得血脑屏障上Aβ1-42内向转运多于外向转运,患者脑内Aβ1-42水平异常升高,形成聚集沉积,而外周血中的Aβ1-42水平相应减少。临床和流行病学研究结果显示,雌激素具有神经保护功能[16];一项大鼠实验的研究结果显示,雌激素可以减少Aβ的神经毒性,对大脑中的过量Aβ有清除作用[17]。这可能部分解释了本研究中男性PD患者的血清Aβ1-42水平较对照组男性低,而两组女性受试者比较,差异无统计学意义的结果。同时,本研究结果也显示,年龄>60岁PD患者的血清Aβ1-42水平低于同年龄层对照组受试者。既往研究也显示,血清Aβ1-42水平降低与Aβ1-42聚集沉积和年龄有相关性[12],提示年龄越大,Aβ1-42越容易聚集,不可溶性Aβ1-42增多,可溶性Aβ1-42减少。另外,本研究发现汉族PD患者的血清Aβ1-42水平较汉族对照组低,而两组维吾尔族受试者比较,差异无统计学意义。这可能与本研究纳入的维吾尔族样本量较少有关,提示进一步的研究应注意扩大各族患者的样本量。
目前,临床上常根据患者的临床症状严重程度,按照H-Y分级将PD病程分为早期和中晚期。本研究结果显示,中晚期PD患者的血清Aβ1-42水平较早期患者低,但两者比较差异无统计学意义。由于PD晚期患者的皮质和海马区常同时存在Aβ和α-突触核蛋白(α-Syn)异常聚集,随PD病程进展,低聚性Aβ损伤血-脑脊液屏障,内向转运增强,CSF中可溶性Aβ减少,这可能是血清Aβ1-42水平降低的原因之一。本研究结果还显示,PD患者血清Aβ1-42水平与UPDRS第Ⅰ、Ⅱ、Ⅲ部分评分均无相关性,推测可能是因为精神、情感及运动的脑病变部位不同,对Aβ1-42的反应机制也不同,但具体原因仍需进一步研究。既往研究结果显示,病程较长PD患者的CSF中Aβ1-42水平较健康对照者低[18],而本研究结果显示,PD患者的血清Aβ1-42水平与病程无相关性。但血清Aβ1-42水平与H-Y分级呈负相关,表明随H-Y分级的增加,PD患者血清Aβ1-42水平会降低。Shi等[19]关于PD患者病程进展的纵向研究结果显示,PD患者CSF中的Aβ1-42水平与PD严重程度呈正相关。说明血清Aβ1-42水平可能是诊断PD的新型生物学指标,但其诊断价值仍有待于进一步研究证实。
综上所述,PD自发现到现在已有近两个甲子的研究历史,国内外研究者均致力于联合多种族、多地区探索新的、有意义的生物学标志物,但由于其机制复杂,仍未能发现特异性指标。本研究结果表明,PD患者的血清Aβ1-42水平低于对照组,特别是男性、年龄>60岁及汉族患者;病情较重患者的血清Aβ1-42水平较低。本研究为初步横断面研究,未来的研究应对患者进行跟踪随访,并进行纵向比较研究,以明确血清Aβ1-42水平在PD诊断和病情评估中的临床价值。
作者贡献:梁若冰进行资料收集、试验实施、撰写论文、成文并对文章负责;雷晶进行试验设计与实施、评估;张小宁进行质量控制与审校。
本文无利益冲突。
[1]Rocca WA.Prevalence of Parkinson′s disease in China[J].Lancet Neurol,2005,4(6):328-329.
[2]Zhang LJ,Shao HT,Wang YX,et al.Progress in Parkinson′s disease[J].Chinese Bulletin of Life Sciences,2014,26(6):560-570.(in Chinese)
张丽娟,邵海涛,王跃秀,等.帕金森病研究进展[J].生命科学,2014,26(6):560-570.
[3]Kang JH,Irwin DJ,Chen-Plotkin AS,et al.Association of cerebrospinal fluid β-amyloid 1-42,T-tau,P-tau181,and α-synuclein levels with clinical features of drug-naive patients with early Parkinson disease[J].JAMA Neurol,2013,70(10):1277-1287.
[4]Xu XH,Ma CM,Han YZ,et al.β-amyloid precursor protein expression level in peripheral platelets in patients with Parkinson′s disease and dementia[J].Chinese General Practice,2015,18(21):2507-2510.(in Chinese)
许晓辉,马聪敏,韩月珍,等.帕金森病痴呆患者外周血血小板β淀粉样前体蛋白表达水平研究[J].中国全科医学,2015,18(21):2507-2510.
[5]Joutsa J,Gardberg M,Röyttä M,et al.Diagnostic accuracy of parkinsonism syndromes by general neurologists[J].Parkinsonism Relat Disord,2014,20(8):840-844.
[6]统一帕金森病评定量表[J].中华老年医学杂志,1999,18(1):61-62.
[7]Hansson O,Stomrud E,Vanmechelen E,et al.Evaluation of plasma Aβ as predictor of Alzheimer′s disease in older individuals without dementia:a population-based study[J].J Alzheimers Dis,2012,28(1):231-238.
[8]Zhang W,Wang YJ,HONG JS,et al.A mechanistic study of parkinson disease-like clinical characteristics in patients with Alzheimer disease[J].Chinese Journal of Neuroimmunology and Neurology,2008,15(5):334-338.(in Chinese)
张巍,王拥军,Jau-shyong HONG,等.阿尔茨海默病患者表现帕金森病样临床特征的机制[J].中国神经免疫学和神经病学杂志,2008,15(5):334-338.
[9]Qi FT,Zhang XW,Tong YP,et al.Clinical studies on autonomic dysfunction in patients with newly diagnosed Parkinson disease[J].Chinese General Practice,2014,17(9):1001-1004.(in Chinese)
戚飞腾,章小微,童洋萍,等.帕金森病初诊患者自主神经功能障碍临床研究[J].中国全科医学,2014,17(9):1001-1004.
[10]Bibl M,Mollenhauer B,Esselmann H,et al.CSF amyloid-beta-peptides in Alzheimer′s disease,dementia with Lewy bodies and Parkinson′s disease dementia[J].Brain,2006,129(Pt 5):1177-1187.
[11]Zhang J,Sokal I,Peskind ER,et al.CSF multianalyte profile distinguishes Alzheimer and Parkinson diseases[J].Am J Clin Pathol,2008,129(4):526-529.
[12]Bekris LM,Tsuang DW,Peskind ER,et al.Cerebrospinal fluid Aβ42 levels and APP processing pathway genes in Parkinson′s disease[J].Mov Disord,2015,30(7):936-944.
[13]Maetzler W,Berg D,Synofzik M,et al.Autoantibodies against amyloid and glial-derived antigens are increased in serum and cerebrospinal fluid of Lewy body-associated dementias[J].J Alzheimers Dis,2011,26(1):171-179.
[14]Maerzler W,Anja A,Markus L,et al.Comparable autoantibody serum levels against amyloid-and inflammation-association proteins in Parkinson′s disease patients and controls[J].PLoS One,2014,9(2):e88604.
[15]Wan W,Cao L,Liu L,et al.Aβ(1-42) oligomer-induced leakage in an in vitro blood-brain barrier model is associated with up-regulation of RAGE and metalloproteinases,and down-regulation of tight junction scaffold proteins[J].J Neurochem,2015,134(2):382-393.
[16]Currie LJ,Harrison MB,Trugman JM,et al.Postmenopausal estrogen use affects risk for Parkinson disease[J].Arch Neurol,2004,61(6):886-888.
[17]Guo R,Cao YP.Eliminating effect of estrogen on β amyloid protein of rat hippocampus[J].Chinese Journal of Gerontology,2010,9(30):2602-2604.(in Chinese)
郭蓉,曹云鹏.雌激素对大鼠海马β-淀粉样蛋白的清除作用[J].中国老年学杂志,2010,9(30):2602-2604.
[18]Maetzler W,Liepelt I,Berg D,et al.Progression of Parkinson′s disease in the clinical phase:potential markers[J].Lancet Neurol,2009,8(12):1158-1171.
[19]Shi M,Bradner J,Hancock AM,et al.Cerebrospinal fluid biomarkers for Parkinson disease diagnosis and progression[J].Ann Neurol,2011,69(3):570-580.
Level of Serum β-amyloid Protein 1-42 and Its Relationship With the Disease Severity of Patients With Parkinson Disease
LIANGRuo-bing,LEIJing,ZHANGXiao-ning.DepartmentofNeurology,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China
Objective To investigate the level of serum β-amyloid protein 1-42(Aβ1-42) and its relationship with the disease status of patients with Parkinson disease(PD).Methods A total of 108 PD patients who received treatment in the Department of Neurology of the First Affiliated Hospital of Xinjiang Medical University from May 2014 to May 2015 were enrolled as case group.We also enrolled 108 healthy adults who received physical examination in the physical examination center of the hospital during the same period as control group.General data of the two groups were collected,and serum Aβ1-42 level was detected.The disease severity of these PD patients were determined by length of disease,Unified PD Rating Scale(UPDRS) score and Hoehn-Yahr(H-Y) grading,and the correlation between serum Aβ1-42 level and disease severity was investigated.Results The two groups were significantly different in serum Aβ1-42 level(P<0.05).With gender stratification,the two groups were significantly different in the serum Aβ1-42 level of male subjects(P<0.05),and the two groups were significantly different in the serum Aβ1-42 level of female subjects(P>0.05).With age stratification,the two groups were not significantly different in the serum Aβ1-42 level of patients aged ≤60(P>0.05),and the two groups were significantly different in the serum Aβ1-42 level of patients aged >60(P<0.05).With nationality stratification,the two groups were significantly different in the serum Aβ1-42 level of Han subjects(P<0.05),and the two groups were not significantly different in the serum Aβ1-42 level of Uygur subjects(P>0.05).Patients at early stage and patients at middle and late stage were not significantly different in serum Aβ1-42 level(P>0.05).Spearman correlation analysis showed that serum Aβ1-42 level had no correlation with the length of disease of PD patients(rs=0.06,P>0.05),had no correlation with part Ⅰ score(rs=-0.11,P>0.05),part Ⅱ score(rs=-0.09,P>0.05),part Ⅲ score of UPDRS(rs=0.10,P>0.05),and had negative correlation with H-Y grading(rs=-0.25,P<0.05).Conclusion PD patients have lower serum Aβ1-42 level,and serum Aβ1-42 level may become a new biological index for the clinical diagnosis of PD,but can not be used as a diagnostic index for disease severity.
Parkinson disease;Amyloid;Disease severity
新疆维吾尔自治区高技术研究发展项目(201417101)
830054 新疆维吾尔自治区乌鲁木齐市,新疆医科大学第一附属医院神经内科
张小宁,830054 新疆维吾尔自治区乌鲁木齐市,新疆医科大学第一附属医院神经内科;E-mail:zxn-1960@163.com
R 742.5
A
10.3969/j.issn.1007-9572.2016.10.013
2015-12-05;修回日期:2016-02-18)
王凤微)
