酸性成纤维细胞生长因子保护庆大霉素对海马星形胶质细胞毒性作用的分裂原活化蛋白激酶通路机制①
2016-04-25黄巨恩黄太萍李校堃
沈 丽,黄巨恩,黄太萍,沈 慧,李校堃
酸性成纤维细胞生长因子保护庆大霉素对海马星形胶质细胞毒性作用的分裂原活化蛋白激酶通路机制①
沈丽1,黄巨恩1,黄太萍1,沈慧1,李校堃2
[摘要]目的探讨酸性成纤维细胞生长因子(aFGF)对庆大霉素损伤的海马星形胶质细胞保护作用可能的机制。方法新生24 h Sprague-Dawley大鼠分离、纯化海马星形胶质细胞,胶质纤维酸性蛋白(GFAP)免疫荧光染色鉴定,传3代细胞接种于24孔培养板培养3 d,分为3组:对照组正常培养,损伤组以2.0 g/L庆大霉素培养24 h,保护组加入4.25 μg/L aFGF培养24 h后再加入2.0 g/L庆大霉素培养24 h。Western blotting检测P38、细胞外信号调节蛋白激酶(ERK)1、ERK2、c-Jun氨基末端激酶(JNK)1、JNK2的表达。结果成功培养细胞,纯度>95%。与对照组比较,损伤组ERK1表达增加(P<0.05);保护组与损伤组比较,P38表达增加(P<0.05),ERK1表达减少(P<0.05);其余两两比较均无显著性差异(P>0.05)。结论信号通路中的P38和ERK1可能在aFGF对抗庆大霉素诱导的海马星形胶质细胞损伤过程中发挥作用。
[关键词]酸性成纤维细胞生长因子;分裂原活化蛋白激酶;庆大霉素;星形胶质细胞;海马;大鼠
[本文著录格式]沈丽,黄巨恩,黄太萍,等.酸性成纤维细胞生长因子保护庆大霉素对海马星形胶质细胞毒性作用的分裂原活化蛋白激酶通路机制[J].中国康复理论与实践,2016,22(3):270-273.
CITED AS:Shen L,Huang JE,Huang TP,et al.Effects of acidic fibroblast growth factor on hippocampal astrocytes injury induced by gentamicin:role of mitogen-activated protein kinase signal pathway[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(3):270-273.
作者单位:1.广西医科大学护理学院,广西南宁市530021;2.温州医学院生物与天然药物研究院,浙江温州市325027。作者简介:沈丽(1987-),女,汉族,湖北十堰市人,硕士研究生,护师,主要研究方向:创伤护理。通讯作者:黄巨恩,男,广西南宁市人,博士,教授,硕士研究生导师,主要研究方向:创伤护理。E-mail:hje5810@163.com。
酸性成纤维细胞生长因子(acidic fibroblast growth factor,aFGF)是一种具有多方面功能的活性蛋白,多存在于肾脏和脑组织中,是血管内皮细胞、成纤维细胞、成肌细胞、角膜细胞、神经细胞及星形胶质细胞等生长的刺激因子,对来源于中胚层和神经外胚层的细胞具有广泛的生物学效应[1]。
庆大霉素属于氨基糖苷类抗生素,能损害神经系统和肾脏;神经元损伤前会使星形胶质细胞受损[2-3]。本研究建立海马星形胶质细胞损伤模型,在之前研究的基础上[4-6],检测分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路中的P38、细胞外信号调节蛋白激酶(extracellular signal-regulated kinase,ERK)1、ERK2、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)1、JNK2的表达情况,研究MAPK信号通路在aFGF对庆大霉素诱导的海马星形胶质细胞保护作用过程中的机制。
1材料和方法
1.1材料
新生24 h内Sprague-Dawley大鼠由广西医科大学实验动物中心提供,合格证号SCXK(桂)2012-0002。DMEM-HG、胎牛血清由维森特公司提供。胰蛋白酶由美国GIBCO公司提供。抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体由ABCAM公司提供。抗兔二抗由中杉金桥公司提供。硫酸庆大霉素由广东南国药业有限公司提供。aFGF由暨南大学生物工程研究所提供,批号20130401。磷酸酶抑制剂、BCA法蛋白含量检测试剂盒由南京凯基生物发展有限公司提供。蛋白预染Marker由美国THERMO公司提供。RIPA裂解液、一抗稀释液由碧云天公司提供。HRP标记的GAPDH优质内参(1∶10000)由上海康成生物提供。显影粉由天津市世纪奥博商贸有限公司提供。
酶标仪为赛默飞世尔(上海)仪器有限公司产品。电泳仪为北京百晶生物技术有限公司产品。高速离心机为珠江黑马公司产品。超声仪细胞破碎仪为宁波新芝生物科技股份有限公司产品。暗室灯、暗匣为广东粤华医疗器械厂有限公司产品。
1.2方法
1.2.1海马星形胶质细胞的分离和培养
采用黄太萍等星形胶质细胞培养方法[7]。新生大鼠分离出海马组织,剔除脑膜、血管,将海马组织剪成小块,转入离心管中,加入37℃复温30 min,终浓度为0.125%的胰蛋白酶,恒温水浴15 min消化,含10%胎牛血清DMEM-HG培养液终止。1000 r/min离心5 min,弃上清。5×105/ml接种于含10%胎牛血清的DMEM-HG培养液中。37℃、5% CO2培养箱中培养7~9 d;待细胞70%~80%汇合时传代纯化,传至第3代的细胞用于实验。
1.2.2海马星形胶质细胞的鉴定
将传3代的细胞接种在6孔板内,置于培养箱中24 h贴壁后,以4%多聚甲醛固定,PBS漂洗。加入1 ∶200兔抗GFAP多克隆抗体,4℃孵育过夜,加入二抗,PBS洗3遍(按试剂盒说明书操作)。加入DAPI染核,用含抗荧光淬灭剂的封片液封片后,共聚焦显微镜下观察显色结果,阳性细胞胞质呈绿色荧光。取5个不同的视野,计数阳性细胞占所有细胞的比例。阴性对照用PBS代替一抗,其余步骤相同。
1.2.3 Western blotting检测
将传3代处于对数生长期的细胞接种于24孔培养板培养3 d,分为对照组、损伤组和保护组。对照组正常培养;损伤组加入2.0 g/L庆大霉素培养24 h;保护组加入4.25 μg/L aFGF培养24 h后,再加入2.0 g/L庆大霉素培养24 h。
常规提取细胞蛋白。分别收集各组细胞,1000 r/min离心5 min,去上清,向细胞沉淀中加入RIPA裂解液,4℃裂解;1000 r/min离心5 min,取上清液至新离心管中。BCA法测定蛋白浓度。80 V恒压电泳至溴酚蓝至分离胶,120 V恒压电泳至溴酚蓝刚出胶底部,4℃转膜2 h,封闭2 h,加入兔抗大鼠P38、ERK1、ERK2、JNK1、JNK2一抗(1∶1000),二抗(羊抗兔IgG,1∶20000),37℃孵育,ECL染色,压片曝光显影,定影。采用Lab Works 4.6图像分析软件采集图像,以HRP标记的GAPDH为内参,Quantity One记算各组目的蛋白及内参蛋白的灰度比值。
1.3统计学分析
采用SPSS 16.0统计软件分析处理。多组均数比较采用单因素方差分析(One-way ANOVA),两两比较采用SNK q检验。显著性水平α=0.05。
2结果
2.1鉴定
培养24 h后可观察到大部分细胞贴壁且折光性较好,部分细胞伸展并长出细小突起。培养3~5 d后细胞数目增多,细胞胞体变大,分支增多且突起相互交织成网状。培养7~10 d后细胞基本汇合并铺满瓶底。进行传代纯化得到第3代细胞。GFAP免疫荧光染色可见星形胶质细胞胞质呈绿色荧光,阳性细胞比例>95%,可用于下一步实验研究。
2.2 Western blotting检测
对照组较损伤组ERK1表达增加(P<0.05),保护组较损伤组P38表达增加、ERK1表达减少(P<0.05)。其余蛋白两两比较均无显著性差异(P>0.05)。见表1。
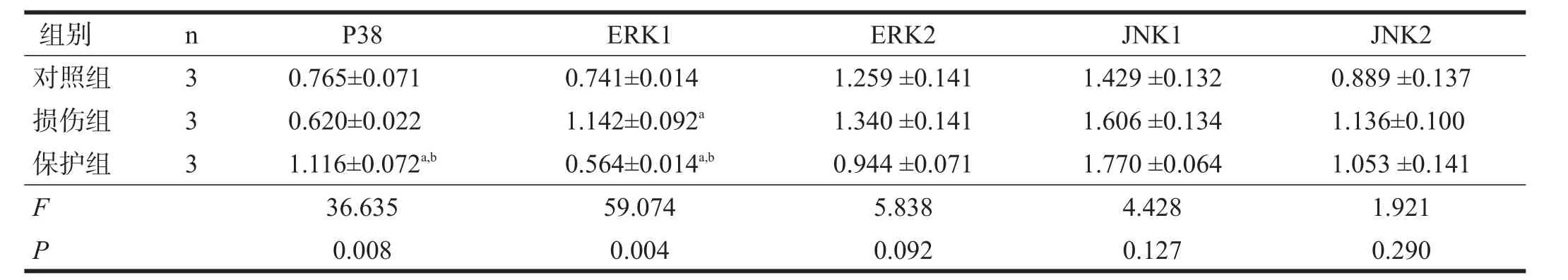
表1 Western blotting检测各组蛋白的表达(相对灰度)
3讨论
大鼠海马星形胶质细胞的培养受很多因素的影响。实验发现之前的方法[8-11]培养的细胞质量不高,采用黄太萍等[7]胰蛋白酶消化组织块分离培养法获得纯度高、生长状态好且成本较低的星形胶质细胞。我们既往的研究[4-6]证明,4.25 μg/L aFGF能保护庆大霉素诱导的海马星形胶质细胞操作,因此本实验亦采用4.25 μg/L aFGF。
星形胶质细胞广泛存在于哺乳动物脑内,能调节神经元代谢,参与脑损伤后的修复过程以及记忆的形成过程,具有营养、支持神经元的功能,在脊髓损伤早期起修复作用,晚期对损伤修复有抑制作用[12-16]。星形胶质细胞与神经元的相互作用对中枢神经系统内环境稳态、可塑性以及神经信息传递、诱导神经干细胞增殖分化有较大影响[17-19]。
aFGF是强促有丝分裂原,具有促有丝分裂和非促有丝分裂两大类型生物学活性,不仅可促进组织细胞分裂、增殖,还能促进创伤修复,舒张血管,保护神经、心肌、局部缺血等[20-24]。
MAPK是一组能被不同的细胞外刺激激活的丝氨酸-苏氨酸蛋白激酶。哺乳动物细胞MAPK通路主要包括P38 MAPK通路、ERK通路和JNK通路[25]。ERK蛋白条带分为ERK1和ERK2两个亚带,JNK蛋白条带也分为JNK1和JNK2两个亚带。研究表明,P38通路和JNK通路在炎症反应、神经系统进行性病变和细胞凋亡中发挥重要作用[26]。ERK信号通路参与调节有丝分裂、增殖、分化和哺乳动物细胞发育的过程[27]。MAPK通路参与调节多种重要的细胞生理、病理过程,促进神经损伤的修复[28]。
aFGF的生物学功能与MAPK信号转导通路以及受体的结合有着密切关系。aFGF促进大鼠肠上皮细胞增殖,与其激活MAPK信号通路有关[29]。aFGF通过ERK途径将信号导入细胞内,引起特定的生物学效应,发挥保护神经元和促进细胞增殖的作用[30-31]。aFGF启动的MAPK信号通路对多种细胞趋化应答、分化、分裂起重要作用,尤其在神经细胞和成纤维细胞的生长发育方面,是细胞增殖、分化等信息传递途径的交集点和共同通路[32]。
本实验通过体外培养的海马星形胶质细胞建立药物损伤模型,研究aFGF对庆大霉素诱导的海马星形胶质细胞损伤保护作用过程中的机制,为临床上安全有效使用氨基糖苷类药物奠定基础。本研究显示,庆大霉素可能通过激活ERK1损伤海马星形胶质细胞;aFGF可能通过P38和ERK1途径对庆大霉素诱导的海马星形胶质细胞发挥保护作用。ERK2、JNK1、JNK2途径意义不明显。
aFGF的保护作用是一个复杂的病理生理过程,本研究未进一步研究不同浓度下aFGF的保护作用机制有无变化,以及aFGF是否通过其他的信号通路发挥保护作用。有待在今后的研究中做更深入的探讨。
[参考文献]
[1]黄荔,张庆平.AFGF及其改构体对视神经保护的研究进展[J].广西医科大学学报,2006,23(4):690-692.
[2]刘春英,黄巨恩,吴世芬,等.aFGF对庆大霉素所致海马星形胶质细胞损害的保护作用[J].广东医学,2011,32(21):2781-2782.
[3]杨月明,王瑜歆,马辉.2847例药物神经损害病例报告分析[J].中国药物警戒,2009,6(9):543-545.
[4]刘春英,黄巨恩,吴世芬,等.酸性成纤维细胞生长因子对庆大霉素诱导的海马星形胶质细胞MDA、NO、SOD、GSH-Px的影响[J].广西医科大学学报,2012,29(1):4-6.
[5]刘海燕,刘春英,黄巨恩,等.aFGF对新生大鼠海马星形胶质细胞存活与增殖的影响[J].现代预防医学,2013,40(18):3451-3456.
[6]黄太萍.aFGF对庆大霉素诱导的海马星形胶质细胞凋亡的影响[D].南宁:广西医科大学,2015.
[7]黄太萍,黄巨恩,沈丽.体外原代星形胶质细胞分离培养方法的优化[J].广西医科大学学报,2014,31(6):894-897.
[8]Meberg PJ,Miller MW.Culturing hippocampal and cortical neurons[J].Methods Cell Biol,2003,71(2):111-127.
[9]石军,张可成,蔡文琴.大鼠脑皮质星形胶质细胞的限制性细胞培养[J].中国组织化学与细胞化学杂志,2009,9(2):206-209.
[10]Hiort O,Holterhus PM.Androgen insensitivity and male infertility[J].Int JAndrol,2003,26(1):16-20.
[11]俞爱青,崔红梅,周志俊.新生鼠星型胶质细胞分离培养方法[J].毒理学杂志,2009,23(1):70-72.
[12]王景.槲皮素对髙糖培养SD大鼠海马神经元凋亡及机制的研宄[D].北京:北京协和医学院,2012.
[13]徐小涵.红景天苷、葛根素对高糖培养SD大鼠海马神经元凋亡的影响及其机制研究[D].北京:北京协和医学院,2014.
[14]杨建凯.Ephrin-B2基因敲除小鼠脑损伤后反应性星形胶质细胞有利于保护组织和促进神经功能恢复[D].石家庄:河北医科大学,2011.
[15]汪莹,许栋明,王文,等.脑缺血再灌注后神经细胞凋亡机制及药物保护作用的研究进展[J].中国康复理论与实践,2010,16(12):1140-1143.
[16]王超,刑喜春,李文志.星形胶质细胞活化增殖在脊髓损伤修复中作用研究进展[J].中国实用诊断与治疗杂志,2015,29(9):837-839.
[17]Rompani SB,Cepko CL.Retinal progenitor cells can produce restricted subsets of horizontal cells[J].PNAS,2008,105(1):192-197.
[18]贾东林,郭建荣.星形胶质细胞与神经病理性疼痛[J].中国康复理论与实践,2010,16(8):704-706.
[19]Panickar KS,Norenberg MD.Astrocytes in cerebral ischemic injury:morphological and general considerations[J].Glia,2005,50(4):287-298.
[20]李校堃,许华,付小兵,等.重组人酸性成纤维细胞生长因子促进创伤愈合的研究[J].中国药科大学学报,2002,33(4):312-315.
[21]李校堃,姚成灿.细胞生长因子在美容护肤中的应用[J].实用美容整形外科杂志,2002,13(3):154-156.
[22]李校堃,许华,赵文,等.重组人酸性成纤维细胞生长因子皮肤用药的药代动力学[J].药学学报,2002,37(6):424-427.
[23]Tan Y,Wang KY,Wang N,et al.Ectopic expression of human acidic fibroblast growth factor 1 in the medicinal plant,Salvia miltiorrhiza,accelerates the healing of burn wounds[J].BMC Biotechnol,2014,9(14):74.
[24]Wu JC,Huang WC,Chen YC,et al.Acidic fibroblast growth factor for repair of human spinal cord injury:a clinical trial[J].J Neurosurg Spine,2011,15(3):216-227.
[25]Kyriakis JM,Avruch J.Mammalian mitogen-activated protein kinase signal transduction pathways activated by stress and inflammation[J].Physiol Rev,2001,81(2):807-869.
[26]郑小兰,陈陵,罗振中,等.P38MAPK信号通路在糖尿病神经病变大鼠脊髓神经元凋亡中的作用[J].广东医学,2015,36(4):509-511.
[27]Liu Y,Lu JB,Chen Q,et al.Involvement of MAPK/ERK kinase-ERK pathway in exogenous bFGF-induced Egr-1 binding activity enhancement in anoxia-reoxygenation injured astrocytes[J].Neurosci Bull,2007,23(4):221-228.
[28]陶昕,孟祥志,孙丽,等.MAPK信号通路与神经系统损伤的研究进展[J].解剖科学进展,2010,16(6):574-577.
[29]郑曙云,付小兵,徐建国,等.酸性成纤维细胞生长因子对大鼠缺血/再灌注损伤肠上皮细胞丝裂素活化蛋白激酶的影响[J].中国危重病急救医学,2006,18(1):9-12.
[30]彭博,孙黎光,刘素媛,等.aFGF对染铅大鼠海马神经元细胞浆ERK活性的保护作用[J].中国医科大学学报,2004,33(2):97-98.
[31]张颐,孙黎光,尚海,等.酸性成纤维细胞生长因子在卵巢癌中的表达及其信号传导途径[J].中华医学杂志,2003,83(11):976-980.
[32]汪小凤,郑青,蔡邵辉,等.酸性成纤维细胞生长因子受体及信号转导的研究进展[J].暨南大学学报(医学版),2004,25(6):734-739.
Effects of Acidic Fibroblast Growth Factor on Hippocampal Astrocytes Injury Induced by Gentamicin:Role of Mitogen-Activated Protein Kinase Signal Pathway
SHEN Li1,HUANG Ju-en1,HUANG Tai-ping1,SHEN Hui1,LI Xiao-kun2
1.School of Nursing,Guangxi Medical University,Nanning,Guangxi 530021,China;2.Institute of Biological and Natural Medicine of Wenzhou Medical College,Wenzhou,Zhejiang 325027,China
Correspondence to HUANG Ju-en.E-mail:hje5810@163.com
Abstract:Objective To explore the mechanism of the protection of acidic fibroblast growth factor(aFGF)for hippocampal astrocytes from injury induced by gentamicin.Methods Hippocampal astrocytes were isolated from newborn(24 hours)Sprague-Dawley rats,purified,and identified with glial fibrillary acidic protein(GFAP)immunofluorescence.The third generations were cultured for 3 days and divided into 3 groups:control group was cultured routinely,injury group was cultured with 2.0 g/L gentamicin for 24 hours,and protection group was cultured with 4.25 μg/L aFGF for 24 hours and then cultured with 2.0 g/L gentamicin for 24 hours.Western blotting was adopted to detect the expressions of P38,extracellular signal-regulated kinase(ERK)1/2 and c-Jun N-terminal kinase(JNK)1/2.Results Hippocampal astrocytes were culturated successfully with the purity above 95%.The ERK1 increased in the injury group compared with the control group(P<0.05).Compared with the injury group,the p38 increased(P<0.05)and the ERK1 decreased(P<0.05)in the protection group.There was no significant difference among others(P>0.05).Conclusion The mitogen-activated protein kinase signal pathway,especially P38 and ERK1,may associate with the protection of aFGF for hippocampal astrocytes from injury induced by gentamicin.
Key words:acidic fibroblast growth factor;mitogen-activated protein kinase;gentamicin;astrocytes;hippocampus;rats
(收稿日期:2015-11-08修回日期:2016-01-06)
基金项目:1.国家“863”计划课题(No.2004AA2Z3C60);2.广西医疗卫生重点科研课题(No.2011046)。
DOI:10.3969/j.issn.1006-9771.2016.03.006
[中图分类号]R595.4
[文献标识码]A
[文章编号]1006-9771(2016)03-0270-04
