CuI/TMEDA催化合成芳基葡萄糖碳苷化合物
2016-04-20毛泽伟饶高雄
毛泽伟, 饶高雄
(云南中医学院 中药学院,云南 昆明 650500)
·研究简报·
CuI/TMEDA催化合成芳基葡萄糖碳苷化合物
毛泽伟, 饶高雄*
(云南中医学院 中药学院,云南 昆明650500)
摘要:以THF为溶剂,CuI/TMEDA为催化剂,四乙酰溴代葡萄糖与芳基溴化镁经取代反应合成了芳基葡萄糖碳苷(2a~2c),其结构经1H NMR和(13)C NMR确证。在最佳反应条件(THF为溶剂,10%CuI和10%TMEDA为催化剂,于0 ℃反应至终点)下,2a~2c的收率为58%~71%, α/β为1/6.5~1/7.1。
关键词:CuI; 催化; 芳基碳苷; 合成
碳苷(C-Glycosides)是一类借助于碳-碳键将糖与非糖部分连接起来的糖类物质。芳基糖碳苷是碳苷化合物中具有代表性的一类化合物,普遍具有多种生物活性,如细胞毒活性[1-2]、抗肿瘤活性[3-4]和抗感染活性[5]等,为化学工作者目前研究的热点之一。有机金属试剂与葡萄糖溴代物发生亲核取代反应是目前最常用的形成碳苷键方法[6-10]。该方法收率较高,但立体选择性较差。
本文设计一种立体选择性构建芳基碳苷键的方法,通过加入催化剂促进反应的进行并提高反应的立体选择性,以期为该类化合物的合成提供新的参考。以四乙酰溴代葡萄糖与芳基溴化镁(1a~1c)为原料,在CuI/TMEDA催化下经取代反应合成了芳基碳苷化合物(2a~2c, Scheme 1),其结构经1H NMR和13C NMR确证。并考察了催化剂用量、反应温度和溶剂对反应的影响。
1实验部分
1.1仪器与试剂
Yanaco型显微熔点仪(温度未校正);Bruker AM-300 HMz型核磁共振仪(CDCl3为溶剂,TMS为内标)。
四乙酰溴代葡萄糖,参考文献[11]方法合成;THF,甲苯和乙醚经干燥处理后使用;其余所用试剂均为分析纯。


CompabcArPh4-MeC6H44-MeOC6H4Yieldof2586571α/β1/6.51/7.11/6.8
Scheme 1
1.2合成
(1) 2a~2c的合成(以2a为例)
在反应瓶中加入CuI 38 mg和四甲基乙二胺(TMEDA) 23 mg,氮气保护,搅拌下加入无水THF 10 mL和1.0 mol·L-1苯基溴化镁(1a)的THF(3 mL)溶液,于0 ℃反应30 min。缓慢滴加四乙酰溴代葡萄糖822 mg(2 mmol)的THF(5 mL)溶液,滴毕,反应5 h(TLC监测)。升至室温,加入饱和氯化铵溶液10 mL,用乙酸乙酯(20 mL)萃取,有机相用无水硫酸钠干燥,浓缩,加入DCM 10 mL溶解,依次滴加三乙胺0.5 mL和乙酸酐0.2 mL,滴毕,于室温反应2 h。加入饱和NaHCO3溶液10 mL,反应1 h。用DCM(2×10 mL)萃取,合并有机相,用无水硫酸钠干燥,浓缩后经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=8 ∶2]纯化得2a。
用类似的方法合成2b和2c。
1-苯基-2,3,4,6-四乙酰氧基-β-吡喃葡萄糖(2a): 淡灰色固体,m.p.137~139 ℃;1H NMRδ: 7.31~7.07(m, 5H), 6.04(d,J=8.2 Hz, 1H), 5.59(t,J=9.5 Hz, 1H), 5.19(t,J=9.6 Hz, 1H), 4.88~4.81(m, 1H), 4.33~4.26(m, 2H), 4.16(d,J=10.5 Hz, 1H), 2.10(s, 3H), 2.08(s, 3H), 2.06(s, 3H), 2.02(s, 3H);13C NMRδ:170.39, 169.74, 169.56, 169.39, 137.46, 128.92, 118.32, 116.55, 79.39, 72.32, 70.92, 70.38, 70.16, 68.02, 61.11, 20.87, 20.39, 20.01。
1-(4-甲基苯基)-2,3,4,6-四乙酰氧基-β-吡喃葡萄糖(2b): 淡黄色固体,m.p.145~147 ℃;1H NMRδ: 7.29(d,J=8.5 Hz, 2H), 7.05(d,J=8.5 Hz, 2H), 6.06(d,J=8.3 Hz, 1H), 5.61(t,J=9.4 Hz, 1H), 5.17~5.14(m, 1H), 4.88~4.81(dd,J=3.9 Hz, 4.0 Hz, 1H), 4.33~4.25(m, 2H), 4.17(d,J=10.4 Hz, 1H), 2.13(s, 3H), 2.10(s, 3H), 2.07(s, 3H), 2.05(s, 6H);13C NMRδ: 170.18, 169.89, 169.48, 137.01, 129.06, 118.28, 115.72, 79.34, 72.20, 70.91, 70.28, 70.22, 67.87, 61.09, 30.21, 20.88, 20.42, 20.11。
1-(4-甲氧基苯基)-2,3,4,6-四乙酰氧基-β-吡喃葡萄糖(2c): 淡黄色固体,m.p.142~144 ℃;1H NMRδ: 7.33(d,J=8.2 Hz, 2H), 7.12(d,J=8.4 Hz, 2H), 6.05(d,J=8.2 Hz, 1H), 5.60(t,J=9.3 Hz, 1H), 5.18(t,J=9.5 Hz, 1H), 4.88~4.81(dd,J=3.9 Hz, 3.9 Hz, 1H), 4.34~4.25(m, 2H), 4.17(d,J=10.4 Hz, 1H), 3.82(s, 3H), 2.11(s, 3H), 2.08(s, 6H), 2.03(s, 3H);13C NMRδ: 170.17, 169.57, 169.32, 169.17, 152.23, 138.85, 128.73, 115.27, 78.88, 72.03, 70.34, 70.16, 69.92, 68.10, 61.03, 53.16, 20.84, 20.61, 20.44, 20.19。
2结果与讨论
2.1合成
在四乙酰溴代葡萄糖中,1-位H的耦合常数为3.9 Hz,溴为α-构型;在目标产物2中,1-位H的耦合常数为8.2~8.3 Hz,说明1-位H的构型发生了翻转,因此芳基为β-构型。
2.2反应条件优化
(1) 溶剂
1a 3 mmol,其余反应条件同1.2(1),考察溶剂对2a收率的影响。结果表明:以甲苯,THF和乙醚为溶剂时,2a的收率分别为39%, 58%和51%。因此,最佳溶剂确定为THF。
(2) 催化剂和溶剂
THF为溶剂,其余反应条件同2.2(1),考察催化剂的用量对2a收率的影响,结果见表1。
表 1催化剂用量对2a收率的影响*
Table 1Effect of the amount of catalyst on the yield of 2a

No.CuI/%TMEDA/%收率/%15532210105831020594202061
*THF为溶剂,其余反应条件同2.2(1)。
由表1可见,催化剂用量为5%时,反应收率低(No.1);增加催化剂的用量对反应收率有一定影响;增加TMEDA的用量,2a收率变化较小(No.2和No.3)。因此,最佳催化剂用量为10%。
(3) 温度
CuI和TMEDA的用量均为10%,其余反应条件同2.2(2),考察温度对2a收率和构型的影响,结果见表2。从表2可见,温度对收率和产物的立体选择性的影响均较大,于0 ℃反应时,效果较好。升高温度时,虽然收率有所提高,但选择性较差;降低温度时,虽然立体选择性大幅提高,但收率明显降低。因此最佳反应温度确定为0 ℃。
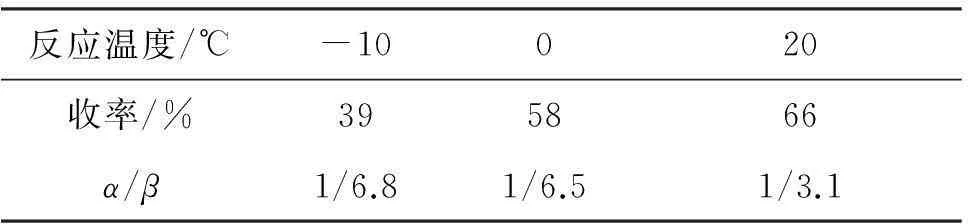
表 2 反应温度对2a的收率和构型的影响*
*CuI和TMEDA用量均为10%,其余反应条件同表1。
综上所述,合成2a的较佳反应条件为:以THF为溶剂,10%CuI和10%TMEDA为催化剂,于0 ℃反应至终点,收率58%。
2.3底物扩展
在合成2a的最佳反应条件,对底物进行扩展,考察了此反应条件对不同芳基格氏试剂的反应普适性,结果见Scheme 1。由Scheme 1可见,带不同取代基的芳基溴化镁试剂在该反应条件下,收率及选择性都相差不大,表明该方法具有良好的普适性。
3结论
本文发展了一种以CuI/TMEDA为催化剂,芳基溴化镁与葡萄糖溴代物经取代反应,立体选择性构建芳基碳苷键的方法,并对其反应条件进行了优化。该方法立体选择性较高,操作简便,普适性好,可用于β-构型碳苷化合物的立体选择性合成。
参考文献
[1]Hirobe C, Qiao Z S, Takeya K,etal. Cytotoxic flavonoids from vtex gnus-astus[J].Phytochemistry,1997,46(3):521-524.
[2]Kirschning A, Chen G W, Drager G,etal. Synthesesand biological evaluation of new glyco-modified augucyclin-antibiotics[J].Bioorganic & Chemistry,2000,8(9):2347-2354.
[3]Carte B K, Carr S, Brosse C D,etal. Aciculation,a novel flavone-C-glycoside with DNA binding activity fromchrysopogonaciculatis[J].Tetrahedron,1991,47:1815-1822.
[4]Chanlagain M R, Postema M H, Valeriote F,etal. Synthesis and anti-tum or activity ofβ-C-glycoside analogs of the immunostimulant KRN7000[J].Tetrahedron Lett,2004,45(41): 7791-7794.
[5]Furuta T, Kmiura T, Kondo S,etal. Concise total synthesis of flavonesC-glycoside having potent anti- inflammatory activity[J].Tetrahedron,2004,60:9375-9379.
[6]Dondoni A, Formaglio P, Marra A. Selectivity in the SmI2- induced eoxygenation of thiazolyketoses for formylC-glycoside synthesis and revised structure ofC-ribofuranosides [J].Tetrahedron,2001, 57:7719-7727.
[7]彭涛, 王林. 糖碳苷类化合物的合成方法研究进展[J].合成化学,2006,14(5):432-441.
[8]Caputo R, Festa P, Guaragna A,etal. A novel approach to the stereocontrolled synthesis ofC-vinyl-β-D-galactopyranosides[J].Carbohydrate Research,2003,338:1877-1880.
[9]Gong H G, Gagne M R. Diastereoselective Ni-catalyzed negishi cross-coupling:Approach to saturated, fully oxygenatedC-alkyl andC-aryl glycosides[J].J Am Chem Soc,2008,130:12177-12183.
[10]Nicolas L, Angibaud P, Stansfield I,etal. Diastereoselective metal-catalyzed synthesis ofC-aryl andC-vinyl glycosides[J].Angew Chem Int Ed,2012,51:11101-11104.
[11]Drillaud N, Banaszak-Léonard E, Pezron I,etal. Synthesis and evaluation of a photochromic surfactant for organic reactions in aqueous media[J].J Org Chem,2012,77:9553-9561.
Synthesis ofC-aryl Glycosides Catalyzed by CuI/TMEDA
MAO Ze-wei,RAO Gao-xiong*
(School of Traditional Chinese Medicine, Yunnan University of Traditional Chinese Medicine, Kunming 650500, China)
Abstract:C-aryl glycosides(2a~2c) were stereoselectively synthesized by substitution reaction of 2,3,4,6-tetra-O-acetyl-α-D-glucopyranosyl bromide and aryl Grignard reagents, using THF as the solvent and CuI/TMEDA as the catalyst. The structures were confirmed by1H NMR and (13)C NMR. Under the optimized reaction conditions(THF as the solvent, 10%CuI and 10%TMEDA as the catalyst, and the reaction temperature was 0 ℃), the yields of 2a~2c were 58%~71% and α/β were 1/6.5~1/7.1.
Keywords:CuI; catalysis; C-aryl glycoside; synthesis
中图分类号:O629.11; O614.121
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.03.15088
作者简介:毛泽伟(1981-),男,汉族,湖北汉川人,博士,主要从事药物合成研究。 E-mail: ydmason@163.com通信联系人: 饶高雄,教授, E-mail: rao13987124569@qq.com
基金项目:云南省应用基础研究计划项目(2014FZ087)
收稿日期:2015-04-17;
修订日期:2016-01-20
