苯丙烯类葡萄糖氧苷的合成及其抗缺氧活性
2016-04-20张文彬李灵芝吴宇强张永亮葛肖健
马 臣, 张文彬, 李 霞, 李灵芝,*, 吴宇强, 张永亮, 葛肖健,3
(1. 天津医科大学 药学院,天津 300070; 2. 武警后勤学院 a.药物化学教研室;
b. 天津市职业与环境危害防制重点实验室,天津 300309; 3. 天津中医药大学 药学院,天津 300193)
·研究论文·
苯丙烯类葡萄糖氧苷的合成及其抗缺氧活性
马臣1,2a, 张文彬1,2a, 李霞2a, 李灵芝2a,2b*, 吴宇强1,2a, 张永亮2b, 葛肖健2a,3
(1. 天津医科大学 药学院,天津300070; 2. 武警后勤学院 a.药物化学教研室;
b. 天津市职业与环境危害防制重点实验室,天津300309; 3. 天津中医药大学 药学院,天津300193)
摘要:以取代苯甲醛(1a~1t)为原料,通过Knoevenagel缩合、酯化和LiAlH4还原等反应制得苯丙烯醇衍生物(3a~3t);以取代肉桂醛(1u~1x)为原料,经NaBH4还原制得苯丙烯醇衍生物(3u~3x); 3a~3x与全乙酰化溴代葡萄糖经Koenigs-Knorr偶联反应及MeONa/MeOH体系脱除乙酰保护基反应,合成了24个苯丙烯类葡萄糖氧苷(5a~5x),其中5c, 5f~5x为新化合物,其结构经1H NMR和ESI-MS表征。采用MTT法测定了5对缺氧损伤的内皮细胞(EA.hy926)的抗缺氧活性。实验结果表明: 5b, 5e, 5g, 5p, 5q, 5s, 5t和5y对EA.hy926的抗缺氧活性均高于红景天苷。
关键词:苯丙烯类; 红景天苷; 合成; 内皮细胞; 抗缺氧活性
红景天是目前应用较为普遍的抗高原反应植物药。红景天苷(Chart 1)是红景天的主要活性成分,具有抗缺氧、抗疲劳、抗肿瘤、抗衰老、抗病毒等广泛的生物活性[1-5]。但由于合成困难[6]、稳定性差[7]和生物利用度低[8]等缺点限制了其临床应用。

为了获得活性高且便于合成的红景天苷类似物,本课题组曾考察了糖基、苯环侧链及糖苷键对化合物抗缺氧活性的影响[9]。研究发现,糖基类型对该类化合物活性影响不大;将红景天苷双碳侧链缩短为一碳侧链时,化合物的抗缺氧活性无明显影响;当将分子中的氧苷键以生物电子等排体氮苷键置换时,化合物的抗缺氧活性普遍得到改善;此外苯环上存在给电子取代基时也有助于增强化合物活性[9]。Menezes J C等[10]报道取代肉桂酸酯类化合物具有较好的抗氧化和清除自由基活性,可能是因为结构中存在羟基肉桂酸片段。因此,本研究以丙烯侧链替代红景天苷结构中的双碳侧链,设计并合成了一系列苯丙烯类葡萄糖氧苷,期望得到抗缺氧活性更好且易于合成的化合物。
本文以取代苯甲醛(1a~1t)为原料,通过Knoevenagel缩合、酯化反应和LiAlH4还原制得苯丙烯醇衍生物(3a~3t);以取代肉桂醛(1u~1x)为原料,经NaBH4还原制得苯丙烯醇衍生物(3u~3x); 3a~3x与全乙酰化溴代葡萄糖(4, Chart 1)经Koenigs-Knorr偶联反应及MeONa/MeOH体系脱除乙酰保护基反应,合成了24个苯丙烯类葡萄糖氧苷(5a~5x, Scheme 1),其中5c, 5f~5x为新化合物。
同时,为了比较苯环侧链的改变对抗缺氧活性的影响,以4-羟基苯甲醛为原料,按文献[9]方法经羟基乙酰化保护反应,NaBH4还原反应,成苷反应及脱乙酰化反应制得侧链为一碳的葡萄糖氧苷(5y, Chart 2);以4-羟基苯丙酸为原料,经酯化反应[11]、羟基苄基保护反应[12]、还原反应[13]、成苷反应、脱乙酰化反应及脱苄基保护反应[14]等6步反应制得侧链为饱和三碳链的葡萄糖氧苷(5z,Chart 2)。所得26个化合物的结构经1H NMR和ESI-MS表征。并以内皮细胞(EA.hy 926)为靶细胞建立细胞缺氧模型,采用MTT法检测细胞代谢活力,测定了5a~5z的抗缺氧活性。

Chart 2

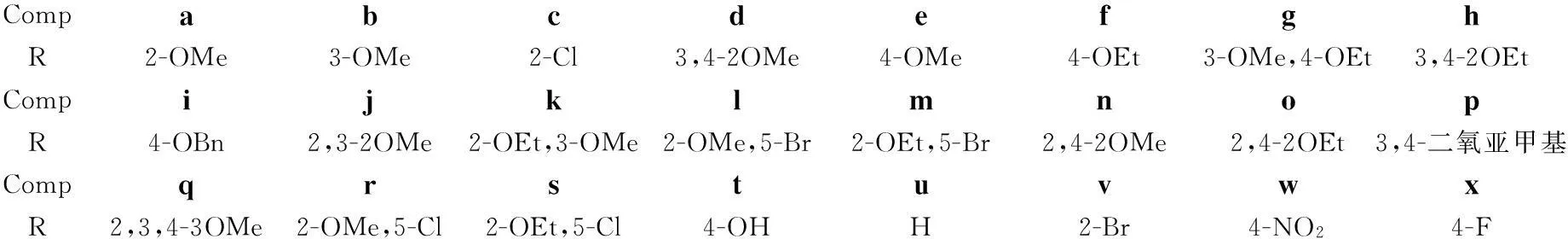
CompabcdefghR2-OMe3-OMe2-Cl3,4-2OMe4-OMe4-OEt3-OMe,4-OEt3,4-2OEtCompijklmnopR4-OBn2,3-2OMe2-OEt,3-OMe2-OMe,5-Br2-OEt,5-Br2,4-2OMe2,4-2OEt3,4-二氧亚甲基CompqrstuvwxR2,3,4-3OMe2-OMe,5-Cl2-OEt,5-Cl4-OHH2-Br4-NO24-F
Scheme 1
1实验部分
1.1仪器与试剂
X-5型显微熔点仪(温度未校正);Bruker AVANCE 400 MHz型核磁共振仪;Bruker Maxis型质谱仪;Thermo Scientific 3111型CO2培养箱;Bio-Rad 680型全波长酶标仪;TS100型倒置相差显微镜。
1a~1x,天津希恩思化学试剂有限公司;柱层析硅胶(100~200目),GF254硅胶板,山东青岛海洋化工公司;人脐静脉内皮细胞株(EA.hy926),中国科学院细胞库;其余所用试剂均为色谱纯或分析纯。
1.2合成
(1) 2a~2t的合成(以2a为例)
在反应瓶中加入2-甲氧基苯甲醛(1a)2.72 g(20 mmol)和DMF 20 mL,搅拌使其溶解;加入丙二酸6.24 g(60 mmol),二甲氨基吡啶(DMAP)0.25 g及哌啶1 mL,缓慢升温至65 ℃,反应12 h(TLC监测)。反应液冷却至室温,倒入冰水(200 mL)中,用稀盐酸调至pH 3,析出白色絮状固体。减压抽滤,滤饼用冰水(100 mL)反复洗涤,干燥得白色固体2-甲氧基苯丙烯酸(2a),收率73%。
用类似方法合成类白色固体2b~2t,收率70%~80%。
(2) 3a~3t的合成(以3a为例)
在反应瓶中加入2a 2.68 g(15 mmol)和无水甲醇20 mL,搅拌使其溶解;于-5 ℃缓慢滴加二氯亚砜5 mL,滴毕,于室温反应30 min;于30 ℃(浴温)反应2 h(TLC监测)。减压蒸除溶剂及过量的二氯亚砜,加入无水THF 20 mL,降温至-40 ℃,缓慢加入LiAlH40.76 g(20 mmol),加毕,N2保护下同温反应2 h(TLC监测)。缓慢滴加冰水(0.76 mL)淬灭过量的LiAlH4,依次加入10%NaOH溶液0.76 mL和冰水2.28 mL,缓慢升温至0 ℃;加入无水硫酸镁2 g,反应30 min。用硅藻土减压助滤,滤饼用乙酸乙酯反复洗涤;滤液中加入蒸馏水200 mL,用乙酸乙酯(3×200 mL)萃取,合并有机相,依次用饱和食盐水和蒸馏水洗涤,无水硫酸镁干燥,减压蒸除溶剂得淡黄色油状液体3a,收率82%。
用类似方法合成淡黄色油状液体3b~3t,收率75%~85%。
(3) 3u~3x的合成通法(以3u为例)
在反应瓶中加入反式肉桂醛(1u)0.79 g(6 mmol)和无水甲醇10 mL,降温至0 ℃,缓慢加入NaBH40.34 g(9 mmol),加毕,反应2 h(TLC监测)。倾入冰水(200 mL)中,用稀盐酸调至pH<7,用乙酸乙酯(3×200 mL)萃取,合并有机相,依次用饱和食盐水和蒸馏水洗涤,无水硫酸镁干燥,减压除去溶剂得淡黄色油状物,真空干燥得粗品3u(直接用于下一步)。
用类似方法合成淡黄色油状液体3u~3x。
(4) 5a~5x的合成(以5a为例)
在反应瓶中加入3a 0.66 g(4 mmol)和无水二氯甲烷10 mL,搅拌使其溶解;依次加入4 2.05 g(5 mmol)和4Å分子筛2 g,于室温反应30 min。加入碳酸银1.38 g, N2保护下于室温反应20 h(TLC监测)。用硅藻土减压助滤,滤饼用二氯甲烷反复洗涤;合并滤液和洗液,减压蒸除溶剂得黄色油状物A。
将A溶于无水甲醇10 mL中,加入甲醇钠0.1 g(1.85 mmol),于室温反应30 min(TLC监测)。用稀盐酸调至pH 7,减压蒸除溶剂后经硅胶柱(100~200目)色谱[梯度洗脱剂:V(二氯甲烷) ∶V(甲醇)=30 ∶1~20 ∶1]纯化得白色固体5a。
用类似方法合成白色固体5b~5x。
(E)-3-(2-甲氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5a): 收率30%, m.p.110.3~113.7 ℃;1H NMRδ: 2.95~3.21(m, 4H), 3.41~3.50(m, 1H), 3.63~3.73(m, 1H), 3.80(s, 3H), 4.16~4.24(m, 2H), 4.44~4.87(m, 4H), 5.01(d,J=5.2 Hz, 1H), 6.28~6.37(m, 1H), 6.84(d,J=16.0 Hz, 1H), 6.92(t,J=14.8 Hz, 1H), 7.00(d,J=8.4 Hz, 1H), 7.25(t,J=5.7 Hz, 1H), 7.46(d,J=7.6 Hz, 1H); ESI-MSm/z: 349.2{[M+Na]+}。
(E)-3-(3-甲氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5b): 收率33%, m.p.117.5~119.5 ℃;1H NMRδ: 2.98~3.17(m, 4H), 3.42~3.47(m, 1H), 3.64~3.70(m, 1H), 3.76(s, 3H), 4.13~4.28(m, 2H), 4.40~4.91(m, 4H), 5.03(d,J=5.2 Hz, 1H), 6.30~6.45(m, 1H), 6.63(d,J=16.0 Hz, 1H), 6.82(dd,J=7.2 Hz, 2.4 Hz, 1H), 7.00(t,J= 5.4 Hz, 2H), 7.24(t,J=7.8 Hz, 1H); ESI-MSm/z: 349.3{[M+Na]+}。
(E)-3-(2-氯苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5c): 收率28%, m.p.124.6~125.7 ℃;1H NMRδ: 2.88~3.01(m, 4H), 3.45~3.81(m, 2H), 4.12~4.94(m, 4H), 4.17~4.31(m, 2H), 5.02(d,J=5.2 Hz, 1H), 6.28~6.47(m, 1H), 6.96(d,J=16.0 Hz, 1H), 7.32~7.36(m, 2H), 7.58(d,J=7.2 Hz, 1H), 7.70(dd,J=7.6 Hz, 1.7 Hz, 1H); ESI-MSm/z: 355.2{[M+Na]+}。
(E)-3-(3,4-二甲氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5d): 收率34%, m.p.107.3~110.3 ℃;1H NMRδ: 2.95~3.21(m, 4H), 3.45~3.72(m, 2H),3.75(s, 3H), 3.78(s, 3H), 4.15~4.24(m, 2H), 4.50~4.94(m, 4H), 5.05(d,J=4.8 Hz, 1H), 6.25~6.30(m, 1H), 6.59(d,J=15.6 Hz, 1H), 6.92(m, 2H), 7.06(s, 1H); ESI-MSm/z: 379.3{[M+Na]+}。
(E)-3-(4-甲氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5e): 收率29%, m.p.102.1~105.4 ℃;1H NMRδ: 2.96~3.20(m, 4H), 3.42~3.50(m, 1H), 3.64~3.72(m, 1H), 3.75(s, 3H), 3.90~4.33(m, 2H), 4.38~4.90(m, 4H), 5.03(d,J=4.8 Hz, 1H), 6.15~6.25(m, 1H), 6.60(d,J=16.0 Hz, 1H), 6.90(d,J=8.0 Hz, 2H), 7.38(d,J=8.4 Hz, 2H); ESI-MSm/z: 349.2{[M+Na]+}。
(E)-3-(2-乙氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5f): 收率25%, m.p.127.9~130.1 ℃;1H NMRδ: 1.32(t,J=4.6 Hz, 3H), 2.96~3.18(m, 4H), 3.40~3.51(m, 1H), 3.62~3.75(m, 1H), 3.97~4.07(m, 2H), 4.14~4.24(m, 2H), 4.38~4.87(m, 4H), 5.02(d,J=5.8 Hz, 1H), 6.09~6.28(m, 1H), 6.59(d,J=16.0 Hz, 1H), 6.88(d,J=8.4 Hz, 2H), 7.36(d,J=8.4 Hz, 2H) ; ESI-MSm/z: 363.2{[M+Na]+}。
(E)-3-(3-甲氧基-4-乙氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5g): 收率20%, m.p.128.1~130.2 ℃;1H NMRδ: 1.31(t,J=4.7 Hz, 3H), 2.96~3.13(m, 4H), 3.42~3.47(m, 1H), 3.69(d,J=11.4 Hz, 1H), 3.78(s, 3H), 3.93~4.02(m, 2H), 4.14~4.25(m, 2H), 6.17~6.32(m, 1H), 6.57(d,J=14.0 Hz, 1H), 6.90(q,J=8.4 Hz, 2H), 7.06(s, 1H); ESI-MSm/z: 393.3{[M+Na]+}。
(E)-3-(3,4-二乙氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5h): 收率23%, m.p.120.6~124.5 ℃;1H NMRδ: 1.21~1.36(m, 6H), 2.97~3.18(m, 4H), 3.44~3.49(m, 1H), 3.69(d,J=11.6 Hz, 1H), 3.92~4.10(m, 4H), 4.13~4.25(m, 2H), 6.22(dt,J=15.9 Hz, 6.0 Hz, 1H), 6.55(d,J=16.0 Hz, 1H), 6.79~6.96(m, 2H), 7.04(s, 1H); ESI-MSm/z: 407.2{[M+Na]+}。
(E)-3-(4-苄氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5i): 收率30%, m.p.128.7~129.9 ℃;1H NMRδ: 2.96~3.18(m, 4H), 3.45(dt,J=11.5 Hz, 5.6 Hz, 1H), 3.66~3.72(m, 1H), 4.12~4.26(m, 2H), 4.40~4.95(m, 4H), 5.06(d,J=4.8 Hz, 1H), 5.11(s, 2H), 6.21(dt,J=16.0 Hz, 6.0 Hz, 1H), 6.60(d,J=16.0 Hz, 1H), 6.98(d,J=8.4 Hz, 2H), 7.31~7.36(m, 7H); ESI-MSm/z: 425.3{[M+Na]+}。
(E)-3-(2,3-二甲氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5j): 收率34%, m.p.131.7~133.8 ℃;1H NMRδ: 2.99~3.17(m, 4H), 3.45(dd,J=11.2 Hz, 5.3 Hz, 1H), 3.63~3.69(m, 1H), 3.70(s, 3H), 3.80(s, 3H), 4.24(dd,J=12.6 Hz, 7.0 Hz, 2H), 4.42~4.96(m, 4H), 5.09(d,J=4.8 Hz, 1H), 6.35(dt,J=16.1 Hz, 5.9 Hz, 1H), 6.86(d,J=16.0 Hz, 1H), 6.95(d,J=9.2 Hz, 1H), 7.04(t,J=6.7 Hz, 1H), 7.14(d,J=8.8 Hz, 1H); ESI-MSm/z: 379.2{[M+Na]+}。
(E)-3-(3-甲氧基-2-乙氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5k): 收率31%, m.p.114.2~116.0 ℃;1H NMRδ: 1.28(t,J=4.7 Hz, 3H), 2.97~3.19(m, 4H), 3.41~3.50(m, 1H), 3.64~3.73(m, 1H), 3.78(s, 3H), 3.91(q,J=7.0 Hz, 2H), 4.24(dd,J=12.2 Hz, 7.1 Hz, 2H), 4.42~4.96(m, 4H), 5.08(d,J=4.8 Hz, 1H), 6.34(dt,J=16.1 Hz, 6.0 Hz, 1H), 6.87(d,J=16.4 Hz, 1H), 6.94(dd,J=8.4 Hz, 1.2 Hz, 1H), 7.02(t,J=5.3 Hz, 1H), 7.14(dd,J=9.2 Hz, 1.2 Hz, 1H); ESI-MSm/z: 393.2{[M+Na]+}。
(E)-3-(2-甲氧基-5-溴苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5l): 收率21%, m.p.115.8~117.4 ℃;1H NMRδ: 3.03~3.10(m, 4H), 3.44~3.68(m, 2H), 3.68(s, 3H), 4.21(t,J=8.5 Hz, 2H), 6.28~6.50(m, 1H), 6.80(d,J=15.2 Hz, 1H), 7.29~7.64(m, 3H); ESI-MSm/z: 443.1{[M+K]+}。
(E)-3-(2-乙氧基-5-溴苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5m): 收率33%, m.p.122.1~125.3 ℃;1H NMRδ: 2.09(t,J=10.2 Hz, 3H), 3.03~3.11(m, 4H), 3.43~3.45(m, 1H), 3.67~3.69(m, 1H), 3.79~3.81(m, 2H), 4.18~4.25(m, 2H), 4.34~4.90(m, 4H), 6.28~6.46(m, 1H), 6.78(d,J=16.4 Hz, 1H), 6.99~7.62(m, 3H); ESI-MSm/z: 441.2{[M+Na]+}。
(E)-3-(2,4-二甲氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5n): 收率35%, m.p.99.3~111.9 ℃;1H NMRδ: 2.98~3.15(m, 4H), 3.40~3.46(m, 1H), 3.69~3.72(m, 1H), 3.77(s, 3H), 3.80(s, 3H), 4.10~4.26(m, 2H), 4.39~4.94(m, 4H), 5.05(d,J=5.2 Hz, 1H), 6.15~6.24(m, 1H), 6.52(d,J=15.0 Hz, 1H), 6.55(d,J=2.0 Hz, 1H), 6.74(d,J=16.0 Hz, 1H), 7.39(d,J=8.8 Hz, 1H); ESI-MSm/z: 379.2{[M+Na]+}。
(E)-3-(2,4-二乙氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5o): 收率30%, m.p.108.9~120.7 ℃;1H NMRδ: 1.31~1.35(m, 6H), 3.00~3.15(m, 4H), 3.43~3.48(m, 1H), 3.65~3.71(m, 1H), 4.00~4.05(m, 4H), 4.11~4.24(m, 2H), 4.37~4.94(m, 4H), 5.04(d,J=5.2 Hz, 1H), 6.16~6.24(m, 1H), 6.45(d,J=14.0 Hz, 1H), 6.51(d,J=2.0 Hz, 1H), 6.74(d,J=16.0 Hz, 1H), 7.37(d,J=8.4 Hz, 1H); ESI-MSm/z: 407.3{[M+Na]+}。
(E)-3-(3,4-二亚甲氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5p): 收率35%, m.p.112.6~114.8 ℃;1H NMRδ: 2.98~3.16(m, 4H), 3.45(dt,J=11.6 Hz, 5.7 Hz, 1H), 3.65~3.72(m, 1H), 4.13~4.22(m, 2H), 4.40~4.96(m, 4H), 5.06(d,J=4.9 Hz, 1H), 6.01(s, 2H), 6.22(dt,J=15.9 Hz, 6.0 Hz, 1H), 6.58(d,J=16.0 Hz, 1H), 6.87(s, 2H), 7.11(s, 1H); ESI-MSm/z: 363.2{[M+Na]+}。
(E)-3-(2,3,4-三甲氧基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5q): 收率30%, m.p.113.5~117.9 ℃;1H NMRδ: 2.95~3.17(m, 4H), 3.45(dt,J=11.5 Hz, 5.6 Hz, 1H), 3.69(dd,J=10.8 Hz, 6.6 Hz, 1H), 3.74(s, 3H), 3.75(s, 3H), 3.80(s, 3H), 4.21~4.27(m, 2H), 4.41~4.95(m, 4H), 5.07(d,J=5.2 Hz, 1H), 6.24(dt,J=16.1 Hz, 6.1 Hz, 1H), 6.74(d,J=16.0 Hz, 1H), 6.81(d,J=8.8 Hz, 1H), 7.23(d,J=8.4 Hz, 1H); ESI-MSm/z: 409.2{[M+Na]+}。
(E)-3-(2-甲氧基-5-氯苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5r): 收率34%, m.p.129.1~135.2 ℃;1H NMRδ: 3.03~3.19(m, 4H), 3.43~3.47(m, 1H), 3.68(dd,J=11.4 Hz, 5.9 Hz, 1H), 3.81(s, 3H), 4.20(dd,J=11.0 Hz, 7.0 Hz, 2H), 4.42~4.96(m, 4H), 5.07(d,J=5.2 Hz, 1H), 6.42(dt,J=16.1 Hz, 5.8 Hz, 1H), 6.80(d,J=16.0 Hz, 1H), 7.03(d,J=8.8 Hz, 1H), 7.28(dd,J=8.8 Hz, 2.4 Hz, 1H), 7.50(d,J=2.8 Hz, 1H); ESI-MSm/z: 383.2{[M+Na]+}。
(E)-3-(2-乙氧基-5-氯苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5s): 收率30%, m.p.112.9~114.1 ℃;1H NMRδ: 1.35(t,J=4.7 Hz, 3H), 3.02~3.19(m, 4H), 3.43~3.48(m, 1H), 3.68(dt,J=13.4 Hz, 6.8 Hz, 1H), 4.02~4.08(m, 2H), 4.16~4.27(m, 2H), 4.41~4.96(m, 4H), 5.05(d,J=5.2 Hz, 1H), 6.43(dt,J=16.1 Hz, 5.8 Hz, 1H), 6.82(d,J=16.0 Hz, 1H), 7.01(d,J=8.8 Hz, 1H), 7.24(dd,J=11.2 Hz, 2.4 Hz, 1H), 7.50(d,J=2.8 Hz, 1H); ESI-MSm/z: 397.2{[M+Na]+}。
(E)-3-(4-羟基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5t): 收率36%, m.p.115.0~116.3 ℃;1H NMRδ: 3.02~3.19(m, 4H), 3.45(dt,J=11.4 Hz, 5.6 Hz, 1H), 3.64~3.71(m, 2H), 4.12~4.21(m, 2H), 4.36~4.95(m, 4H), 5.05(d,J=5.2 Hz, 1H), 6.12(dt,J=16.0 Hz, 6.1 Hz, 1H), 6.53(d,J=16 Hz, 1H), 6.71(d,J=8.8 Hz, 2H), 7.26(d,J=8.4 Hz, 2H), 9.51(s, 1H); ESI-MSm/z: 335.2{[M+Na]+}。
(E)-3-苯基-2-丙烯基-β-D-吡喃葡萄糖苷(5u): 收率27%, m.p.124.3~125.2 ℃;1H NMRδ: 3.05~3.19(m, 4H), 3.44~3.48(m, 1H), 3.65~3.71(m, 1H), 4.18~4.26(m, 2H), 4.47~4.91(m, 4H), 5.04(d,J=4.8 Hz, 1H), 6.36(dt,J=16.0 Hz, 5.8 Hz, 1H), 6.67(d,J=16.0 Hz, 1H), 7.25(dd,J=7.2 Hz, 3.2 Hz, 1H), 7.34(t,J=5.1 Hz, 2H), 7.44(d,J=7.6 Hz, 2H); ESI-MSm/z: 319.3{[M+Na]+}。
(E)-3-(2-溴苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5v): 收率42%, m.p.134.2~137.4 ℃;1H NMRδ: 3.01~3.19(m, 4H), 3.47(dd,J=11.6 Hz, 5.5 Hz, 1H), 3.70(d,J=11.4 Hz, 1H), 4.22~4.31(m, 2H), 4.45~4.77(m, 4H), 5.10(d,J=5.2 Hz, 1H), 6.39(dt,J=15.9 Hz, 5.7 Hz, 1H), 6.90(d,J=16.0 Hz, 1H), 7.22(t,J=8.8 Hz, 1H), 7.38(t,J=7.2 Hz, 1H), 7.62(dd,J=7.2 Hz, 0.8 Hz, 1H), 7.68(dd,J=9.2 Hz, 1.2 Hz, 1H); ESI-MSm/z: 398.3{[M+Na]+}。
(E)-3-(4-硝基苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5w): 收率39%, m.p.94.8~100.3 ℃;1H NMRδ: 3.03~3.19(m, 4H), 3.43~3.48(m, 1H), 3.68(dt,J=15.0 Hz, 7.5 Hz, 1H), 4.23(d,J=8.0 Hz, 1H), 4.20~4.32(m, 2H), 4.54(t,J=6.0 Hz, 1H), 4.93(d,J=5.2 Hz, 1H), 4.98(d,J=4.4 Hz, 1H), 5.13(d,J=4.8 Hz, 1H), 6.67(dt,J=15.3 Hz, 4.8 Hz, 1H), 6.86(d,J=16.0 Hz, 1H), 7.72(d,J=8.8 Hz, 2H), 8.20(d,J=8.4 Hz, 2H); ESI-MSm/z: 364.2{[M+Na]+}。
(E)-3-(4-氟苯基)-2-丙烯基-β-D-吡喃葡萄糖苷(5x): 收率38%, m.p.101.9~105.2 ℃;1H NMRδ: 3.00~3.18(m, 4H), 3.46~3.71(m, 2H), 4.23~4.30(m, 2H), 4.41~4.75(m, 4H), 5.01(d,J=5.2 Hz, 1H), 6.33~6.42(m, 1H), 6.67(d,J=16.0 Hz, 1H), 7.17(t,J=8.8 Hz, 2H), 7.50(t,J=8.8 Hz, 2H); ESI-MSm/z: 337.3{[M+Na]+}。
2-(4-羟基苯基)甲基-β-D-吡喃葡萄糖苷(5y): 收率32%, m.p.96.3~100.1 ℃;1H NMRδ: 3.01~3.17(m, 4H), 3.37(s, 2H), 3.43~3.51(m, 1H), 3.70(dd,J=11.4 Hz, 5.3 Hz, 1H), 4.18(d,J=7.6 Hz, 1H), 4.53(t,J=5.2 Hz, 1H), 4.70(d,J=11.6 Hz, 1H), 4.94(dd,J=14.4 Hz, 4.4 Hz, 1H), 5.03(d,J=4.8 Hz, 1H), 6.73(d,J=8.4 Hz, 2H), 7.17(d,J=8.4 Hz, 2H), 9.37(s, 1H); ESI-MSm/z: 309.1{[M+Na]+}。
3-(4-羟基苯基)丙基-β-D-吡喃葡萄糖苷(5z): 收率37%, m.p.109.4~112.3 ℃;1H NMRδ: 1.64~1.84(m, 2H), 2.52(t,J=7.6 Hz, 2H), 2.90~3.15(m, 4H), 3.39~3.44(m, 1H), 3.65(dt,J=17.2 Hz, 9.4 Hz, 1H), 3.70~3.80(m, 1H), 4.10(d,J=8.0 Hz, 1H), 4.47(t,J=6.0 Hz, 1H), 4.90(d,J=4.4 Hz, 1H), 4.93(d,J=4.4 Hz, 1H), 5.00(d,J=4.8 Hz, 1H), 6.65(d,J=8.4 Hz, 2H), 7.00(d,J=8.4 Hz, 2H), 9.12(s, 1H); ESI-MSm/z: 337.3{[M+Na]+}。
1.3抗缺氧活性测定
取对数生长期的内皮细胞用胰酶消化并计数,调整细胞浓度(c)为5.0×104个·mL-1,在96孔培养板中每孔接种200 μL,在5%CO2环境下于37 ℃培养24 h。以高糖无血清DMEM代替正常培养基继续培养24 h。将细胞随机分为正常对照组、红景天苷对照组(c1.0×10-6mol·L-1),同时设置缺氧模型组(不加药物,加等量的溶媒)、待测化合物组(c1.0×10-6mol·L-1),每组设6个复孔。除正常对照组外其它各组均以D-Hank’s液替代培养基,置于混合气体(5%CO2+95%N2)培养箱中,于37 ℃培养2 h,正常对照组在5%CO2培养箱中于37 ℃同步培养2 h。
在缺氧培养结束后,每孔加入20 μL新配制的MTT溶液,在5%CO2环境下于37 ℃培养箱中继续培养4 h。弃去上清液,每孔加入150 μL DMSO使细胞内蓝紫色结晶充分溶解,用酶标仪测定各孔在波长492 nm处的OD值。
2结果与讨论
2.1合成
苯丙烯酸衍生物通常彩用Knoevenagel[11]反应合成制得。该方法以取代苯甲醛、丙二酸为原料,吡啶为反应溶剂,由哌啶催化合成苯丙烯类衍生物。所用吡啶的毒性较大,且反应需要高温回流,对一些含有活泼基团的底物并不适用[12]。Mcnulty J[13]和李娟[14]课题组分别采用超声波和碱性离子液体促进Knoevenagel反应的发生。也有采用新型催化剂如聚丙烯腈纤维[15]、相转移催化剂[16]等来改进反应条件的,但是这些催化剂大多较昂贵,且合成困难。
本文在合成3a~3t的路线中,避免了使用毒性较大的吡啶,以DMF为反应溶剂,DMAP联合哌啶为催化剂,于65 ℃反应,以较高收率合成苯环上有不同取代基的苯丙烯酸衍生物3a~3t;接着通过酯化、还原得到苯丙烯醇衍生物(5a~5t)。在合成3u~3x的路线中,由取代肉桂醛经还原反应一步制得苯丙烯醇衍生物;后者再与4通过Koenigs-Knorr偶联得到乙酰化苯丙烯类糖苷化合物,最后脱去糖基的乙酰保护基,即得5a~5x。
1a~1t较为易得,且价格低廉,但反应路线较为繁琐。1u~1x通过一步反应即可得3u~3x,操作简便,但1u~1x不易得到。
2.2抗缺氧活性
5的抗缺氧活性结果见表1。由表1可见,与正常对照组比较,缺氧模型组细胞代谢活力显著降低,经5b, 5e, 5g, 5p, 5q, 5s, 5t和5y干预后,细胞在缺氧状态下的代谢活力均高于红景天苷组,具有统计学差异。其中,苯环均为4-羟基取代但侧链分别为丙烯基(5t)、一碳(5y)及三碳(5z)的三个化合物的抗缺氧活性均高于红景天苷,且5t的活性最强。这表明侧链缩短或延长一个碳不降低化合物的抗缺氧活性,但侧链为丙烯基时可能会提高其活性。
由表1还可见,5a, 5b, 5d, 5e和5p较红景天苷的OD值升高,增长比例分别为1.9%, 21.5%,12.5%, 16.6%和33.5%。由此可见,苯环上3-位和4-位引入甲氧基能够增强该类化合物的抗缺氧活性。
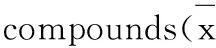
表1 化合物的抗缺氧活性
#与缺氧模型组相比,P<0.05;*与红景天苷相比,P<0.05。
3结论
以苯丙烯醇衍生物为关键中间体,与溴代糖通过Koenigs-Knorr偶联偶联反应及脱乙酰基保护,合成了24个苯丙烯类葡萄糖氧苷。该合成方法具有条件温和,反应时间短,后处理简单且收率较高的优点。
抗缺氧活性研究结果显示,细胞在缺氧状态下,5b, 5e, 5g, 5p, 5q, 5s, 5t和5y处理的细胞的代谢活力均高于同浓度红景天苷组。其构效关系和进一步的抗缺氧活性研究正在进行中。
参考文献
[1]Sanctis R D, Bellis R D, Scesa C,etal.Invitroprotective effect ofRhodiolaroseaextract against hypochlorous acid-induced oxidative damage in human erythrocytes[J].Biofactors,2004,20(3):147-159.
[2]Mao G X, Deng H B, Yuan L G,etal. Protective role of salidroside against aging in a mouse model induced by D-galactose[J].Biomed Environ Sci,2010,23(2):161-166.
[3]Hu X, Zhang X S, Yu D,etal. Salidroside induces cell-cycle arrest and apoptosis in human breast cancer cells[J].Biochem Bioph Res Co,2010,398(1):62-67.
[4]Zuo G, Li Z, Chen L,etal. Activity of compounds from Chinese herbal medicineRhodiolakirilowii(regel) maxim against HCV NS3 serine protease[J].Antivir Res,2007,76(1):86-92.
[5]Wang H, Ding Y, Zhou J,etal. Theinvitroandinvivoantiviral effects of salidroside fromRhodiolaroseaL. against coxsackie virus B3[J].Phytomedicine,2009,16(16):146-155.
[6]陈辉,崔颖,李灵芝. 红景天苷类似物的合成[J].第三军医大学学报,2012,34(11):1057-1061.
[7] 彭涛,王林,韩凤昭,等. 红景天苷糖碳苷类似物的合成及心肌保护活性研究[J].中国药物化学杂志,2009,19(2):89-93.
[8]祝辉,罗自力,顾建文,等. 红景天苷衍生物的合成及其抗氧化作用研究[J].解放军药学学报,2013,29(4):290-292.
[9]陈辉. 侧链失碳红景天苷类似物的合成及抗缺氧和抗氧化活性初步研究[D].天津:天津医科大学, 2012.
[10]Menezes J C, Kamat S P, Cavaleiro J A,etal. Synthesis and antioxidant activity of long chain alkyl hydroxycinnamates[J].Eur J Med Chem,2011,46(2):773-777.
[11]List B, Doehring A, Fonseca M T H, Job A,etal. A practical,efficient,and atom economic alternative to the Wittig and Horner-Wadsworth-Emmons reactions for the synthesis of (E)-α,β-unsaturated esters from aldehydes[J].Cheminform,2006,37(21):476-482.
[12]Zhang H J, Zhu D D, Li Z L,etal. Synthesis,molecular modeling and biological evaluation ofβ-ketoacylacyl carrier protein synthase III (FabH) as novel antibacterial agents[J].BioorgMed Chem,2011,19(15):4513-4519.
[13]Mcnulty J, Steere J A, Wolf S. The ultrasound promoted Knoevenagel condensation of aromatic aldehydes[J].Tetrahedron Lett,1998,39(44):8013-8016.
[14]李娟,孙辉,蔡晓晨,等. 碱性离子液体[bmim]OH在Knoevenagel反应和Perkin反应中的应用[J].有机化学,2007,27(10):1296-1299.
[15]Li G W, Xiao J, Zhang W Q. Highly efficient Knoevenagel condensation reactions catalyzed by a proline-functionalized polyacrylonitrile fiber[J].Chinese Chem Lett,2013,24(1):52-54.
[16]刘林,余俊梅. 相转移催化合成顺式取代肉桂酸[J].四川化工,1995,(3):2-3.
Synthesis of Benzene PropyleneO-Glycosides and Their Anti-hypoxic Activities
MA Chen1,2a,ZHANG Wen-bin1,2a,LI Xia2a,LI Ling-zhi2a,2b*,WU Yu-qiang1,2a,ZHANG Yong-liang2b,GE Xiao-jian2a,3
(1. College of Pharmacy, Tianjin Medical University, Tianjin 300070, China; a. Pharmaceutical Chemistry Lab;b. Tianjin Key Laboratory for Prevention and Control of Occupational and Environmental Hazard,2. Logistics University of Chinese People’s Armed Police Forces, Tianjin 300309, China;3. College of Pharmacy, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China)
Abstract:Twenty four benzene propylene O-glycosides(5a~5x) were designed and synthesized by Koenigs-Knorr reaction of 3-phenyl-2-propen-1-ol derivatives (3a~3x) with bromo acetyl glucose and deacetylation. 3a~3x were prepared by two methods. 3a~3t were prepared by Knoevenagel condensation, esterification, and reduction from substituted benzaldehyde. And 3u~3x were prepared by reduction from cinnamic aldehyde derivatives. 5c, 5f~5x were new compounds. The structures were characterized by1H NMR and ESI-MS. The anti-hypoxic activities of 5 on hypoxia exposure endothelial cells(EA.hy926) were evaluated by MTT assays. The results indicated that 5b, 5e, 5g, 5p, 5q, 5s, 5t and 5y exhibited better anti-hypoxic activity than salidroside.
Keywords:benzenepropylene; salidroside; synthesis; endothelial cell; anti-hypoxia activity
中图分类号:O629.13; R914.5
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.03.15374
作者简介:马臣(1989-),男,回族,山东德州人,硕士研究生,主要从事药物合成的研究。 E-mail: 349878267@qq.com通信联系人: 李灵芝,教授,博士生导师, E-mail: 13682196000@163.com
基金项目:国家自然科学基金资助项目(81471823); 天津市重点基金项目(12JCZDJC34700); 武警后勤学院科研创新团队项目(WHTD210303)
收稿日期:2015-11-09
