新型三唑并[4,5-d]嘧啶类化合物的合成及其抗血小板聚集活性
2016-04-20姜希明刘登科王平保
王 兵, 杨 静, 姜希明, 刘 颖, 刘登科, 王平保*
(1. 天津医科大学 研究生院,天津 300070; 2. 天津渤海职业技术学院 生物与环境工程系,天津 300408;
3. 天津法莫西医药科技有限公司,天津 300384; 4. 天津药物研究院有限公司,天津 300193)
·研究论文·
新型三唑并[4,5-d]嘧啶类化合物的合成及其抗血小板聚集活性
王兵1,4, 杨静2, 姜希明3, 刘颖4, 刘登科4, 王平保4*
(1. 天津医科大学 研究生院,天津300070; 2. 天津渤海职业技术学院 生物与环境工程系,天津300408;
3. 天津法莫西医药科技有限公司,天津300384; 4. 天津药物研究院有限公司,天津300193)
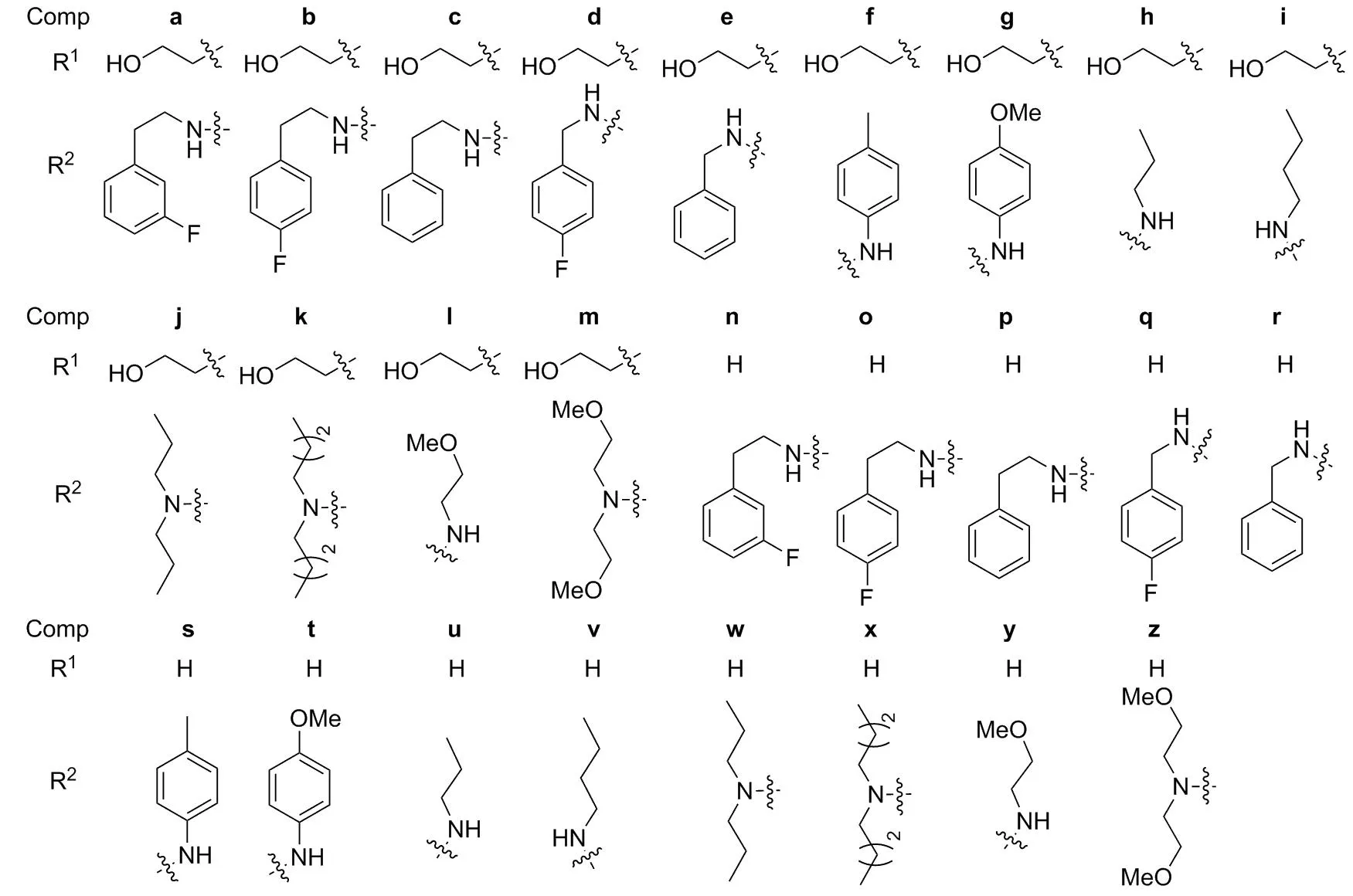
摘要:以2-丙硫基-4,6-二氯-5-氨基嘧啶为原料,与伯胺类化合物(1)经取代反应制得氨基嘧啶类化合物(2); 2经重氮化反应制得三氮唑类化合物(3); 3与胺类化合物经亲核取代反应和水解反应合成了26个新型的三唑并[4,5-d]嘧啶类化合物(6a~6z),其结构经1H NMR和ESI-MS表征。大鼠体内抗血小板聚集模型测试结果表明:26个化合物均具有一定的抗血小板聚集活性,其中,6d, 6i和6l的抗血小板聚集活性较强,抑制率分别为61.9%, 69.3%和71.2%。
关键词:三唑并[4,5-d]嘧啶; 合成; 抗血小板聚集活性
通信联系人: 王平保,研究员,硕士生导师, E-mail: wangpb@tjipr.com
血栓可导致急性心肌梗死、中风、肺栓塞等心脑血管疾病,严重威胁着人类的健康和生命[1]。P2Y12二磷酸腺苷(ADP)受体抑制剂通过选择性的抑制ADP达到抗凝血作用而得到广泛应用[2]。

Scheme 1
ADP受体拮抗剂分不可逆性和可逆性两类,三唑并[4,5-d]嘧啶类药物,如替格瑞洛【{1S-[1α,2α,3β(1S*,2R*),5β]}-3-{7-[2-(3,4-二氟苯基)环丙基氨基]-5-(丙硫基)-3H-[1,2,3]三唑并[4,5-d]嘧啶-3-基}-5-(2-羟基乙氧基)环戊烷-1,2二醇】(Ticagrelor, Chart 1)[3-4]为新型的可逆性ADP受体拮抗剂,由美国阿斯利康公司研发,于2010年12月首次在英国上市,临床上用于减少急性冠脉综合症,包括不稳定心绞痛,ST段抬高心肌梗死和非ST段抬高心肌梗死,以及经皮冠状动脉介入治疗后和冠状动脉旁路移植术后患者的心血管死亡和心脏病发作。Ticagrelor的代谢产物为AR-C124910XX(Chart 1),也具有抗血小板聚集活性[5]。替格瑞洛具有作用强、起效快、停药后恢复迅速、患者个体间差异小等一系列优点,但存在出血、产生呼吸困难等不良反应缺陷[6]。因此寻找更加安全有效的该类抗血栓药物具有一定的价值。

本研究在文献[7-11]方法的基础上,以替格瑞洛和AR-C124910XX为先导化合物,保留其药效基团三唑并[4,5-d]嘧啶母核,对嘧啶环进行结构修饰,通过生物电子等排和药物代谢原理,设计并合成了2个系列共计26个新型的三唑并[4,5-d]嘧啶类化合物(6a~6z)。以2-丙硫基-4,6-二氯-5-氨基嘧啶为原料,与伯胺(1a, 1n)经取代反应制得氨基嘧啶类化合物(2a, 2n); 2经重氮化反应制得三氮唑类化合物(3a, 3n); 3与胺类化合物经亲核取代反应和水解反应合成了6a~6z(Scheme 1),其结构经1H NMR和ESI-MS表征。并测定了6a~6z的抗血小板聚集活性。
1实验部分
1.1仪器与试剂
YRT-3型熔点仪(温度未校正);BRUKER AV400型核磁共振仪(DMSO-d6为溶剂,TMS为内标);VG ZAB-HS型质谱仪;CHRONO-LOG型血小板聚集仪。
4a~4m,阿拉丁试剂公司;其余所用试剂均为分析纯。
1.2合成
(1) 2a和2n的合成(以2a为例)
在反应瓶中加入2-丙硫基-4,6-二氯-5-氨基嘧啶10 g(40 mmol)和乙二醇30 mL,搅拌使其溶解;于室温(25 ℃)分批次加入2-{[(3aR,4S,6R,6aS)-6-氨基-2,2-二甲基四氢-4H-环戊二烯并[d][1,3]二氧杂环戊-4-基]氧基}乙基-1-醇的酒石酸盐(1a)16 g(44 mmol),加毕,滴加三乙胺14.5 g,滴毕(约15 min), N2保护下于100 ℃反应18 h。冷却至室温,加水30 mL,用乙酸乙酯(3×30 mL)萃取,合并有机相,用饱和食盐水(2×30 mL)洗涤,无水硫酸钠干燥,减压蒸除溶剂得褐色油状物,用混合溶剂[V(乙酸乙酯) ∶V(石油醚)=1 ∶5]重结晶得淡棕色粉末2-【【(3aR,4S,6R,6aS)-6-{[5-氨基-6-氯-2-(丙硫基)嘧啶-4-基]氨基}-2,2-二甲基四氢-4H-环戊二烯并[d][1,3]二氧杂环戊-4-基】氧基】乙基-1-醇(2a)15 g,收率85%,纯度97%;1H NMRδ: 0.95(t,J=3.6 Hz, 3H), 1.18(t,J=9.0 Hz, 3H), 1.14(s, 3H), 1.63(q,J=7.2 Hz, 2H), 1.86(d,J=13.6 Hz, 1H), 2.19~2.49(m, 1H), 2.95~2.99(m, 2H), 3.45~3.56(m, 4H), 3.87(s, 1H), 4.31(s, 1H), 4.47(d,J=6.0 Hz, 1H), 4.53(d,J=6.0 Hz, 1H), 4.70(s, 2H), 4.96(s, 1H), 6.55(d,J=7.2 Hz, 1H)。
用(3aR,4S,6R,6aS)-6-氨基-2,2-二甲基四氢-4H-环戊二烯并[d][1,3]二氧杂环戊-4-醇(1n)代替1a,用类似方法合成红褐色油状物(3aR,4S,6R,6aS)-6-{[ 5-氨基-6-氯-2-(丙硫基)嘧啶-4-基]氨基}-2,2-二甲基四氢-4H-环戊二烯并[d][1,3]二氧杂环戊-4-醇(2n),收率80%。
(2) 3a和3n的合成(以3a为例)
在反应瓶中加入2a 15 g(36 mmol),乙酸45 mL,于30 ℃搅拌使其完全溶解;滴加亚硝酸钠2.7 g(0.04 mol)溶液15 mL,滴毕,反应1 h;加入蒸馏水50 mL,用二氯甲烷(3×30 mL)萃取,合并有机相,依次用饱和Na2CO3溶液和饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂后得淡褐色油状物2-【{(3aR,4S,6R,6aS)-6-[7-氯-5-(丙硫基)-3H-[1,2,3]三唑并[4,5-d]嘧啶-3-基]-2,2-二甲基四氢-4H-环戊二烯并[d][1,3]二氧杂环戊-4-基}氧】乙基-1-醇(3a)15 g,收率97%;1H NMRδ: 1.02(t,J=7.2 Hz, 3H), 1.27(s, 3H), 1.49(s, 3H), 1.71~1.80(m, 2H), 2.56~2.64(m, 1H), 2.69~2.75(m, 1H), 3.15~3.23(m, 2H), 3.37(s, 3H), 3.39~3.48(m, 1H), 4.02(d,J=6.8 Hz, 1H), 4.19(s, 1H), 4.70(q,J=3.2 Hz, 1H), 5.15~5.19(m, 1H), 5.32(q,J=2.4 Hz, 1H)。
用2n代替2a,用类似方法合成淡黄色固体(3aR,4S,6R,6aS)-6-[7-氯-5-(丙硫基)-3H-[1,2,3]三唑并[4,5-d]嘧啶-3-基]-2,2-二甲基四氢-4H-环戊二烯并[d][1,3]二氧杂环戊-4-醇(3n),收率80%,纯度95%。
(3) 5a~5z的合成(以5a为例)
在反应瓶中加入3a 4.3 g(10 mmol),甲苯13 mL,于室温搅拌使其完全溶解;加入碳酸钾2.76 g和3-氟苯乙胺(4a)1.53 g(11 mmol),于30 ℃反应3 h(TLC跟踪)。加水13 mL,静置分层,甲苯层用饱和食盐水(2×15 mL)洗涤,无水硫酸钠干燥,减压蒸除溶剂后经硅胶色谱柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=1 ∶1]纯化得淡黄色固体2-【{(3aR, 4S, 6R, 6aS)-6-{7-[(3-氟苯乙基)氨基]-5-(丙硫基)-3H-[1,2,3]三唑并[4,5-d]嘧啶-3-基}-2,2-二甲基四氢-4H-环戊二烯并[d][1,3]二氧杂环戊-4-基}氧】乙基-1-醇(5a)3.87 g,收率72.6%。
用类似的方法合成5b~5m;用3n代替3a,用类似方法合成5n~5z。
(4) 6a~6z的合成(以6a为例)
在反应瓶中加入5a 5.3 g(10 mmol)和无水甲醇16 mL,于30 ℃搅拌使其完全溶解;滴加38%HCl 5 mL,于35 ℃反应10 h(TLC跟踪)。加水稀释至pH 3~4,析出白色固体,于室温搅拌30 min。抽滤,滤饼用水洗涤两次,干燥得白色固体(1S, 2S, 3R, 5S)-3-{7-[(3-氟苯乙基)氨基]-5-(丙硫基)-3H-[1,2,3]三唑并[4,5-d]嘧啶-3-基}-5-(2-羟基乙氧基)环戊烷-1,2二醇(6a)4.2 g,纯度99%。
用类似方法合成6b~6z。
6a: 白色固体,收率86.5%, m.p.129.1~130.9 ℃;1H NMRδ: 0.95(t,J=7.2 Hz, 3H), 1.68(q,J=9.3 Hz, 2H), 1.86(d,J=6.8 Hz, 1H), 2.54~2.62(m, 1H), 2.94(t,J=6.8 Hz, 2H), 3.05(t,J=6.8 Hz, 2H), 3.47(t,J=4.0 Hz, 4H), 3.72(d,J=5.6 Hz, 3H), 3.9(s, 1H), 4.50~4.56(m, 2H), 4.89~4.99(m, 1H), 5.01(d,J=4.0 Hz, 1H), 5.07(d,J=8.0 Hz, 1H), 6.96~7.13(m, 3H), 7.28(q,J=6.7 Hz, 1H), 9.01(d,J=4.0 Hz, 1H); ESI-MSm/z: 515.2{[M+Na]+}。
6b: 深黄色固体,收率95%, m.p.146.5~146.5 ℃;1H NMRδ: 0.95(t,J=7.2 Hz, 3H), 1.7(q,J=6.5 Hz, 2H), 1.98~2.13(m, 1H),2.58~2.65(m, 1H), 2.93(t,J=8.0 Hz, 2H), 3.06~3.09(m, 2H), 3.44~3.49(m, 4H), 3.73~3.76(m, 3H), 4.00(s, 1H), 4.52~4.59(m, 2H), 4.93~4.98(m, 1H), 5.01(t,J=2.0 Hz, 1H), 5.08(t,J=4.0 Hz, 1H), 7.11~7.15(m, 2H), 7.25~7.28(m, 2H), 9.02(t,J=6.0 Hz, 1H); ESI-MSm/z: 515.2{[M+Na]+}。
6c: 淡黄色固体,收率95%, m.p.138.5~140.5 ℃;1H NMRδ: 0.95(t,J=7.2 Hz, 3H), 1.69(q,J=8.0 Hz, 2H), 1.98~2.09(m, 1H), 2.63(q,J=5.3 Hz, 1H), 2.95(t,J=4.0 Hz, 2H), 3.03~3.11(m, 2H), 3.41~3.52(m, 4H), 3.70~3.78(m, 3H), 3.94(s, 1H), 4.52~4.58(m, 2H), 4.90~4.98(m, 1H), 5.01(t,J=4.0 Hz, 1H), 5.08(t,J=4.0 Hz, 1H), 7.11~7.23(m, 1H), 7.30~7.32(m, 4H), 9.03(t,J=4.0 Hz, 1H); ESI-MSm/z: 497.2{[M+Na]+}。
6d: 黄色固体,收率92%, m.p.157.2~159.5 ℃;1H NMRδ: 0.92(t,J=7.2 Hz, 3H), 1.60~1.68(m, 3H), 1.99~2.06(m, 1H), 2.57~2.64(m, 1H), 2.97~3.08(m, 2H), 3.44~3.49(m, 4H), 3.73~3.76(m, 1H), 3.92(t,J=2.0 Hz, 1H), 4.52~4.58(m, 2H), 4.68(s, 2H), 4.95(q,J=9.3 Hz, 1H), 5.13(s, 1H), 5.26(s, 1H), 7.10~7.16(m, 2H), 7.35~7.43(m, 2H), 9.50(s, 1H); ESI-MSm/z: 501.2{[M+Na]+}。
6e: 淡黄色固体,收率85.2%, m.p.126.8~128.3 ℃;1H NMRδ: 0.90(t,J=6.8 Hz, 3H), 1.56~1.65(m, 2H), 1.97~2.04(m, 1H), 2.46~2.62(m, 1H), 2.92~3.05(m, 2H), 3.35~3.47(m, 4H), 3.74(t,J=8.0 Hz, 1H), 3.90(d,J=2.0 Hz, 1H), 4.50~4.53(m, 1H), 4.67(d,J=4.0 Hz, 2H), 4.80(s, 3H), 4.91(q,J=7.2 Hz, 1H), 7.19(s, 1H), 7.27(t,J=4.0 Hz, 4H), 9.46(t,J=6.0 Hz, 1H); ESI-MSm/z: 483.2{[M+Na]+}。
6f: 黄色固体,收率89.7%, m.p.96.2~98.1 ℃;1H NMRδ: 0.92(t,J=6.8 Hz, 3H), 1.65~1.75(m, 2H), 2.28(s, 3H), 2.50~2.59(m, 1H), 2.69~2.72(m, 1H), 3.04~3.12(m, 2H), 3.40~3.46(m, 3H), 3.48~3.51(m, 1H), 3.99~4.04(m, 2H), 4.52~4.55(m, 1H), 4.67~4.69(m, 1H), 4.82(d,J=4.0 Hz, 1H), 4.95(q,J=6.8 Hz, 1H), 5.22~5.25(m, 1H), 7.18(d,J=4.0 Hz, 2H), 7.72(d,J=4.0 Hz, 2H), 9.10(d,J=4.0 Hz, 1H) ; ESI- MSm/z: 483.2{[M+Na]+}。
6g: 棕色固体,收率77.5%, m.p.99.8~101.5 ℃;1H NMRδ: 0.91(t,J=7.3 Hz, 3H), 1.61~1.70(m, 2H), 2.46~2.57(m, 1H), 2.63~2.69(m, 1H), 2.98~3.01(m, 2H), 3.38~3.42(m, 3H), 3.46(d,J=8.0 Hz, 1H), 3.73(s, 3H), 3.96~4.00(m, 1H), 4.51(t,J=6.0 Hz, 1H), 4.64~4.66(m, 2H), 4.81~4.87(m, 1H), 5.01~5.04(m, 1H), 5.10~5.19(m, 1H), 7.17(d,J=9.0 Hz, 2H), 7.98(d,J=8.0 Hz, 2H), 9.12(d,J=8.0 Hz, 1H); ESI-MSm/z: 499.2{[M+Na]+}。
6h: 白色固体,收率82.2%, m.p.150.5~152.3 ℃;1H NMRδ: 0.91(t,J=6.0 Hz, 3H), 0.96(t,J=9.0 Hz, 3H), 1.63~1.74(m, 4H), 1.99~2.06(m, 1H), 2.58~2.65(m, 1H), 3.02~3.12(m, 2H), 3.42~3.49(m, 3H), 3.51~3.53(m, 3H), 3.75(t,J=6.0 Hz, 1H), 3.93(s, 1H), 4.52~4.59(m, 2H), 4.95(q,J=7.3 Hz, 1H), 5.00(d,J=4.0 Hz, 1H), 5.08(d,J=6.4 Hz, 1H), 8.95(t,J=4.0 Hz, 1H); ESI- MSm/z: 435.2{[M+Na]+}。
6i: 白色固体,收率79.3%, m.p.150.5~152.4 ℃;1H NMRδ: 0.89(t,J=6.0 Hz, 3H), 0.98(t,J=9.0 Hz, 3H), 1.31~1.39(m, 2H), 1.56~1.62(m, 2H), 1.64~1.71(m, 2H), 2.01~2.09(m, 1H), 2.57~2.65(m, 1H), 3.01~3.12(m, 2H), 3.37~3.55(m, 6H), 3.61~3.65(m, 1H), 3.89~3.93(m, 1H), 4.52~4.58(m, 2H), 4.95(q,J=7.3 Hz, 1H), 5.00(d,J=1.2 Hz, 1H), 5.08(d,J=6.4 Hz, 1H), 8.94(t,J=4.0 Hz, 1H); ESI- MSm/z:449.3{[M+Na]+}。
6j: 淡黄色固体,收率76.4%, m.p.68.1~69.7 ℃;1H NMRδ: 0.90(t,J=7.3 Hz, 6H), 0.98(t,J=6.8 Hz, 3H), 1.66~1.73(m, 6H), 1.97~2.05(m, 1H), 2.49~2.64(m, 1H), 3.02~3.09(m, 2H), 3.44~3.53(m, 4H), 3.64(t,J=4.0 Hz, 2H), 3.74~3.77(m, 1H), 3.94~3.98(m, 1H), 4.10~4.13(m, 2H), 4.53~4.56(m, 2H), 4.92~5.02(m, 3H); ESI-MSm/z: 477.3{[M+Na]+}。
6k: 黄绿色油状液体,收率87%;1H NMRδ: 0.90(t,J=6.8 Hz, 6H), 0.95(t,J=7.3 Hz, 3H), 1.24~1.46(m, 4H), 1.60~1.70(m, 6H), 1.96~2.03(m, 1H), 2.55~2.62(m, 1H), 3.05~3.08(m, 2H), 3.42~3.50(m, 4H), 3.68(t,J=5.3 Hz, 2H), 3.74(d,J=4.0 Hz, 1H), 3.93(s, 1H), 4.13(d,J=5.6 Hz, 2H), 4.51~4.56(m, 1H), 4.62(d,J=4.4 Hz, 1H), 4.94(q,J=8.9 Hz, 1H), 5.09~5.14(m, 2H); ESI-MSm/z: 505.3{[M+Na]+}。
6l: 黄色固体,收率95%, m.p.94.2~96.2 ℃;1H NMRδ: 0.97(t,J=8 Hz, 3H), 1.68(q,J=8.3 Hz, 2H), 2.01~2.07(m, 1H), 2.58~2.69(m, 1H), 3.05~3.11(m, 2H), 3.26(s, 3H), 3.45~3.58(m, 6H), 3.65(q,J=5.3 Hz, 2H), 3.75(t,J=6.0 Hz, 1H), 3.93(s, 1H), 4.52~4.60(m, 2H), 4.95(q,J=10.2 Hz, 1H), 5.01(d,J=4.0 Hz, 1H), 5.08(d,J=6.4 Hz, 1H), 8.90(t,J=6.0 Hz, 1H); ESI-MSm/z: 451.2{[M+Na]+}。
6m: 黄色油状液体,收率90%;1H NMRδ: 0.97(t,J=8.3 Hz, 3H), 1.68(q,J=9.2 Hz, 2H), 1.99~2.06(m, 1H), 2.57~2.64(m, 1H), 3.03~3.09(m, 2H), 3.26(d,J=3.6 Hz, 6H), 3.30(s, 1H), 3.42~3.53(m, 4H), 3.59(t,J=5.8 Hz, 2H), 3.65(t,J=5.4 Hz, 2H), 3.73~3.77(m, 1H), 3.94(t,J=5.6 Hz, 2H), 4.41(d,J=2.4 Hz, 2H), 4.53~4.58(m, 2H), 4.95(t,J=9 Hz, 1H), 5.00(d,J=4.4 Hz, 1H), 5.07(d,J=6.4 Hz, 1H); ESI-MSm/z: 509.2{[M+Na]+}。
6n: 淡黄色固体,收率95%, m.p.152.8~154.5 ℃;1H NMRδ: 0.95(t,J=8.3 Hz, 3H), 1.65~1.74(m, 2H), 1.87~1.94(m, 1H), 2.53~2.61(m, 1H), 2.96(t,J=8.0 Hz, 2H), 3.01~3.14(m, 2H), 3.72~3.77(m, 2H), 3.92(d,J=4.0 Hz, 1H), 4.13(t,J=5.2 Hz, 1H), 4.61~4.73(m, 1H), 4.81(d,J=4.0 Hz, 1H), 4.86~4.89(m, 1H), 4.92~4.99(m, 1H), 5.07(d,J=4.0 Hz, 1H), 6.89~7.22(m, 3H), 7.33(q,J=8.0 Hz, 1H), 9.04(t,J=5.6 Hz, 1H); ESI-MSm/z: 471.2{[M+Na]+}。
6o: 淡灰色固体,收率90%, m.p.158.4~160.2 ℃;1H NMRδ: 0.97(t,J=3.6 Hz, 3H), 1.66~1.73(m, 2H), 1.88~1.94(m, 1H), 2.49~2.61(m, 1H), 2.93(t,J=6.8 Hz, 2H), 3.03~3.14(m, 2H), 3.21~3.33(m, 2H), 3.68~3.73(m, 1H), 3.78(s, 1H), 3.63(s, 1H), 4.63~4.67(m, 1H), 4.90~5.03(m, 3H), 7.03~7.12(m, 2H), 7.26(t,J=6.8 Hz, 2H), 9.02(t,J=5.2 Hz,1H); ESI-MSm/z: 471.2{[M+Na]+}。
6p: 白色固体,收率90%, m.p.164.3~165.2 ℃;1H NMRδ: 0.98(t,J=3.2 Hz, 3H), 1.65~1.74(m, 2H), 1.87~1.94(m, 1H), 2.53~2.61(m, 1H), 2.94(t,J=7.4 Hz, 2H), 3.04~3.13(m, 2H), 3.70~3.78(m, 3H), 3.92(s, 2H), 4.10(q,J=7.3 Hz, 2H), 4.62~4.70(m, 1H), 4.90~4.98(m, 1H), 7.19(t,J=6.8 Hz, 1H), 7.24~7.31(m, 4H), 9.04(t,J=5.6 Hz, 1H); ESI-MSm/z: 453.2{[M+Na]+}。
6q: 淡黄色固体,收率95%, m.p.164.5~165.8 ℃;1H NMRδ: 0.95(t,J=6.8 Hz, 3H), 1.56~1.70(m, 2H), 1.89~1.97(m, 1H), 2.54~2.61(m, 1H), 2.96~3.11(m, 2H), 3.78(t,J=4.0 Hz, 1H), 3.93(s, 1H), 4.63~4.69(m, 6H), 5.14(d,J=6.4 Hz, 1H), 7.13(t,J=8.8 Hz, 2H), 7.35~7.43(m, 2H), 9.50(t,J=4.0 Hz, 1H); ESI-MSm/z: 457.2{[M+Na]+}。
6r: 黄色固体,收率90%, m.p.132.3~133.5 ℃;1H NMRδ: 0.95(t,J=6.8 Hz, 3H), 1.59~1.68(m, 2H), 1.88~1.95(m, 1H), 2.54~2.61(m, 1H), 2.96~3.30(m, 2H), 3.77(s, 1H), 3.91(d,J=4.0 Hz, 1H), 4.61~4.66(m, 1H), 4.71(d,J=6.0 Hz, 2H), 4.87(d,J=4.0 Hz, 1H), 4.92(d,J=8.8 Hz, 1H), 4.98(t,J=7.2 Hz, 1H), 5.08(d,J=2.0 Hz, 1H), 7.22(t,J=6.6 Hz, , 1H), 7.28~7.38(m, 4H), 9.50(t,J=6.2 Hz, 1H); ESI-MSm/z: 439.2{[M+Na]+}。
6s: 红褐色固体,收率80%, m.p.65.6~67.7 ℃;1H NMRδ: 0.97(t,J=7.4 Hz, 3H), 1.65~1.74(m, 2H), 2.29(s, 3H), 2.44~2.51(m, 1H), 2.54~2.61(m, 1H), 3.08(m,J=7.2 Hz, 2H), 3.79(s, 1H), 3.94(s, 1H), 4.45~4.50(m, 2H), 4.83~4.90(m, 1H), 4.96~5.01(m, 1H), 5.03~5.09(m, 1H), 7.18(d,J=4.2 Hz, 2H), 7.71(d,J=4.0 Hz, 2H), 9.10(d,J=3.6 Hz, 1H); ESI-MSm/z: 439.2{[M+Na]+}。
6t: 红褐色固体,收率82%, m.p.101.1~103.6 ℃;1H NMRδ: 0.97(t,J=7.4 Hz, 3H), 1.65~1.72(m, 2H), 2.44~2.49(m, 1H), 2.54~2.61(m, 1H), 3.07(t,J=7.2 Hz, 2H), 3.76(s, 3H), 3.93(s, 1H), 4.09~4.18(m, 2H), 4.43~4.57(m, 1H), 4.70~4.83(m, 1H), 4.87~4.98(m, 1H), 5.01~5.08(m, 1H), 6.95(d,J=4.0 Hz, 1H), 7.17(d,J=4.4 Hz, 1H), 7.71(s, 1H), 8.80(d,J=4.4 Hz, 1H), 9.09(d,J=4.0 Hz, 1H); ESI-MSm/z: 455.2{[M+Na]+}。
6u: 白色固体,收率89%, m.p.164.9~165.9 ℃;1H NMRδ: 0.89(t,J=6.8 Hz, 3H), 0.96(t,J=7.3 Hz, 3H), 1.60~1.74(m, 4H), 1.88~1.94(m, 1H), 2.54~2.61(m, 1H), 3.02~3.11(m, 2H), 3.45(q,J=6.5 Hz, 2H), 3.77(s, 1H), 3.92(s, 1H), 4.64(q,J=6.5 Hz, 1H), 4.87(d,J=4.0 Hz, 1H), 4.92(t,J=8.8 Hz, 1H), 4.98(d,J=7.3 Hz, 1H), 5.08(d,J=4.0 Hz, 1H), 8.95(t,J=5.4 Hz, 1H); ESI-MSm/z: 391.2{[M+Na]+}。
6v: 淡橙色固体,收率92%, m.p.191.5~192.6 ℃;1H NMRδ: 0.87(t,J=6.8 Hz, 3H), 0.97(t,J=4.2 Hz, 3H), 1.31~1.39(m, 2H), 1.55~1.64(m, 2H), 1.65~1.73(m, 2H), 1.87~1.94(m, 1H), 2.53~2.61(m, 1H), 3.02~3.13(m, 2H), 3.50(q,J=6.7 Hz, 2H), 3.77(s, 1H), 3.86~3.93(m, 1H), 4.61~4.70(m, 1H), 4.87(d,J=3.6 Hz, 1H), 4.89~4.99(m, 2H), 5.07(t,J=4.2 Hz, 1H), 8.94(t,J=3.8 Hz, 1H); ESI-MSm/z: 405.2{[M+Na]+}。
6w: 黄色固体,收率85%, m.p.101.5~102.6 ℃;1H NMRδ: 0.85~0.92(m, 6H), 0.98(t,J=4.2 Hz, 3H), 1.67~1.74(m, 6H), 1.86~1.92(m, 1H), 2.53~2.60(m, 1H), 3.03~3.10(m, 2H), 3.66(t,J=7.4 Hz, 2H), 3.78(s, 1H), 3.93(d,J=3.6 Hz, 1H), 4.08~4.14(m, 2H), 4.61~4.66(m, 1H), 4.87(d,J=3.2 Hz, 1H), 4.90~4.98(m, 2H), 5.08(d,J=4.0 Hz, 1H); ESI-MSm/z: 433.3{[M+Na]+}。
6x: 黄色油状液体,收率87%;1H NMRδ: 0.88(t,J=4.2 Hz, 6H), 0.97(t,J=5.3 Hz, 3H), 1.28~1.39(m, 4H), 1.63~1.72(m, 6H), 1.86~1.97(m, 1H), 2.53~2.60(m, 1H), 3.02~3.10(m, 2H), 3.68(t,J=7.6 Hz, 2H), 3.79(s, 1H), 3.93(d,J=8.4 Hz, 1H), 4.09~4.17(m, 2H), 4.62~4.67(m, 1H), 4.87(d,J=4.0 Hz, 1H), 4.91~4.98(m, 2H), 5.08(d,J=4.0 Hz, 1H); ESI-MSm/z: 461.3{[M+Na]+}。
6y: 淡黄色固体,收率90%, m.p.146.5~148.2 ℃;1H NMRδ: 0.98(t,J=7.4 Hz, 3H), 1.65~1.74(m, 2H), 1.88~1.95(m, 1H), 2.54~2.61(m, 1H), 3.02~3.14(m, 2H), 3.28(d,J=12 Hz, 3H), 3.52~ 3.58(m, 2H), 3.63~3.68(m, 2H), 3.77(s, 1H), 3.92(s, 1H), 4.64(q,J=6.8 Hz, 1H), 4.87(d,J=4.0 Hz, 1H), 4.90~ 4.99(m, 2H), 5.07(d,J=4.0 Hz, 1H), 8.91(t,J=5.6 Hz, 1H); ESI-MSm/z: 407.2{[M+Na]+}。
6z: 淡黄色固体,收率85%, m.p.116.5~118.5 ℃;1H NMRδ: 0.98(t,J=7.4 Hz, 3H), 1.64~1.73(m, 2H), 1.87~1.94(m, 1H), 2.50~2.60(m, 1H), 3.03~3.11(m, 2H), 3.26(d,J=3.2 Hz, 3H), 3.30(s, 3H), 3.59(t,J=5.6 Hz, 2H), 3.66(t,J=6.4 Hz, 2H), 3.77(s, 1H), 3.94(t,J=5.8 Hz, 3H), 4.42(t,J=1.6 Hz, 2H), 4.63~4.67(m, 1H), 4.88(d,J=4.0 Hz, 1H), 4.92~4.99(m, 2H), 5.08(d,J=4.0 Hz, 1H); ESI-MSm/z: 465.3{[M+Na]+}。
1.3抗血小板聚集活性
选用200~250 g的健康雄性SD大鼠(SPF级)随机分组,实验设空白和替格瑞洛对照组,每组6只,灌胃给药,剂量30 mg·kg-1,给药溶剂均为10 mL·(kg·bw)-1。正常对照组给予等计量的0.5% CMC-Na,给药两小时后腹腔注射40 mg·kg-1戊巴比妥钠(1 ml·kg-1)麻醉,腹主动脉采血,用3.8%枸橼酸钠抗凝,分别制备富血小板血浆(PRP)和贫血小板血浆(PPP),测定ADP(终浓度:1.25 μmol·L-1)诱导的血小板最大聚集百分率[12],计算抑制率。
2结果与讨论
2.1合成
5的合成为亲核取代反应,空间位阻越大越不利于反应的进行。由于4j, 4k和4m为仲胺,加大了亲核取代反应的空间位阻,因此在合成5j, 5k和5m及5w, 5x和5z时,反应温度需升至100 ℃,反应时间也需要延长至6~7 h,反应才完全。
2.2抗血小板聚集活性
6a~6z的抗血小板聚集活性见表1。由表1可见,6a~6z均具有一定的抗血小板聚集活性;含有羟乙基的化合物(6a~6m)的抗血小板聚集活性强于其它化合物(6n~6z); 6d, 6i 和6l的活性较强,抑制率分别为61.9%, 69.3%和 71.2%。

表1 6的抗血小板聚集活性
3结论
设计并合成了26个新型三唑并[4,5-d]嘧啶类化合物。其抗血小板聚集活性测定结果表明:含有羟乙基的化合物(6a~6m)的抗血小板聚集活性强于其它化合物(6n~6z)。这为寻找更加安全有效的抗血栓药物提供了一定的参考价值。
参考文献
[1]张立夏. 抗血栓药物概况[J].中国医药指南,2012,10(15):454-456.
[2]Storey R F. Pharmacology and clinical trials reversibly-binding P2Y12inhibitors[J].Thromb Haemostasis,2011,105(1):75-81.
[3]Husted S, Giezen V. Ticagrelor:The first reversibly binding oral P2Y12 receptor antagonist[J].Cardiovascular Therapeutics,2009,27(4):259-274.
[4]霍韶伟,郭晔堃,钟静芬,等. 新型抗血小板药替卡格雷[J].上海医药,2012,33(03):21-23.
[5]刘美,刘梅林. 新型抗血小板药替卡格雷[J].中国新药杂志,2012,21(15):1703-1707.
[6]杨峥. 替卡格雷严重不良反应的国外研究进展[J].中国药物与临床,2013,13(03):343-345.
[7]Zhang H, Liu J, Zhang L Y,etal. Synthesis and biological evaluation of ticagrelor derivatives as novel antiplatelet sgents[J].Bioorganic and Medicinal Chemistry Letters,2012,22(04):3598-3602.
[8]Guile S, Ingall A, Willis P,etal. Novel compound:WO 9 905 143[P],1999.
[9]Maras N, Gazic S I, Sterk D. Synthesis of taiazolopyrimidine compounds:WO 2 013 092 900[P],2012.
[10]李学超,罗杰,向志祥,等. 一种替卡格雷的晶型及其制备方法:CN 103 664 958A[P],2013.
[11]黄阳,王兵,刘颖,等. 替卡格雷的合成工艺改进[J].合成化学,2015,23(7):650-652.
[12]Sayi P, Herbert J M, Pflieger A M,etal. Importance of hepatic metabolism in the antiaggregatine activity of thienopyridine clopidogrel[J].Biochemical Pharmacology,1992,44(3):527-532.
Synthesis and Anti-platelet Aggregation Activities of Novel Triazolo[4,5-d]pyrimidin Compounds
WANG Bing1,4,YANG Jing2,JIANG Xi-ming3,LIU Ying4,LIU Deng-ke4,WANG Ping-bao4*
(1. Graduate School, Tianjin Medical University, Tianjin 300070, China; 2. Department of Biology and Environmental Engineering, Tianjin Bohai Vocational and Technical College, Tianjin 300408, China; 3. Tianjin Pharmacn Medical Technology Co., Ltd., Tianjin 300384, China; 4. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China)
Abstract:The aminopyrimidines(2) were obtained via the substitution reaction of 4,6-dichloro-2-(propylthio)pyrimidin-5-amine with primary amines. Diazotization and coupling reaction of 2 provided thiazoles(3). Twenty-six novel triazolo[4,5-d]pyrimidin compounds(6a~6z) were synthesized by the nucleophilic subsititution reaction of 3 with substituted amines and hydrolysis orderly. The structures were characterized by1H NMR and ESI-MS. The anti-platelet aggregation activities were evaluated by platelet aggregation inhibition tests in rats. The results showed that 6a~6z exhibited certain anti-platelet aggregation activities. The inhibition rates of 6d, 6i and 6l were 61.9%, 69.3% and 71.2%, respectively.
Keywords:triazolo[4,5-d]pyrimidin; synthesis; anti-platelet aggregation activity
中图分类号:626.26; O626.41
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.03.15379
作者简介:王兵(1989-),男,山东潍坊人,硕士研究生,主要从事药物合成的研究。E-mail: wangbing2310@sina.com
基金项目:国家科技重大专项“重大新药创制”课题(2013ZX09102014)
收稿日期:2015-11-24
