GFP生色团衍生物的合成及其荧光性能
2016-04-20叶剑衡
叶剑衡, 王 超, 底 霄, 孙 健, 唐 卓
(1.中国科学院 成都生物研究所 天然药物室,四川 成都 610041; 2. 中国科学院大学,北京 100049)
·快递论文·
GFP生色团衍生物的合成及其荧光性能
叶剑衡1,2, 王超1*, 底霄1, 孙健1, 唐卓1*
(1.中国科学院 成都生物研究所 天然药物室,四川 成都610041; 2. 中国科学院大学,北京100049)
摘要:以N-甲基乙酰胺或N-甲基苯甲酰胺为起始原料,与氯乙酰氯经酰化反应后,与叠氮钠经取代反应制得二酰亚胺(2); 2在三苯基膦的催化下发生分子内氮杂Witting反应制得关键中间体——咪唑啉酮(3); 3与芳醛在碱性条件下经缩合反应合成了8个新型的GFP生色团衍生物(5a~5h),其结构经1H NMR和(13)C NMR表征。对5a~5h的激发波长和发射波长进行了研究。结果表明,与对羟基苯咪唑啉酮(p-HOBDI)相比,大部分化合物的发射波长发生了比较显著的红移,其中2-羟基-5-硝基苯咪唑啉酮的发射波长达614 nm。
关键词:GFP; 咪唑啉酮; 芳香醛; 合成; 光学性质
1962年,下村修等人在一种名为Aequorea Victoria的水母中发现绿色的荧光蛋白,简称GFP(Chart 1)[1]。GFP在蓝光的激发下会发出非常强的绿色荧光,其荧光性质引起了科学家的广泛关注和研究[2-5]。GFP由238个氨基酸组成,其生色基团是在蛋白质链折叠时,经过分子内脱水环化,并在氧气的存在下发生氧化脱氢得到的对羟基苯咪唑啉酮(p-HOBDI[6], Chart 1)。
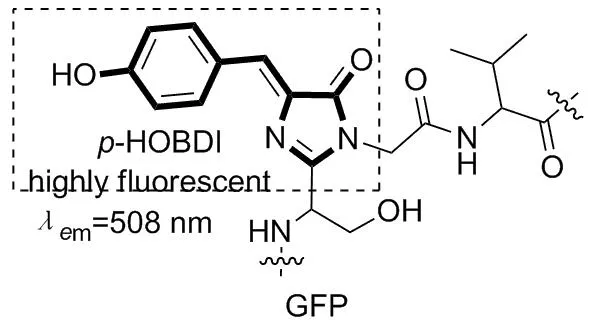
Chart 1

Scheme 1
然而,通过化学方法合成所得的生色团p-HOBDI,在溶液中几乎没有荧光[7]。这可能是由于p-HOBDI分子内的双键的扭转运动,导致其激发态电子通过无荧光形式跃迁返回基态[8-12]。2011年,Jaffrey小组[13]将GFP骨架的荧光小分子与某一段特定序列的RNA结合形成适配体(限制了分子内双键的转动),经光照可以发出绿色的荧光,这对特异性标记RNA序列或者是编码有荧光的RNA序列提供了参考,具有突破性的意义。然而,目前大多数以p-HOBDI为基础的荧光分子,荧光发射波长为395~500 nm,波长较短。随着荧光技术的不断进步、细胞成像技术和活体荧光成像诊断技术的不断成熟,对渗透能力强的长波长的荧光分子,特别是能发红光或近红外荧光的荧光分子的需求日益增加。因此我们希望通过改变分子结构,提高p-HOBDI分子内双键的转动能垒,让激发态电子尽量以发射荧光方式回到基态。
为此,本文拟以p-HOBDI结构为基础,设计合成发光能力更强,且荧光波长更长的荧光分子,并将其用于RNA的标记。以氮甲基乙酰胺(1a)或氮甲基苯甲酰胺(1e)为原料,首先与氯乙酰氯发生酰化反应,然后用叠氮钠对产物上的氯原子进行取代制得二酰亚胺(2a, 2e); 2在三苯基膦的作用下发生分子内关环制得关键中间体——咪唑啉酮(3a, 3e)[6]; 3与芳香醛(4a~4e, 4g~4h)经缩合反应合成了8个新型的p-HOBDI衍生物(5a~5h, Scheme 1),其结构经1H NMR和13C NMR表征。并对5的荧光性质进行了初步考察。
1实验部分
1.1仪器与试剂
Bruker 400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Thermo Scientific Varioskan Flash型光谱扫描多功能读数仪。
所用试剂均为分析纯。
1.2合成
(1) 2a的合成
在干燥的反应瓶中加入1a 7.3 g(0.1 mol),三乙胺15.2 mL和二氯甲烷100 mL,搅拌下缓慢滴加氯乙酰氯8.8 mL(0.11 mol),滴毕,于室温反应2 h。依次用水(3×30 mL)洗涤,用饱和食盐水(30 mL)洗涤,无水硫酸钠干燥;减压浓缩,剩余物用DMSO(100 mL)溶解,一次性加入叠氮钠13 g(0.2 mol),于室温反应12 h。倾入100 mL冰水中,用乙酸乙酯(3×50 mL)萃取,合并有机相,依次用水和饱和食盐水洗涤,无水硫酸钠干燥;减压浓缩后经硅胶柱层析[洗脱剂:A=V(石油醚) ∶V(乙酸乙酯)=4 ∶1]纯化得黄色油状液体2a,产率23%。
(2) 2e的合成
在干燥的反应瓶中加入1e 2.15 g(15.9 mmol)和甲苯50 mL,搅拌使其溶解;缓慢滴加氯乙酰氯1.4 mL(17.5 mmol),滴毕,回流反应12 h。减压浓缩,后处理同1.2(1)(洗脱剂:A=10 ∶1)得黄色油状液体2b,产率70%。
(3) 3的合成(以3a为例)
在反应瓶中加入2a 1.09 g(7 mmol)和甲苯35 mL,搅拌使其均匀;加入三苯基膦2.02 g(7.7 mmol),于室温反应12 h。反应液减压浓缩后经硅胶柱层析[洗脱剂:V(甲醇) ∶V(乙酸乙酯)=1 ∶19]纯化得黄色油状液体3a,产率87%。
用类似方法制得红色固体3e,产率88%。
(4) 5a~5h的合成(以5a为例)
在反应瓶中加入4-二乙基氨基水杨醛(4a) 193 mg(1 mmol), 3a 124 mg(1.1 mmol)和哌啶5 mL,搅拌下于室温反应12 h。用1 mol·L-1盐酸调至pH 5, 析出固体;抽滤,滤饼依次用水、石油醚和少量乙酸乙酯洗涤,干燥得黄色固体5a。
用类似方法合成黄色固体5b~ 5h。
5a: 产率70%;1H NMRδ: 7.60(d,J=7.4 Hz, 1H), 7.05 (s, 1H), 6.26(dd,J=9.0 Hz, 2.5 Hz, 1H), 6.05(d,J=2.5 Hz, 1H), 3.35(q,J=7.0 Hz, 4H), 3.11(s, 3H), 2.33(s, 3H), 1.11(t,J=7.0 Hz, 6H);13C NMRδ: 168.01, 160.60, 156.43, 152.43, 137.67, 129.36, 127.43, 109.32, 104.93, 98.55, 44.38, 26.77, 15.33, 13.11。
5b: 产率70%;1H NMRδ: 9.39(d,J=2.9 Hz, 1H), 8.14(dd,J=9.1 Hz, 2.9 Hz, 1H), 7.24(s, 1H), 7.08(d,J=9.1 Hz, 1H), 3.12(s, 3H), 2.41(s, 3H);13C NMRδ: 169.47, 165.48, 163.52, 140.22, 138.83, 129.12, 127.52, 121.40, 118.15, 117.27, 26.88, 15.94。
5c: 产率75%;1H NMRδ: 10.13(s, 1H), 7.98(d,J=1.6 Hz, 1H), 7.54(dd,J=8.4 Hz, 1.6 Hz, 1H), 7.15(d,J=8.4 Hz, 1H), 7.15(d,J=8.4 Hz, 1H), 7.12(t,J=74.7 Hz, 1H), 6.87(s, 1H), 3.10(s, 1H), 2.36(s, 1H);13C NMRδ: 170.81, 163.30, 152.33(dd,J=241.5 Hz, 7.6 Hz), 138.71, 136.58(t,J=16.5 Hz), 132.19, 129.36, 129.19, 125.47, 125.16(t,J=9.2 Hz), 116.00(dd,J=15.6 Hz, 6.9 Hz), 115.96, 115.89, 29.19。
5d: 产率40%;1H NMRδ: 10.57(s, 2H), 8.12(dd,J=9.1 Hz, 1.9 Hz, 2H), 6.90(s, 1H), 3.10(s, 3H), 2.36(s, 3H);13C NMRδ: 170.12, 164.66, 147.93, 143.79, 138.76, 137.93, 125.25, 123.72, 121.72, 119.81, 26.75, 15.90。
5e: 产率69%;1H NMRδ: 10.22(s, 1H), 8.18(d,J=8.7 Hz, 2H), 7.93(dd,J=8.0 Hz, 1.6 Hz, 2H), 7.68~7.46(m, 3H), 7.12(s, 1H), 6.87(d,J=8.8 Hz, 2H), 3.27(s, 3H);13C NMRδ: 171.05, 161.48, 160.51, 136.72, 135.10, 131.79, 129.70, 129.27, 129.08, 128.26, 125.93, 116.39, 29.10。
5f: 产率66%;1H NMRδ: 9.56(d,J=2.9 Hz, 1H), 8.14(dd,J=9.1 Hz, 2.9 Hz, 1H), 7.95(d,J=6.7 Hz, 2H), 7.72~7.61(m, 3H), 7.44(s, 1H), 7.04(d,J=9.1 Hz, 1H), 3.30(s, 3H);13C NMRδ: 170.46, 164.16, 163.47, 140.04, 138.98, 132.50, 129.43, 129.34, 129.19, 129.00, 127.80, 121.56, 119.92, 117.34, 29.34。
5g: 产率71%;1H NMRδ: 8.06(d,J=9.1 Hz, 2H), 7.99~7.90(m, 2H), 7.71~7.54(m, 3H), 7.12(s, 1H), 3.27(s, 3H);13C NMRδ: 170.81, 163.30, 152.33(dd,J=241.5 Hz, 7.6 Hz), 138.71, 136.58(t,J=16.5 Hz), 132.19, 129.36, 129.19, 125.47, 125.16(t,J=9.2 Hz), 116.00(dd,J=15.6 Hz, 6.9 Hz), 115.96, 115.89, 29.19。
5h: 产率68%;1H NMRδ: 9.27(s, 1H), 7.96(d,J=6.2 Hz, 2H), 7.76(s, 2H), 7.61(d,J=7.4 Hz, 3H), 7.12(s, 1H), 3.81(s, 6H), 3.29 (s, 3H);13C NMRδ: 171.00, 161.24, 148.35, 139.59, 136.96, 131.83, 129.74, 129.34, 128.97, 128.70, 125.03, 110.90, 56.41, 29.22。
1.3荧光测定
将5配成40 mmol·L-1的二甲亚砜溶液,取5 μL溶于1 mL HEPES缓冲盐溶液中(由于5f在缓冲液中的溶解度较低,需要补加10%DMSO溶液100 mL),用酶标仪测量其光学性质。
2结果与讨论
2.1荧光性质
5的荧光性质见表1。从表1可见,除5c和5e外,其余化合物的发射波长在500 nm以上。这可能是因为5中的Ar需要有明显的强供电子基或强吸电子来提高分子内双键的转动能垒,让激发态电子尽量以发射荧光方式回到基态。通过对比5b和5c,可以发现芳环上有吸电子取代基时更利于发射光谱的红移。从5b到5f的发射波长变化可以看出,增加分子的共轭体系,有利于发射波长的红移。5b的Stock位移达到了180 nm。基于这些荧光小分子的适配体筛选的相关工作正在进行中。
从N-甲基取代的乙酰胺或苯甲酰胺出发,经4步反应顺利合成了p-HOBDI衍生物5。在此基础之上,对所合成化合物进行了光学性质研究,发现大多数化合物在溶液中有较强的荧光强度。与p-HOBDI相比,其发射波长发生了较显著的红移,这为此类化合物的进一步应用提供了理论基础。

表1 5a~5h的荧光性质
参考文献
[1]Shimomura O, Johnson F H, Saiga Y. Extraction,purification and properties of aequorin,a bioluminescent protein from the luminous hydromedusan,aequorea[J].J Cell Comp Physiol,1962,59(3):223-239
[2]Zimmer M. Green fluorescent protein (GFP):Applications,structure,and related photophysical behavior[J].Chem Rev,2002,102(3):759-782.
[3]Chalfie M, Kain S. Green Fluorescent Protein:Properties,Applications,and Protocols[M].Hoboken:Wiley-Intersciences,2005.
[4]Tsien R Y. The green fluorescent protein[J].Annu Rev Biochem,1998,67(1):509-544.
[5]TolbertL M, Baldridge A, Kowalik J,etal. Collapse and recovery of green fluorescent protein chromophore emission through topological effects[J].Acc Chem Res,2011,45(2):171-181.
[6]Wu L X, Burgess K. Synthesis of highly fluorescent GFP-chromophore analogues[J].J Am Chem Soc,2008,130:4089-4096.
[7]Chattoraj M, King B A, Bublitz G U,etal. Ultra-fast excited state dynamics in green fluorescent protein: multiple states and proton transfer[J].PNAS,1996,93(16):8362-8367.
[8]Hsieh C C, Chou P T, Shih C W,etal. Comprehensive studies on an overall proton transfer cycle of the ortho-green fluorescent protein chromophore[J].J Am Chem Soc,2011,133(9):2932-2943.
[9]Dong J, Abulwerdi F, Baldridge A,etal. Isomerization in green fluorescent protein chromophores involves addition/elimination[J].J Am Chem Soc,2008,130(43):14096-14098.
[10]Olsen S, Smith S C. Bond selection in the photoisomerization reaction of anionic green fluorescent protein chromophore models[J].J Am Chem Soc,2008,130(27):8677-8689.
[11]Forbes M W, Jockusch R A. Deactivation pathways of an isolated by green fluorescent protein model chromophore studies by electronic action spectroscopy[J].J Am Chem Soc,2009,131(47):17038-17039.
[12]Usman A, Mohammed O F, Tolbert L M,etal. Excited-state structure determination of the green fluorescent protein chromophore[J].J Am Chem Soc,2005,127(32):11214-11215.
[13]Paige J S, Wu K, Jaffrey S R. RNA mimics of green fluorescent protein[J].Science,2010,333:642.
Synthesis and Fluorescence Properties of the GFP Chromophores’ Derivatives
YE Jian-heng1,2,WANG Chao1*,DI Xiao1,SUN Jian1,TANG Zhuo1*
(1. Natural Products Research Center, Chengdu Institute of Biology, Chinese Academy of Sciences,Chengdu 610041, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Abstract:Eight novel analogs(5a~5h) of fluorescent protein chromophore were designed and synthesized by condensation between aromatic aldehydes and imidazolinones, which were obtained by acetylation, substitution and Wittiong reaction, starting from N-methylacetamide or N-methylbenzamide. The structures were characterized by1H NMR and ( 13)C NMR. The optical study showed that the fluorescent emission wavelengths of most compounds were red-shifted compared with p-hydroxybenzylideneimidazolinone. The emission wavelength of (Z)-4-(2-hydroxy-5-nitrobenzylidene)-1-methyl-2-phenyl-1H-imidazol-5(4H)-one was 614 nm.
Keywords:GFP; imidazolinone; aromatic aldehyde; synthesis; optical property
中图分类号:O625.15; O621.3
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.03.15135
作者简介:叶剑衡(1989-),男,汉族,四川雅安人,硕士研究生,主要从事有机小分子催化和荧光小分子研究。 E-mail: ye_jianheng@163.com通信联系人: 王超,副研究员, E-mail: wangchao@cib.ac.cn; 唐卓,研究员, E-mail: tangzhuo@cib.ac.cn
基金项目:国家863项目子课题
收稿日期:2015-04-16;
修订日期:2016-01-28
