甲醛经口染毒致小鼠脏器损伤和炎症反应的研究
2016-04-20尤会会沈世萍梅宇飞李金泉朱雨晴李潇潇丁书茂华中师范大学生命科学学院遗传调控与整合生物学湖北省重点实验室湖北武汉430079
赵 云,尤会会,沈世萍,郭 晴,梅宇飞,李金泉,朱雨晴,李潇潇,丁书茂,杨 旭(华中师范大学生命科学学院,遗传调控与整合生物学湖北省重点实验室,湖北 武汉 430079)
甲醛经口染毒致小鼠脏器损伤和炎症反应的研究
赵云,尤会会,沈世萍,郭晴,梅宇飞,李金泉,朱雨晴,李潇潇,丁书茂,杨旭∗(华中师范大学生命科学
学院,遗传调控与整合生物学湖北省重点实验室,湖北 武汉 430079)
摘要:为探讨在单独染毒和卵清蛋白(OVA)联合致敏的条件下,甲醛灌胃染毒对小鼠造成的毒性效应,将雄性Balb/c小鼠随机分为7组:对照组(蒸馏水组);OVA致敏组;2mg/(kg⋅d) FA(甲醛)组;20mg/(kg⋅d) FA组;200mg/(kg⋅d) FA组;200mg/(kg⋅d )FA+ OVA组;200mg/(kg⋅d) FA+ OVA +MT(褪黑素)组,以蒸馏水和不同浓度甲醛溶液灌胃,连续21d. OVA致敏组,200mg/(kg⋅d) FA+ OVA组,200mg/(kg⋅d) FA+ OVA +MT组在第6,13,20d进行腹腔注射OVA致敏;此外,200mg/(kg⋅d) FA+ OVA +MT组,每天用1.0mg/mL褪黑素灌胃小鼠(小鼠灌胃剂量10mg/(kg⋅d)),连续21d.检测肝,肾和肺组织中活性氧自由基(ROS),丙二醛(MDA)和还原型谷胱甘肽(GSH)的含量,并采用ELISA法检测肝组织中IL-4和IFN -γ的水平.结果表明,与对照组相比,甲醛浓度为200mg/(kg⋅d),小鼠肝脏ROS含量增加(P<0.05),MDA含量增加以及小鼠肾脏GSH含量降低,均有显著性差异(P<0.05).OVA作为致敏剂,甲醛浓度为200mg/(kg⋅d)时,肝组织中IL-4(Interleukin-4)含量增加(P<0.01),10mg/(kg⋅d)褪黑素能够降低200mg/(kg⋅d)甲醛+OVA染毒小鼠肝脏内ROS含量(P<0.05).综上,200mg/(kg⋅d)甲醛灌胃染毒能使小鼠产生氧化损伤和炎症反应, ROS, MDA水平上升(P<0.05),GSH水平下降(P<0.05),肝脏中细胞因子IL-4水平上升(P<0.01), IFN -γ水平下降(P<0.05).
关键词:甲醛;卵清蛋白;小鼠;氧化损伤;炎症反应
* 责任作者, 教授, yangxu@mail.ccnu.edu.cn
环境中甲醛的主要污染来源是有机合成,化工,合成纤维,染料,木材加工及制漆等行业排放的废水,废气等.某些有机化合物在环境中降解也产生甲醛,如氯乙烯的降解产物也包含甲醛.流行病学和动物研究表明,甲醛暴露均可使机体产生多种毒理效应,包括免疫毒性,神经毒性,生殖毒性,遗传毒性[1-4].甲醛还可导致呼吸道和眼部刺激作用,致敏作用,免疫毒性和各组织器官氧化损伤[5].氧化损伤是机体在暴露于毒性物质后,产生过量的活性氧自由基,过量的自由基直接攻击生物大分子产生的损伤[6].甲醛的氧化损伤作用主要体现在其对抗氧化系统的抑制作用,使机体内的自由基不能及时清除而堆积,最终对机体产生广泛的损害作用[7].活性氧ROS在炎症部位诱导组织产生损伤,与气道炎症的发病密切相关. Reidel等[8]研究表明,豚鼠连续超过5d的0.4mg/kg甲醛暴露,显著促进了吸入卵清蛋白(OVA)过敏原的致敏作用.Tarkowski等[9]发现经OVA滴鼻致敏的小鼠持续10d暴露于1.6mg/kg甲醛能够增加OVA特异性抗体IgE的产生.经口暴露途径往往因为其在人体的多种暴露途径中并非十分重要而常被忽视,但是由于食品中含有的甲醛可能使很多人经口腔摄入甲醛,因而甲醛的经口暴露途径对人体健康的危害绝不能被低估.虽然上述实验对吸入甲醛致机体产生氧化损伤及炎症反应进行研究,但通过甲醛经口染毒致小鼠脏器损伤及产生过敏性体质的相关研究尚未见报道.干扰素γ(IFN-γ)和白细胞介素4(IL-4)分别是Th2型和Th1型过敏性炎症反应的细胞因子,测定肝脏中的IL-4和IFN-γ的含量,可反映甲醛对小鼠造成的过敏性炎症反应.本实验以雄性Balb/c小鼠为实验动物,采用灌胃和腹腔注射的方法进行甲醛和OVA联合染毒,测定肝,肾和肺组织中活性氧自由基(ROS),丙二醛(MDA)和还原型谷胱甘肽(GSH)的含量,并采用ELISA法检检测肝组织中IL-4和IFN-γ的含量,以期为进一步探讨通过消化道途径进入机体的甲醛所造成的危害及其毒作用机制提供科学依据.
1 材料与方法
1.1实验动物
选用湖北省疾病控制中心供给的SPF级雄性Balb/c小鼠[5~6周龄,(22±1.5) g].购买后饲养于华中师范大学实验动物管理中心的屏障环境中,给予充足的饮水和饲料,料购于湖北省实验动物中心.5d适应性饲养之后进行实验.
1.2试剂与仪器
试剂包括甲醛(FA)原液(Sigma, 4%),卵清蛋白(OVA, Sigma),氢氧化铝胶体(Sigma,分析纯),褪黑素(Melatonin, MT,国奥联信),硫代巴比妥酸(Thiobarbituric acid, TBA,分析纯,国药集团),2’, 7’-二氯荧光黄双乙酸盐(DCFH-DA 荧光染料, 99.9%,Sigma),微量还原型谷胱甘肽(GSH)试剂盒(南京建成),福林酚试剂盒(南京建成),小鼠IL-4酶联免疫试剂盒(eBioscience, USA),IFN-γ试剂盒(eBioscience, USA).仪器包括全波长酶标仪(Bio-Tek, USA),-70℃冰箱,低温冷冻离心机(Eppendorf-5415R),FL×800荧光酶标仪(Bio-Tek, USA),三用电热恒温水箱,超声处理器.
1.3实验方法
1.3.1溶液配制甲醛溶液:每天给小鼠灌胃的甲醛溶液体积(mL)与其体重(g)比值为0.01,灌胃浓度为2mg/(kg⋅d),20mg/(kg⋅d),200mg/(kg⋅d).经计算,用蒸馏水将4%甲醛原液分别稀释200,20,2倍可得以上浓度的甲醛染毒液;OVA致敏液: 1.67mg OVA+58.4mg Al(OH)3+10mL生理盐水,超声溶解;生理盐水:0.9% NaCl溶液;褪黑素(MT):小鼠灌胃剂量10mg/(kg⋅d).称取一定量的褪黑素粉末,用2%的无水乙醇助溶,再用生理盐水定容至一定体积,褪黑素溶液浓度为1mg/mL,现用现配.
1.3.2染毒方案将49只Balb/c小鼠随机分为7组,每组7只,分别为:A.蒸馏水(DI water)组; B. OVA致敏组;C. 2mg/(kg⋅d) FA组;D. 20mg/(kg⋅d) FA组;E. 200mg/(kg⋅d) FA组;F. 200mg/(kg⋅d) FA+ OVA组;G. 200mg/(kg⋅d) FA+ OVA + MT组(图1).采用灌胃法,分别用蒸馏水和不同浓度甲醛溶液对小鼠进行灌胃,连续染毒21d. OVA致敏组, 200mg/(kg⋅d)FA+OVA组,200mg/kg/d FA+ OVA +MT组小鼠分别在第6,13,20d通过腹腔注射OVA致敏;200mg/(kg⋅d) FA+ OVA +MT组小鼠用浓度为1mg/mL褪黑素灌胃,即小鼠每日摄入褪黑素剂量为10mg/(kg⋅d),连续21d.灌胃容量为0.01mL/g.

图1 实验分组及染毒流程Fig.1 Experiment groups and exposure process
1.3.3组织匀浆制备第22d采用脱颈法处死小鼠,立即摘取肝、肾、肺3个脏器,在冰冷的PBS (PH7.5)中漂洗,以去除表面血迹.在定型滤纸上拭干,称重,加入一定量PBS(pH 7.5),用玻璃匀浆器在冰上制成10%的组织匀浆,将匀浆液离心(10000r/min, 10min,4℃),取上清,将上清液分装后冻存于-70℃冰箱,用于指标的测定.
1.3.4各项生物学指标的测定ROS含量的测定:取一定量10%匀浆液,加入适量PBS稀释,肝,肾组织匀浆稀释2倍,肺组织匀浆不稀释; DCFH-DA荧光染料用PBS稀释1000倍.取100μL稀释液于酶标板中排列,并加入100μL DCFH-DA荧光染料染色,避光反应10min. DCFH-DA能转化生成DCFH,在活性氧的存在条件下,DCFH 被氧化成荧光物质DCF,用FL× 800荧光酶标仪在激发波长488nm和发射波长525nm下检测DCF的吸光值,根据标准曲线计算出ROS的含量.MDA含量的测定:MDA含量的测定采用硫代巴比妥酸(TBA)法,MDA 可与TBA 缩合,形成红色产物,且在532nm处有最大吸收峰.取100μL 10%的匀浆液,加入400μL 0.6%TBA溶液,沸水浴15min.取上清液,离心(10000r/min,10min,4℃),取上清液200μL于酶标板,用全波长酶标仪检测,分别在450、532和600nm波长下测定吸光度,按照公式C=[6.45 (OD532nm-OD600nm)-0.56OD450nm]/prot计算出MDA含量(μmol/mg prot).GSH含量的测定:用还原型谷胱甘肽(GSH)试剂盒来检测各组织中的浓度,具体做法按照试剂盒的说明书进行操作.IL-4和IFN-γ含量的测定:通过酶联免疫吸附法(ELISA)检测肝脏组织中的IL-4和IFN-γ含量,灵敏度分别为4pg/mL和15pg/mL.具体做法按照ELISA试剂盒的说明书进行操作.
1.3.5统计分析实验数据均采用平均值±标准误表示.Origin 6.1,Graphpad Prism5统计分析软件对实验数据进行分析,应用单因素方差分析(one-way ANOVA)检验组间均值的差异,之后采用LSD检验进行两两比较,显著水平α定为P<0.05.
2 结果
2.1体重变化及脏体比

图2 各组小鼠体重变化Fig.2 Weight changes of mice in different groups
2.1.1体重变化如图2所示,与对照组相比,OVA组,2FA组和20FA组的小化,无统计学意义(P>0.05);200FA组和200FA+OVA组小鼠体重随着染毒时间增长降低,有统计学意义(P<0.05).
2.1.2脏体比如图3所示,与对照组相比,OVA 组,2FA组和20FA组的小鼠肺、肝、肾三个脏器的脏体比没有明显差异,无统计学意义(P>0.05); 而200FA组和200FA+OVA组小鼠肺的脏体比增加,有统计学差异(P<0.01),肝的脏体比增加,有统计学差异(P<0.05);肾脏体比无明显变化,无统计学意义(P>0.05).

图3 各组小鼠脏体比Fig.3 Organ-body ratios of mice in different groups
2.2脏器氧化损伤

图4 各组小鼠脏器ROS含量Fig.4 The ROS content in different organs in different groups
2.2.1ROS含量变化如图4所示,不同实验组小鼠各脏器ROS含量变化趋势相同,均随染毒剂量增加而上升.与对照组相比,小鼠肺部各不同处理组间ROS含量均无统计学意义(P>0.05).在小鼠肝脏中,甲醛单独染毒组20FA组,ROS含量无显著变化(P>0.05);OVA组,200FA+OVA和200FA+OVA+MT组与对照组相比,ROS含量增加(P<0.01),200FA组ROS含量增加(P<0.05),在小鼠肾脏中, 200FA,200FA+OVA组ROS含量增加(P<0.01), OVA组,200FA+OVA+MT组ROS含量增加(P<0.05).与OVA组相比,200FA+OVA组小鼠肾脏中ROS含量增加(P<0.01).与200FA+ OVA组相比,200FA+OVA+MT组的小鼠肝脏内ROS含量下降(P<0.05),肾脏内ROS含量下降(P<0.01).

图5 各组小鼠脏器MDA含量Fig.5 The MDA content in different organs in different groups
2.2.2MDA含量变化如图5所示,不同处理组小鼠各脏器MDA含量的变化趋势基本一致.与对照组相比,OVA致敏组小鼠肺部MDA含量上升(P<0.05),肝脏MDA含量增加(P<0.01); 200FA组小鼠肺部和肝脏MDA含量高于对照组(P<0.05);200FA+OVA组中,小鼠各脏器MDA含量均高于对照组(P<0.05),肝脏MDA含量极显著增加 (P<0.01);200FA+OVA+MT组中,小鼠各脏器MDA含量均高于对照组,但只有肝脏含量增加具有统计学意义(P<0.05).相比于200FA+OVA 组,给予MT的小鼠脏器内MDA含量有所下降,但无统计学意义(P>0.05);与OVA致敏组相比,200FA+OVA组MDA含量无明显增加(P>0.05).
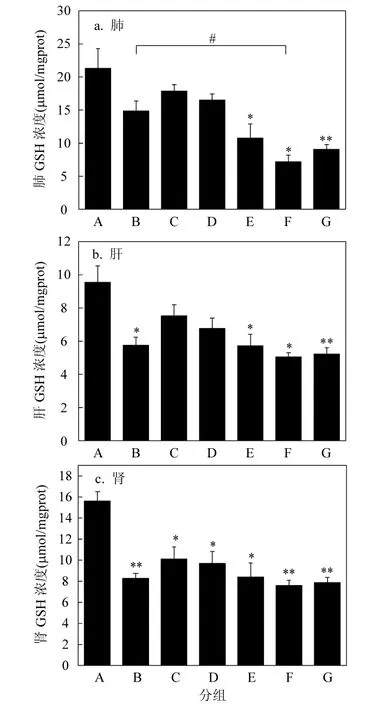
图6 各组小鼠脏器GSH 含量Fig.6 The GSH content in different organs in different groups
2.2.3GSH含量变化结果如图6所示,与ROS 和MDA含量相比,不同处理组小鼠各脏器内GSH含量变化呈相反趋势.其中对照组含量最高,OVA致敏组小鼠肝,肾GSH含量低于对照组(P<0.05);与对照组相比,2FA组肺和肝脏内GSH含量无明显变化(P>0.05);200FA组小鼠肺部GSH含量降低(P<0.05),肝脏GSH含量降低(P<0.05);200FA+OVA组小鼠肺和肝脏GSH含量均低于对照组(P<0.05),肾脏GSH含量低于对照组(P<0.01);与OVA致敏组相比,200FA+OVA组小鼠肺部GSH含量降低(P<0.05).与200FA+OVA组相比,200FA+OVA+MT组小鼠脏器内GSH含量没有显著变化(P>0.05).

图7 各组小鼠肝脏IL-4、IFN-γ 含量Fig.7 The IL-4and IFN-γ content in the liver of mice in different groups
2.3肝脏中细胞因子IL-4、IFN-γ的含量变化IL-4结果见图7a,与对照组相比,OVA致敏组, 200FA 组,200FA+OVA组,200FA+OVA+MT组小鼠肝脏IL-4含量显著增高(P<0.01);200FA+ OVA组小鼠肝脏IL-4含量高于OVA致敏组(P<0.05);与200FA+OVA组相比,200FA+ OVA+ MT组的小鼠脏器内IL-4含量有所下降,但无统计学意义(P>0.05). IFN-γ结果见图7b,与对照组相比,各不同处理组小鼠肝脏内IFN-γ含量无显著变化(P>0.05);与OVA致敏组相比, 200FA+ OVA组小鼠肝脏IFN-γ含量变化无显著变化(P>0.05);相比于200FA+OVA组,200FA+ OVA+ MT组小鼠肝脏IFN-γ含量变化无统计学意义(P>0.05).
3 讨论
3.1致敏剂的选择
OVA作为一种常见的过敏原,被广泛应用于多种动物模型中[10].很多研究中,OVA用来构建动物哮喘模型.Qiao等[13]利用OVA免疫大鼠成功构建了Wistar大鼠哮喘模型,进而探究气态甲醛的佐剂作用; Liu等[14]在Qiao的工作基础上,进一步探讨了甲醛对OVA构建的哮喘小鼠超敏反应的佐剂效应.杨剑婷等[13]用OVA构建的小鼠致敏模型作为阳性对照,对白果蛋白过敏动物模型进行试验研究.本研究也选取了OVA这种常见致敏剂用以构建Balb/c小鼠致敏模型.
3.2甲醛的氧化损伤作用
甲醛本身及代谢过程中均可产生活性氧自由基ROS,ROS可直接与DNA分子发生反应,导致DNA链断裂,碱基修饰和DNA蛋白交联等氧化损伤[5].同时甲醛能够抑制超氧化物歧化酶(SOD)活性,使过量自由基不能及时清除,间接损伤生物大分子和组织[14].正常情况下,机体存在完善的自由基清除系统,使体内自由基的产生与消除处于动态平衡中,若机体受到外在刺激,例如甲醛导致发生氧化应激,从而自由基不能被及时清除,过量的自由基攻击靶分子,可造成组织,器官及机体不同程度的损伤[14-15].本实验中,高浓度甲醛造成小鼠体重下降,说明甲醛对小鼠的机体造成一定程度的损伤.过量的ROS可攻击生物膜中多不饱和脂肪酸,引发脂质过氧化作用并形成脂质过氧化物,而MDA则是脂质过氧化最终的分解产物[16].ROS还可以与还原性谷胱甘肽(GSH)结合形成硫代半缩醛,导致GSH损竭,使机体抗氧化能力显著降低[15].本研究表明高浓度甲醛(200mg/(kg⋅d))可以使小鼠肝脏中ROS含量大大增多,而在200FA+OVA组中含量达到最大,并显著高于OVA组,可见高浓度甲醛不仅造成小鼠肝脏氧化损伤,还能加重已有的损伤,MDA的含量变化也呈现类似结果,GSH测定结果恰好相反,其含量随染毒浓度增高而下降,反映出机体抗氧化能力显著降低.
3.3甲醛的致敏作用
实验数据表明,OVA致敏组的IL-4含量显著增加,而对该组小鼠给予高浓度甲醛[200mg/(kg⋅d)]的小鼠,IL-4含量增加极显著,而同样条件下,IFN-γ的含量没有明显的变化.这样的结果表明,甲醛的暴露更多导致的是Th2型反应,并且能够促进和增强OVA已致敏小鼠产生Th2型反应.ROS被视为一种能造成组织损伤的炎症介质,可能参与干扰炎症细胞,诸如嗜酸性粒细胞Th1/Th2型过敏反应的平衡[17].实验结果显示,200FA+OVA组小鼠肝脏中ROS含量最高,同时IL-4的含量也最高.该结果表明,ROS含量的增加可能会导致Th2型细胞因子表达上调.
3.4 褪黑素的抗氧化作用
褪黑素是生物体内一种常见的分子,具有多种功能,最重要的特点之一即是一种良好的抗氧化剂[18].实验结果显示,甲醛和OVA联合染毒的小鼠灌胃褪黑素能够使小鼠各脏器内ROS和MDA含量下降,而使GSH含量上升,变化不显著可能是因为本次实验当中使用的褪黑素浓度不高所致.其发挥抗氧化作用可能是因为MT吲哚环上的5-甲氧基极大增强了MT捕获自由基的能力,而N-乙酰基则保护了MT不被单胺氧化酶降解,上述两个基团是MT清除包括氧自由基在在内的活性氧的必需基团[15].同时,可能由于褪黑素减少了自由基的产生,相对增加了组织中GSH浓度,自由基的减少使SOD和GSH- PX的消耗减少,相应提高了SOD和GSH- PX的活性,而SOD和GSH- PX活性的提高又可以进一步清除自由基,降低自由基对机体的损伤,这样形成一个良性循环[13].
4 结论
本实验结果表明,高浓度甲醛[200mg/ (kg⋅d)]暴露可对小鼠脏器造成明显的氧化损伤,并提高小鼠肝脏IL-4表达水平(P<0.01),能够引发Th2型过敏性炎症反应;对于OVA致敏小鼠,高浓度甲醛[200mg/(kg⋅d)]可以显著性地加重其脏器的氧化损伤程度以及Th2型炎症反应;小鼠不同脏器对甲醛暴露产生的损伤和过敏反应程度不同,其中肝脏,肾脏较为严重;褪黑素在一定程度上可以保护机体,减弱机体因甲醛暴露所致的损伤.
参考文献:
[1] Tang X, Bai Y, Duong A, et al. Formaldehyde in China: production, consumption, exposure levels, and health effects [J]. Environment International, 2009,36(8):1210-1224.
[2] Sul D, Kim H, Oh E, et al. Gene expression profiling in lung tissues from rats exposed to formaldehyde [J]. Archive Für Toxikologie, 2007,81(8):589-597.
[3] 李慧,张玉超,柯玉洁,等.甲醛对原癌基因c-myc, MDM2及抑癌基因p53的影响 [J]. 中国环境科学, 2013,33(8):1483-1486.
[4] 柯玉洁,秦晓丹,李兰,等.甲醛对小鼠骨髓组织的毒性作用[J]. 中国环境科学, 2012,32(6):1129-1133.
[5] WHO. 2002. Concise International Chemical Assessment Document 40: Formaldehyde [R]. Geneva: World Health Organization. 12-16.
[6] Halliwell B, Whiteman M. Measuring reactive species and oxidative damage in vivo and in cell culture: how should you do it and what do the results mean? [J]. British Journal of Pharmacology, 2004,142(2):231-255.
[7] 段丽菊,朱燕,胡青莲,等.甲醛吸入致小鼠蛋白质氧化损伤作用的研究 [J]. 环境科学学报, 2005,25(6):851-854.
[8] Riedel F, Hasenauer E, Barth P J, et al. Formaldehyde exposure enhances inhalative allergic sensitization in the guinea pig [J]. Allergy, 1996,51(2):94-99.
[9] Tarkowski M, Gorski P. Increased IgE Antiovalbumin Level in Mice Exposed to Formaldehyde [J]. International Archives of Allergy & Immunology, 1995,106(4):422-424.
[10] Kumar R K, Herbert C, Foster P S. The "classical" ovalbumin challenge model of asthma in mice [J]. Current Drug Targets,2008,9(6):485-494(10).
[11] Qiao Y, Li B, Yang G. Irritant and adjuvant effects of gaseous formaldehyde on the ovalbumin-induced hyperresponsiveness and inflammation in a rat model. [J]. Inhalation Toxicology, 2009,21(14):1200-1207.
[12] Liu D, Zheng Y, Li B, et al. Adjuvant effects of gaseous formaldehyde on the hyper-responsiveness and inflammation in a mouse asthma model immunized by ovalbumin. [J]. Journal of Immunotoxicology, 2011, volume 8(4):305-314(10).
[13] 杨剑婷,吴彩娥,李莹莹,等.白果蛋白过敏动物模型的试验研究[J]. 中国农业科学, 2010,43(17):3616-3623.
[14] 武阳,常青,杨旭.不同浓度甲醛致大鼠肝细胞DNA氧化损伤作用 [J]. 环境科学学报, 2009,29(11):2415-2419.
[15] 代国杰,朱建津,高琳琳,等.褪黑素对小鼠抗氧化作用的影响[J]. 食品工业科技, 2010,(3):347-350.
[16] 刘云儒,许琼军,马亚萍,等.甲醛灌胃染毒对小鼠肝脏超氧化物歧化酶和丙二醛的影 [J]. 中华劳动卫生职业病杂志, 2014, 32(5):376-377.
[17] Jung W W. Formaldehyde exposure induces airway inflammation by increasing eosinophil infiltrations through the regulation of reactive oxygen species production. [J]. Environmental Toxicology & Pharmacology, 2007,24(2):174-182.
[18] Galano A, Tan D X, Reiter R J. Melatonin as a natural ally against oxidative stress: a physicochemical examination. [J]. Journal of Pineal Research, 2011,51(1):1-16.
李克强:加大环境治理力度 重拳治理大气雾霾
2016年3月5日上午9时,十二届全国人大四次会议在人民大会堂开幕,国务院总理李克强作政府工作报告.
李克强在报告2016年重点工作时指出,加大环境治理力度,推动绿色发展取得新突破.治理污染、保护环境,事关人民群众健康和可持续发展,必须强力推进,下决心走出一条经济发展与环境改善双赢之路.
重拳治理大气雾霾和水污染.今年化学需氧量、氨氮排放量要分别下降2%,二氧化硫、氮氧化物排放量分别下降3%,重点地区细颗粒物(PM2.5)浓度继续下降.着力抓好减少燃煤排放和机动车排放.加强煤炭清洁高效利用,推进以电代煤、以气代煤.全面实施燃煤电厂超低排放和节能改造.加快淘汰不符合强制性标准的燃煤锅炉.增加天然气供应,完善风能、太阳能、生物质能等发展扶持政策,提高清洁能源比重.鼓励秸秆资源化利用,减少直接焚烧.全面推广车用燃油国五标准,淘汰黄标车和老旧车380万辆.在重点区域实行大气污染联防联控.全面推进城镇污水处理设施建设与改造,加强农业面源污染和流域水环境综合治理.加大工业污染源治理力度,对排污企业全面实行在线监测.强化环境保护督察.新修订的环境保护法必须严格执行,对超排偷排者必须严厉打击,对姑息纵容者必须严肃追究.
大力发展节能环保产业.扩大绿色环保标准覆盖面.支持推广节能环保先进技术装备,广泛开展合同能源管理和环境污染第三方治理.加大建筑节能改造力度,加快传统制造业绿色改造.开展全民节能、节水行动,推进垃圾分类处理,健全再生资源回收利用网络,把节能环保产业培育成我国发展的一大支柱产业.
加强生态安全屏障建设.健全生态保护补偿机制.停止天然林商业性采伐,实行新一轮草原生态保护补助奖励政策.推进地下水超采区综合治理试点,实施湿地保护与恢复工程,继续治理荒漠化、石漠化和水土流失.保护环境,人人有责.每一个社会成员都要自觉行动起来,为建设美丽中国贡献力量.
摘自中国环境网
2016-03-05
Organ injure and inflammatory response of mice induced by oral exposure of formaldehyde.
ZHAO Yun, YOU Hui-hui, SHEN Shi-Ping, GUO Qing, MEI Yu-fei, LI Jin-quan, ZHU Yu-qing, LI Xiao-xiao, DING Shu-mao, YANG Xu*. (Hubei Key Laboratory of Genetic Regulation and Integrative Biology, College of Life Science, Central China Normal University, Wuhan 430079, China). China Environmental Science, 2016,36(3):935~942
Abstract:To explore the effects on mice through administration of formaldehyde (FA) by gavage with or without ovalbumin (OVA), which lead to the inflammation in body, the male Balb/c mice were randomly divided into 7groups: the control group (distilled water group), OVA group, 2mg/(kg⋅d) FA (formaldehyde) group, 20mg/(kg⋅d) FA group, 200mg/(kg⋅d) FA group, 200mg/(kg⋅d) FA+OVA group and 200mg/(kg⋅d)FA+OVA+ MT (melatonin) group. Mice were gavaged with distilled water and different concentrations of FA solution respectively for 21 days. The mice in OVA group, 200mg/(kg⋅d) FA+OVA group and 200mg/(kg⋅d) FA+OVA+MT group were sensitized with OVA in day 6, 13, 20 by intraperitoneal injection, and the mice in 200mg/(kg⋅d) FA+OVA+MT group were also challenged with 1mg/mL MT by gavage for 21 days. The contents of ROS, MDA and GSH in liver, kidney and lung tissue homogenate were determined. IL-4and IFN-g concentrations in liver were measured by ELISA kits. The results showed that compared with control group, the livers ROS of mice in 200mg/(kg⋅d) FA group reached a significant level (P<0.05), and MDA increased significantly (P<0.05); GSH content in kidneys decreased significantly (P<0.05). IL-4 content in livers of mice in 200mg/(kg⋅d) FA+OVA group significantly increased (P<0.01). In 200mg/(kg⋅d) FA+OVA group, the administration of 10mg/(kg⋅d) MT can reduce ROS in the livers significantly (P<0.05). In a word, the gavage of 200mg/(kg⋅d) FA would induce oxidative damage and inflammation in mice. ROS, MDA in 200mg/(kg⋅d) FA group reached a significant level (P<0.05), on the contrary, GSH content decreased significantly (P<0.05). In 200mg/(kg⋅d) FA+OVA group, IL-4 content in livers of mice significantly increased (P<0.01), while IFN-g content had no significant change (P>0.05).
Key words:formaldehyde;ovalbumin;mice;oxidative stress;inflammation
作者简介:赵云(1992-),女,山西长治人,华中师范大学硕士研究生,研究方向为生物化学与分子毒理学.
基金项目:国家自然科学基金重点项目(51136002)
收稿日期:2015-06-19
中图分类号:X503.22
文献标识码:A
文章编号:1000-6923(2016)03-0935-08
