复合刺激创伤后应激障碍模型大鼠重要脑区的病理变化
2016-04-14陈旺李陈成李森冯东亮洪有建南伟江龙黄显凯伍亚民
陈旺,李陈成,李森,冯东亮,洪有建,南伟,江龙,黄显凯,伍亚民
(1. 第三军医大学大坪医院 野战外科研究所创伤外科, 重庆 400042;2. 第三军医大学大坪医院 野战外科研究所第三研究室,创伤、烧伤与复合伤国家重点实验室, 重庆 400042;3. 兰州大学第二临床医学院骨科, 兰州 730030)
研究报告
复合刺激创伤后应激障碍模型大鼠重要脑区的病理变化
陈旺1,2,李陈成1,2,李森2,冯东亮3,洪有建1,2,南伟3,江龙1,2,黄显凯1*,伍亚民2
(1. 第三军医大学大坪医院 野战外科研究所创伤外科, 重庆400042;2. 第三军医大学大坪医院 野战外科研究所第三研究室,创伤、烧伤与复合伤国家重点实验室, 重庆400042;3. 兰州大学第二临床医学院骨科, 兰州730030)
【摘要】目的研究复合刺激创伤后应激障碍(PTSD)模型大鼠重要脑区的病理变化。方法成年SD雌性大鼠20只,随机分为正常组、模型组,每组10只。模型组按复合刺激方法建立PTSD大鼠模型,4 周后对两组大鼠行高架十字迷宫和Morris水迷宫检测;行为检测结束后对大鼠大脑皮层和海马CA1、CA2、CA3区和齿状回进行HE染色和Nissl染色,观察其病理变化特点。结果正常组大脑皮层和海马各区细胞形态规则、分布均匀,核仁及边界清晰,胞质尼氏体丰富,无明显神经元变性坏死;模型组大脑皮层细胞形态较规则、分布均匀,无明显病理改变;海马CA1、CA3区细胞形态不规则,排列紊乱,细胞间隙增大,细胞数量减少,有较多空泡样细胞病变,CA3区更为明显;CA2区细胞排列较规则,分布较均匀;齿状回可见部分细胞排列疏松、细胞间隙增大、尼氏体数量减少。结论PTSD模型大鼠海马CA1、CA3区和齿状回均有不同程度的病理改变,为探讨PTSD患者的病理机制提供了实验依据。
【关键词】创伤后应激障碍;大脑皮层;海马;病理学;大鼠
复合刺激(combined stress,CS)模型是一种新的创伤后应激障碍(post-traumatic stress disorder,PTSD)动物模型,与经典的连续单一应激模型(single-prolonged stress,SPS)比较:前者在禁锢时给予不可逃避的电刺激,能更好的模拟现实环境中多种应激因素的作用,且在强迫游泳后省去了乙醚麻醉的步骤,避免了乙醚对大脑的直接影响。因此,CS模型在造模方法上能更好模拟人类发生PTSD的状况。目前有报道PTSD患者可能存在重要脑区的实质性损害,但尚存争议,并没有PTSD患者大脑的直接病理学证据。但这种模型大鼠重要脑区是否存在病理改变也不确定,相关研究的报道很少。为此,本实验重点观察CS模型大鼠重要脑区的病理变化特点,为研究PTSD的病理机制提供实验证据。
1材料与方法
1.1材料及试剂
1.1.1实验动物
SPF级SD雌性大鼠20只,体重190~200 g,购于第三军医大学大坪医院实验动物中心【SCXK(渝)2012-0005】。实验在第三军医大学大坪医院野战外科研究所【SYXK(军)2012-0037】进行,环境为室温(20±2)℃,湿度(55~60)%,动物分笼饲养,自由进食水。将20只大鼠随机分为正常组和模型组,每组10只,适应性喂养一周后开始实验。本研究得到第三军医大学动物管理委员会批准(SYXK-PLA-20120031),实验设计和操作均按减少动物使用数量和减轻动物受伤害的原则进行。
1.1.2主要仪器及试剂
高架十字迷宫(垂直方向为开臂× 50 cm,水平方向为闭臂× 50 cm,中央为10 cm × 10 cm正方形区域),水迷宫(直径135 cm,高80 cm的圆柱形水池),Smart行为轨迹分析系统(San Diego Instrument,美国),DCR-TRV318红外摄像机(Sony公司,日本),大鼠玻璃禁锢器,HE染色试剂盒(南京建成生物工程研究所有限公司),尼氏染液(南京建成生物工程研究所有限公司)。
1.2PTSD动物模型的建立
采用赵中兴[1]所用的复合刺激(CS)模型,方法如下:用玻璃禁锢器将大鼠禁锢2 h,期间给予大鼠足部电击(4 mA,60 V)持续2 s,电击间隔时间为30~120 s,禁锢结束后将大鼠取出进行力竭式游泳(大鼠放弃挣扎沉入水底10 s视为力竭),造模结束后将大鼠放回原笼内喂养,喂养条件不变。
1.3行为学检测
1.3.1高架十字迷宫
将大鼠放入迷宫中央使其头正对其中一个开臂,同时Smart软件记录大鼠在5 min内进入开臂和闭臂次数总和以及在闭臂停留时间百分比,以此来反映大鼠的焦虑性。每只大鼠实验完毕后均需清理迷宫内的粪便和尿液,并用75%酒精擦拭迷宫,防止对下一只大鼠行为检测产生影响。
1.3.2水迷宫
将水迷宫的四个象限定义为东(E)、南(S)、西(W)、北(N)四个象限,于各自象限的池臂上放置四种不同颜色的标记物,作为大鼠的视觉参照。将平台(40 cm高)放入水迷宫的西南象限,水池内注入自来水至水深超过平台2 cm,为防止大鼠看见水下平台将墨汁倒入水池内,调节水温在22~25℃之间。
1.3.3定位航行实验
历时4 d,每只大鼠每天训练4次,第1天按E→S→W→N的顺序将大鼠沿池壁头朝上轻轻放入水中,同时Smart软件记录大鼠的行为轨迹,若大鼠找到水下平台则记录自动终止,若大鼠在1 min内仍未找到水下平台,则人为诱导其找到平台并在平台上休息20 s。每只大鼠训练完后均需清理水池内的粪便。第2天按S→W→N→E的顺序开始训练,以此类推。
1.3.4空间探索实验
训练结束后的第2天,取走水下平台,将大鼠沿原平台所在象限的对侧象限放入水池内,同时Smart软件记录大鼠在1 min内的行为轨迹,每只大鼠实验完后均需清理水池内的粪便。通过分析大鼠在1 min内穿越平台次数和在靶象限停留时间来反映大鼠的空间记忆能力。
1.4HE染色和Nissl染色
大鼠行为检测结束后,用1%戊巴比妥钠腹腔麻醉两组大鼠。麻醉起效后,仰卧固定,立即剖开胸腔暴露心脏,剪开右心耳,在左心室剪开一个小口,仅容灌注针头进入,针头经切口进入左心室到达升主动脉,灌注生理盐水直至右心耳流出无色液体,然后以4%多聚甲醛灌注定直至灌注液进入大鼠大脑,抽动完全停止,全身组织变硬后方可取脑。将取出的脑组织在4%多聚甲醛中固定2 d,随后冲洗、脱水、透明、侵蜡、包埋、切片(HE染色5 μm,尼氏染色10 μm)、染色。 分别对两组大鼠的大脑皮层和海马CA1、CA2、CA3区和齿状回进行HE染色和Nissl染色,显微镜在200倍下观察其病理变化特点。
1.5统计学方法
2结果
2.1高架十字迷宫
与正常组比较,模型组大鼠进入开臂和闭臂次数,闭臂停留时间百分比均增多,差异有显著统计学意义(P<0.01),提示模型组大鼠活动性减少,焦虑性增加(见表1、图1)。
2.2水迷宫
与正常组比较,模型组大鼠穿越平台次数和靶象限停留时间百分比均减少,差异有显著性(P<0.01),提示模型组大鼠空间记忆能力受损(见表2、图2)。
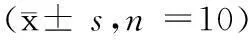
表1 高架十字迷宫的比较
注:与正常组相比,*P<0.01。
Note.*P<0.01, vs.the control group.
表2 Morris水迷宫空间探索实验的比较(x± s,n=10)
Tab. 2 Comparison of space exploration test in the Morris water maze
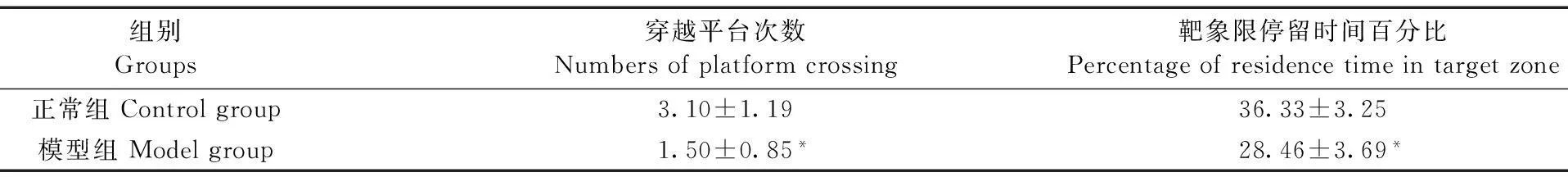
表2 Morris水迷宫空间探索实验的比较(x± s,n=10)
组别Groups穿越平台次数Numbersofplatformcrossing靶象限停留时间百分比Percentageofresidencetimeintargetzone正常组Controlgroup3.10±1.1936.33±3.25模型组Modelgroup1.50±0.85*28.46±3.69*
注:与正常组相比,*:P<0.01。
Note.*P<0.01, vs. the control group.
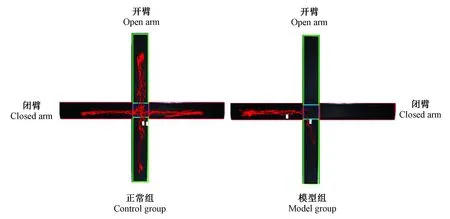
图1 大鼠高架十字迷宫5 min 的行为轨迹Fig.1 The behavior trace of rats tested by elevated plus maze for 5 minutes
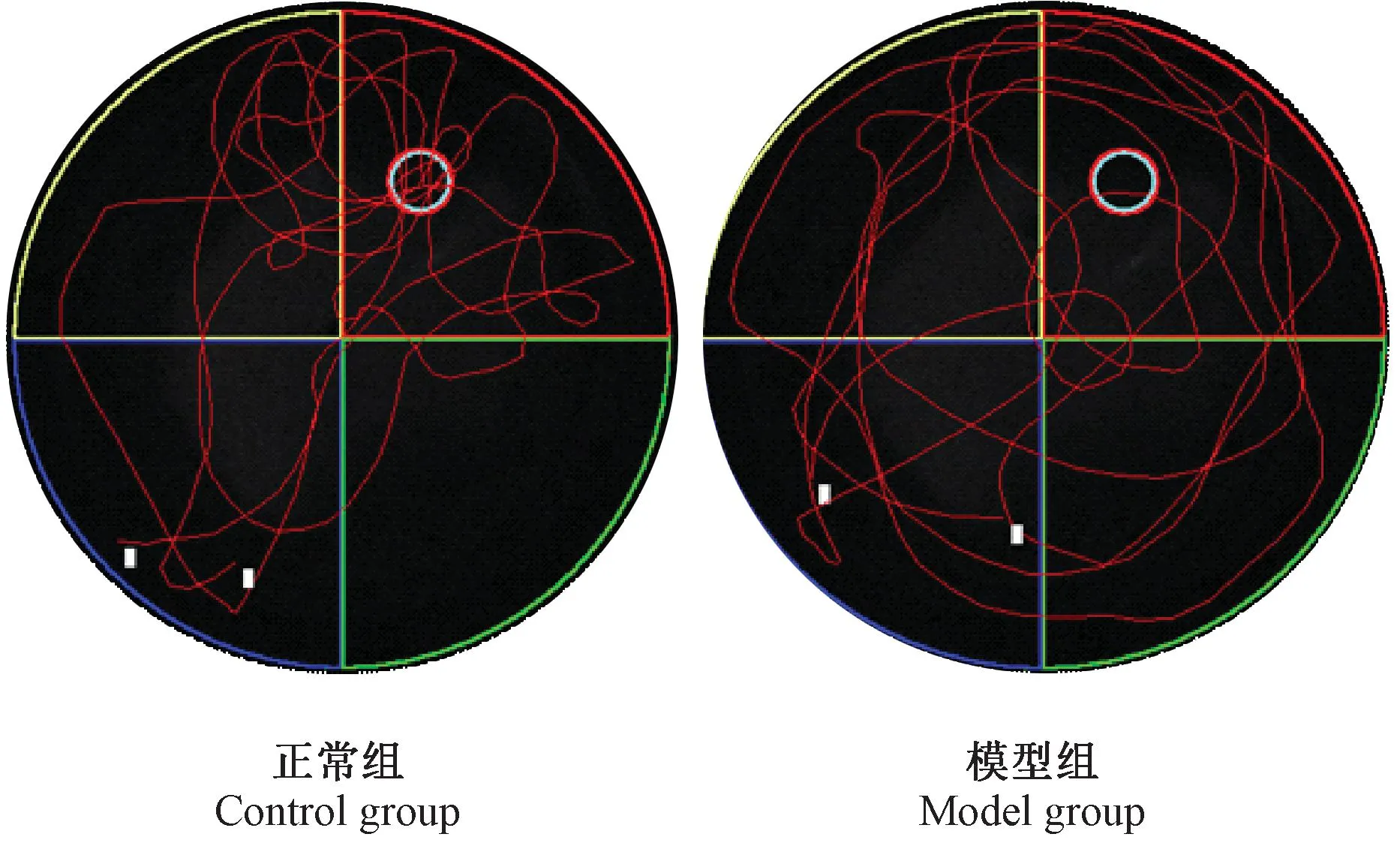
图2 大鼠空间探索实验 1 min 的行为轨迹Fig.2 The behavior trace of rats on space exploration test for one minute.
2.3重要脑区病理染色
两组大鼠大脑皮层,海马CA1、CA2、CA3区和齿状回HE染色和Nissl染色结果如下:正常组大脑皮层和海马各区细胞形态规则、分布均匀、排列紧密,核仁及边界清晰,胞质尼氏体丰富,无明显神经元变性坏死;模型组大脑皮层细胞形态较规则、分布均匀,无明显病理改变;但模型组大鼠海马细胞结构层变薄,CA1、CA3区椎体细胞形态不规则,排列紊乱,细胞间隙增大,细胞数量减少,有较多空泡样细胞病变,CA3区更为明显;CA2区细胞排列较规则,分布较均匀;齿状回可见部分细胞排列疏松、细胞间隙增大、尼氏体数量减少(见图3)。
3讨论
PTSD是延迟出现和长期存在的精神障碍,其核心症状表现为再体验、高警觉和回避[2]。当今社会,自然灾害、战争、恐怖袭击、重大交通事故等频繁发生,使PTSD的患病率持续升高。研究发现,8%~9%的人在一生中的某些时候会遭遇比较强烈的应激事件,最终有可能发展成PTSD[3,4]。PTSD由于其病程长、治疗困难、预后不佳,已成为社会的沉重负担,受到越来越多的重视。
目前国内外对PTSD发生机制的研究已引起广泛关注,fMRI等影像学检测提示PTSD患者可能有重要脑区的损害,但尚存争议。因此,通过动物实验来模拟、探索PTSD发生的特点、机制十分必要。在本模型中,CS大鼠能很好复制出PTSD样行为表现,通过对其重要脑区的病理进行直接观察,发现CS模型大鼠HE染色后海马CA1和CA3区呈现出一定的病理改变,可见细胞排列紊乱,部分细胞核碎裂、溶解,空泡细胞形成。尼氏小体与神经元的功能密切相关,当神经元变性时,尼氏小体会变小甚至消失,尼氏小体的数量直接反映了神经元内的蛋白合成功能[11]。CS模型大鼠Nissl染色后可见CA1和CA3区的尼氏小体排列紊乱、数量明显减少、颜色变浅,CA3区更为明显。另外,齿状回的某些区域也出现了尼氏小体排列疏松、数量减少的现象。
海马是大脑边缘系统的一部分,其最显著的特点是神经元紧密排列,使其结构层次分明、边界清晰,因此在PTSD脑结构的研究中得到了最多的关注。海马的主要结构有三层,即多形层、椎体层和分子层,齿状回则主要分为多形层、颗粒层和分子层。海马各个区域的细胞类型也是不同的:CA1区的椎体细胞比较小,CA3区的椎体细胞较大,A2区界于CA1区和CA3区之间,由大小不等的椎体细胞组成。
海马有很多重要的生理功能,它影响着躯体活动和行为、内分泌功能的调节、自主神经功能以及学习记忆。海马在动物的学习和记忆中发挥着重要作用,尤其是CA3区,对空间记忆的辨别至关重要[5]。研究发现,当海马受到损伤后将影响短时记忆向长时记忆的转化[6]。海马对应激非常敏感,极易受到应激的损伤。研究发现,适当的应激有利于学习记忆的改善,对大脑退化有积极的防治作用[7];而强烈的应激事件则会损害其学习记忆功能[8]。海马长时程增强(LTP)是学习记忆的神经学基础,Sousa等[9]认为应激能抑制CA1区和齿状回诱发LTP,而Kadar等[10]则认为应激能抑制CA3区和齿状回诱发LTP。
综上所述,CS模型大鼠海马的不同区域均发生了不同程度的病理改变,海马CA1、CA3、齿状回等区受损明显,导致较多神经元的变性坏死,这在一定程度上可以解释其在进行高架十字迷宫和水迷宫时的行为表现。本实验结果提示:PTSD模型大鼠同样存在重要脑区的病理性损害,为探讨PTSD患者的发病机制提供了重要的实验依据。但此模型对大脑产生的应激损伤可能不仅仅在于海马,PTSD影响的另外一个重要脑区是杏仁核,但由于其体积太小、位置隐匿,在研究中有一定的困难,本次实验尚未对其观察,CS模型大鼠杏仁核是否存在病理损害有待以后深入研究。

图3 大鼠重要脑区的组织学改变(HE与Nissl染色,×200)Fig.3 Histological changes in the brain areas of rats. HE and Nissl staining. ×200
[1]赵中兴, 伍亚民. 一种新的大鼠创伤后应激障碍模型的建立及其行为学检测 [J]. 第三军医大学学报, 2012, 34(10): 928-932.
[2]Liberzon I, Sripada CS. The functional neuroanatomy of PTSD: a critical review [J]. Progr Brain Res, 2008, 167: 151-169.
[3]Hidalgo R, Davidson J. Posttraumatic stress disorder: epidemiology and health-related considerations [J]. J Clin Psychiatry, 2000, 61(suppl 7): 5-13.
[4]Yule W. Posttraumatic stress disorder in the general population and in children [J]. J Clin Psychiatry, 2001, 62(suppl 17) :23-28.
[5]库宝善. 加压素与学习记忆 [J]. 生理科学进展, 1981, 12(1): 79.
[6]Rauch SL, Shin LM, Segal E, et al. Selectively reduced regional cortical volumes in post-traumatic stress disorder [J]. Neuroreport, 2003, 14(7): 913-916.
[7]Fordyce DE, Wehner JM. Physical activity enhances spatial learning performance with an associated alteration in hippocampal protein kinase C activity in C57BL/6 and DBA/2 mice [J]. Brain Res, 1993, 619: 111-119.
[8]Quervain DJD, Roozendaal B, Mcgaugh JL. Stress and glucocorticoids impair retrieval of long-term spatial memory [J]. Nature Int Weekly J Sci, 1998, 394(6695): 787-790.
[9]Sousa N, Lukoyanov NV, Madeira MD, et al. Reorganization of the morphology of hippocampal neurites and synapses after stress-induced damage correlates with behavioral improvement [J]. Neuroscience, 2000, 97(2): 253-266.
[10]Kadar T, Dachir S, Shukitt-Hale B, et al. Sub-regional hippocampal vulnerability in various animal models leading to cognitive dysfunction [J]. J Neural Transm, 1998, 105(8-9): 987-1004.
[11]郭以河, 赵梅兰, 彭瑞云, 等. 尼氏小体染色方法的改进及其在神经病理学研究中的应用[J]. 实用医技杂志, 2003, 10(6): 605-606.
Pathological changes in some important brain areas of rats with post-traumatic stress disorder induced by combined stress
CHEN Wang1,LI Chen-cheng1,LI Sen2,FENG Dong-liang2,HONG You-jian1, NAN Wei2,JIANG Long1,HUANG Xian-kai1*,WU Ya-min1
(1. Department of Traumatology, Research Institute of Surgery/Daping Hospital,2. Third Department of Research Institute of Surgery/Daping Hospital, State Key Laboratory of Trauma,Burns and Combined Injury, Third Military Medical University, Chongqing 400042, China;3. Department of Orthopedics, the Second Clinical Medical College of Lanzhou University, Lanzhou 730030)
【Abstract】ObjectiveTo study the pathological changes in some important brain areas of rats with post-traumatic stress disorder (PTSD) induced by combined stress.MethodsTwenty healthy adult female SD rats were randomly divided into normal group and model group, with 10 rats in each group. The PTSD model was established by combined stress. After 4 weeks, the rat behaviors of the two groups were tested by elevated plus maze and Morris water maze. After the test, samples of the cerebral cortex, areas of CA1, CA2, CA3 and hippocampal dentate gyrus were taken for pathological examination using HE and Nissl staining. ResultsIn the normal group, the cell morphology and distribution were regular and the cell nucleoli were clear in the cerebral cortex and hippocampus, cytoplasmic Nissl bodies were abundant, and there were no obvious neuronal degeneration and necrosis. In the model group, the cell morphology and distribution in the CA1 and CA3 areas were irregular, with increased cell gaps, and in addition, there were some pathological changes of physaliferous cells, especially in the CA3 area. The cell morphology and distribution in the CA2 area were regular. In the dentate gyrus, some cells arranged loosely, the cell gap was widened, and the amount of Nissl bodies was decreased. Conclusions There are some pathological changes in the hypocampal CA1, CA3 and dentate gyrus in rat models of post-traumatic stress disorder, and they will provide an experimental basis for studying the pathological mechanism of PTSD patients.
【Key words】Post-traumatic stress disorder; Cerebral cortex; Hippocampus; Pathology; Rats
[收稿日期]2015-08-06
Corresponding author:HUANG Xian-kai, E-mail:hxkai123@sina.com
Doi:10.3969/j.issn.1005-4847.2016.01.016
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016) 01-0087-05
[作者简介]陈旺(1989-),男,硕士研究生,研究方向:PTSD的防治。E-mail: 453777442@qq.com[通讯作者]黄显凯,主任医师、教授、博士、硕士生导师,研究方向:严重创伤救治。E-mail: hxkai123@sina.com
[基金项目]全军医药卫生科研基金(08G096)。
