利用心脏特异性CYP2E1基因修饰小鼠评价药物心脏毒性的初步探索
2016-04-14裴彦宇孙井江赵显莉贺银丽魏若尧高虹
裴彦宇, 孙井江, 赵显莉, 贺银丽, 魏若尧, 高虹
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
研究报告
利用心脏特异性CYP2E1基因修饰小鼠评价药物心脏毒性的初步探索
裴彦宇, 孙井江, 赵显莉, 贺银丽, 魏若尧, 高虹*
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京100021)
【摘要】目的使用两种心脏特异性CYP2E1基因修饰小鼠来评价药物西布曲明(sibutramine)的心脏毒性作用,选择出在评价药物的心脏毒性中具有更高敏感性的动物模型。方法8周龄雄性Tg(+)型小鼠、sTg(+)型小鼠、野生型C57BL/6小鼠(WT),各50只,分别随机分成5组,每组10只,溶媒对照组(灌胃给予纯净饮用水)及4个实验组(50、100、150、300 mg/kg西布曲明)。给药过程中进行一般症状观察以及存活率的测定;给药15 d 后取血并解剖取心脏,测定各组实验小鼠血生化心脏损伤指标:乳酸脱氢酶(LDH),肌酸激酶(CK),肌酸激酶同工酶(CK-MB)。并进行病理组织学检查,免疫组织化学方法观察心脏组织缝隙蛋白43(connexin 43,CX43)的表达情况。结果(1)血生化指标显示,在给药剂量50 mg/kg和100 mg/kg时,Tg(+)型小鼠均显著高于WT型小鼠(P<0.05 或P<0.01);在给药剂量50、100和150 mg/kg时,Tg(+)型小鼠均显著高于sTg(+)型小鼠(P<0.05 或P<0.01);而在给药剂量300 mg/kg时,Tg(+)型小鼠均显著低于WT和sTg(+)型小鼠(P<0.05 或P<0.01),且sTg(+)型小鼠减小的程度最小。(2)病理组织学结果显示,Tg(+)和WT型小鼠各个给药组均表现出心脏损伤的迹象。(3)免疫组织化学染色显示,随着给药剂量的加大,Tg(+)、sTg(+)和WT型三种小鼠CX43在心肌细胞闰盘处的表达数量均逐渐下降,且染色颜色逐渐变浅;而CX43在心肌细胞闰盘处的表达数量下降程度和染色颜色变浅程度由高到低分别为,Tg(+)型小鼠,其次是WT型小鼠,sTg(+)型小鼠。结论Tg(+)型小鼠在评价药物潜在心脏毒性试验中可能比WT型小鼠具有更高的敏感性,而sTg(+)型小鼠则是很好的心脏毒性保护模型。
【关键词】细胞色素P450 2E1;基因修饰;西布曲明;药物毒性
细胞色素P450 2E1(cytochrome P2E1,CYP2E1)是细胞色素P450混合功能氧化酶系的重要成员之一,参与机体内许多内外源性物质的代谢与活化[1]。CYP2E1主要分布于肝脏,同时在肝外组织如心脏、肾脏等处也有高表达[2]。一直以来,心脏毒性都是药物临床前和药物临床检验和防治的重点,选择一种理想的药物评价模型是决定药物安全性评价效果的关键因素之一[3]。本实验选用的两种心脏特异性CYP2E1基因修饰小鼠[(心脏特异性CYP2E1转基因小鼠,α-MHCCYP2E1 transgenic mice,Tg(+)和心脏特异性CYP2E1基因沉默小鼠,α-MHCCYP2E1 silence mice,sTg(+)],来进行药物西布曲明心脏毒性评价的初步探索,以期选择一种敏感性更高的基因修饰动物模型,为评价具有潜在心脏毒性药物的临床前安全性寻找一种更加快速、灵敏、准确的动物模型。
1材料与方法
1.1实验动物
SPF级雄性Tg(+)和sTg(+)各50只,8周龄,20~25 g左右,均由中国医学科学院医学实验动物研究所遗传中心构建;雄性WT 50只,8周龄,SPF级,20~25 g左右,购自北京维通利华实验动物技术有限公司【SCXK (京) 2012-0001】。动物饲养于中国医学科学院医学实验动物研究所SPF级环境中【SYXK(京)2014-002】,温度范围22~26℃,相对湿度40%~70%,换气次数15次/h,照明>200 lx,12/12h明暗交替,自由进食、饮水。
1.2仪器和试剂
全自动生化分析仪(日本日立公司,7100型);光学显微镜(Olympus,BX50);西布曲明(分析纯,阿拉丁试剂公司);兔抗小鼠CX43抗体(Affinity,AF0137);PV-9001 辣根酶标记抗兔IgG聚合物(中杉金桥,K152708B);进口羊血清工作液(中杉金桥,15A92605)。
1.3动物分组及给药方案
8周龄Tg(+)、sTg(+)和WT型小鼠分别随机分为溶媒对照组、给药组1、给药组2、给药组3、给药组4,每组10只,ig给药。各组小鼠给药组给予西布曲明的剂量分别为给药组1(50 mg/kg)、给药组2(100 mg/kg)、给药组3(150 mg/kg)、给药组4(300 mg/kg);溶媒对照组给予等剂量的纯净水,连续15 d,每日一次,给药时间为每日9:00~11:00。西布曲明用纯净水溶解,每只动物灌胃体积为0.2 mL/10( g·bw)。
1.4大体观察和生存率测定
每日定时观察小鼠的外观和行为(包括小鼠的精神状态、皮肤毛发、眼睛和黏膜的变化、活动情况、呼吸状况、死亡情况及其他异常表现)、分泌物和排泄物等。末次给药结束后,记录各组小鼠的死亡数,并计算死亡率。
1.5血液生化学指标检测
实验小鼠末次给药后,禁食不禁水12~18 h,0.3 %戊巴比妥钠麻醉后取全血300~500 μL,静置30~60 min后,离心10 min,取上层血清于日立7100生化自动分析仪上检测心脏的血液生化学指标。
1.6心脏组织病理学检查
小鼠心脏组织分别经4 % 中性甲醛固定、修块、梯度酒精脱水、石蜡包埋切片(5 μm),HE染色,封片后光学显微镜观察并拍照。
1.7免疫组织化学检测
脱蜡、水化组织切片后依次进行抗原修复、3% H2O2去除内源性过氧化物酶活性、正常羊血清封闭、CX43一抗 (1∶100)、二抗、DAB显色、苏木素复染、自来水充分冲洗、脱水、透明、封片。2 h 后置于光学显微镜下观察。
1.8统计学分析
2结果
2.1大体观察和生存率测定
整个实验过程中各给药组有不同程度的死亡现象发生,同时Tg(+)型小鼠在给药组4(300 mg/kg)时有个别小鼠出现精神萎靡等异常现象。
在相同饲养条件下,Tg(+)、sTg(+)和WT型小鼠的溶媒对照组、给药组1(50 mg/kg)、给药组2(100 mg/kg)、给药组3(150 mg/kg)均无死亡现象;而给药组4(300 mg/kg)至给药结束时,死亡率分别达到70%、60%、30%(见图1)。
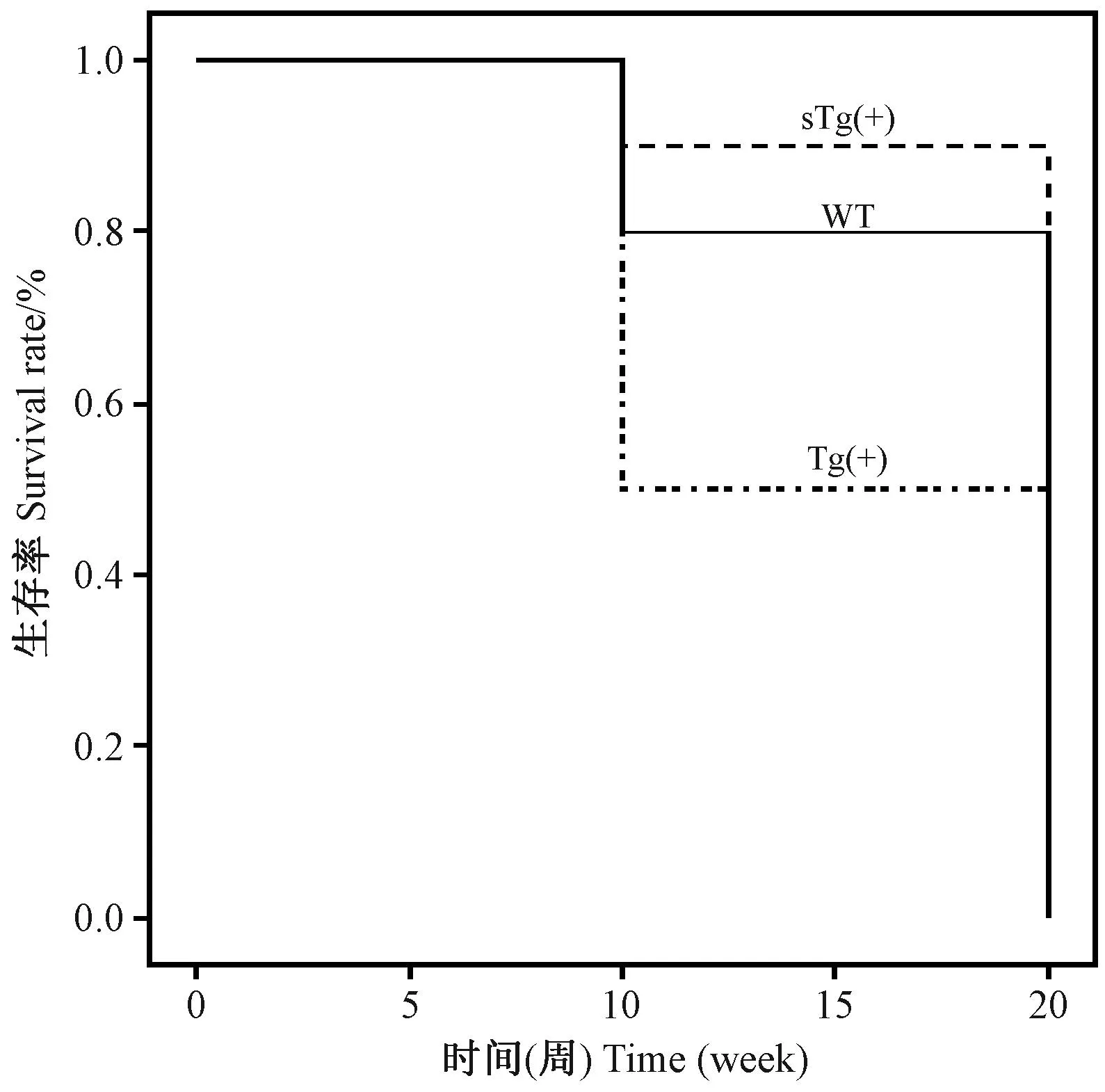
图1 300 mg/kg剂量时WT、Tg(+)、sTg(+)型小鼠的生存情况Fig. 1 The survival curves of WT, Tg(+) and sTg(+) mice treated with 300 mg/kg sibutramine
2.2血液生化学指标检测
Tg(+)、sTg(+)和WT型小鼠在给药剂量50 mg/kg和100 mg/kg时,Tg(+)型小鼠的CK、LDH、CK-MB均显著高于WT型小鼠(P<0.05 或P<0.01,n=10);在给药剂量50、100 和150 mg/kg时,Tg(+)型小鼠的各指标均显著高于sTg(+)型小鼠(P<0.05 或P<0.01,n=10)(表1)。在给药剂量为300 mg/kg时,Tg(+)型小鼠的CK、LDH、CK-MB均十分显著低于其自身溶媒对照组(P<0.01,n=3);并均低于WT和sTg(+)型小鼠(P<0.05或P<0.01,n=3)(表1)。同时结合三种小鼠的生存率,分析Tg(+)和WT型小鼠在给药剂量为300 mg/kg时可能发生了恶病质,且Tg(+)型小鼠更为严重,而sTg(+)型小鼠尚未完全发生这种现象,提示Tg(+)型小鼠比WT型小鼠对药物的心脏毒性作用更为敏感,且sTg(+)型小鼠可能是一个心脏保护模型。
2.3心脏组织病理学检测
当给药剂量为50、100、150 mg/kg时,HE染色可见部分Tg(+)型小鼠出现少数心肌细胞颗粒变性、空泡变性及嗜酸性变性(见图2 B1、B2、B3);当给药剂量为100、150 mg/kg时,HE染色可见部分WT型小鼠出现少数心肌细胞颗粒变性或空泡变性(见图2 A2、A3);当给药剂量为300 mg/kg时,HE染色可见几乎全部WT和Tg(+)型小鼠出现心肌细胞颗粒变性或空泡变性(见图2 A4、B4)。而溶媒对照组以及sTg(+)型小鼠各个给药组的心内外膜、心肌膜结构清晰,心肌纤维着色均匀,胞界清楚,间质未见异常。
2.4免疫组织化学检测
Tg(+)、sTg(+)和WT型三种小鼠的溶媒对照组的CX43蛋白在心肌细胞闰盘处的表达均清晰有序,表达数量多,且染色颜色深;随着给药剂量的加大,三种小鼠的CX43抗体在心肌细胞闰盘处的表达数量均有不同程度的下降,且染色颜色变浅。同时,在相同的给药剂量下,CX43抗体在心肌细胞闰盘处的表达数量下降程度和染色颜色变浅程度依次是:Tg(+)型>WT型>sTg(+)型小鼠(见图3)。
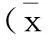
表1 各组小鼠血生化心脏损伤指标±s)
注:相同基因型小鼠与各自溶媒对照组比较,*P<0.05,**P<0.01;相同给药剂量时Tg(+)和 sTg(+)分别与WT小鼠比较,#P<0.05,##P<0.01;相同给药剂量时Tg(+)与sTg(+)比较,▲P<0.05,▲▲P<0.01。
Note.*P<0.05,**P<0.01, compared with the solvent control group in the same genotype of mice.#P<0.05,##P<0.01, the Tg(+) and sTg+ mice compared with the WT mice treated with the same dose of sibutramine.▲P<0.05,▲▲P<0.01, the Tg(+) mice compared with the sTg(+) mice treated with the same dose of sibutramine.
3讨论
在新药研究开发中,临床前药物安全性评价是决定新药能否进入临床试验的关键因素之一。药物的毒性反应是临床前安全性评价的主要研究内容,其中高达26%的毒性反应是心血管毒性[4]。目前,外源性药物导致心脏毒性的作用机制主要有氧化应激反应、脂质过氧化反应和免疫炎症反应等。
CYP2E1是机体参与内外源性物质催化作用的一类重要的氧化代谢酶,同时产生活性氧自由基(reactive oxygen species,ROS),引发氧化应激反应、炎症反应和细胞凋亡等过程,进而对机体产生毒性[5]。国内外许多研究已将其应用于CYP2E11的代谢机制以及与CYP2E11基因有关的疾病如脂肪性肝病的病理机制研究中[6],但目前却鲜见将CYP2E1基因修饰小鼠应用于药物毒性评价中的报道。
西布曲明于1997年上市,主要是通过抑制中枢神经细胞对去甲肾上腺素和5-羟色胺的再摄取来降低食欲,达到减肥的效果[7],因西布曲明具有潜在的心血管系统毒性,而且减肥治疗的风险远大于效益[8],并于2010年在世界各国相继撤市。有研究表明,西布曲明灌胃给药对小鼠的半数致死量LD50为98.8~125.1 mg/kg[9],故本实验采用50、100、150及300 mg/kg 4个给药剂量来进行探索。
心脏生化损伤指标(LDH、CK、CK-MB)作为心脏特异酶类标志物,其在血清中的活性变化可以反映心脏功能的好坏和心肌细胞结构的完好程度。从本实验心脏损伤血生化指标结果来看,在给药剂量为50 mg/kg和100 mg/kg时,Tg(+)型小鼠的心脏损伤指标最高,而在给药剂量为300 mg/kg时,Tg(+)型小鼠的心脏损伤指标最低,且均有统计学意义。同时,Tg(+)、sTg(+)和WT型三种小鼠在给药剂量为300 mg/kg时死亡率分别达到70%、60%、30%,提示在给药剂量为300 mg/kg时,Tg(+)型小鼠的心脏组织已出现严重毒性。说明Tg(+)型小鼠能够更敏感地从血生化指标来反映心脏结构和功能,提示Tg(+)型小鼠比WT型小鼠及sTg(+)型小鼠对药物的心脏毒性作用更为敏感,且sTg(+)型小鼠可能是一个心脏保护模型。
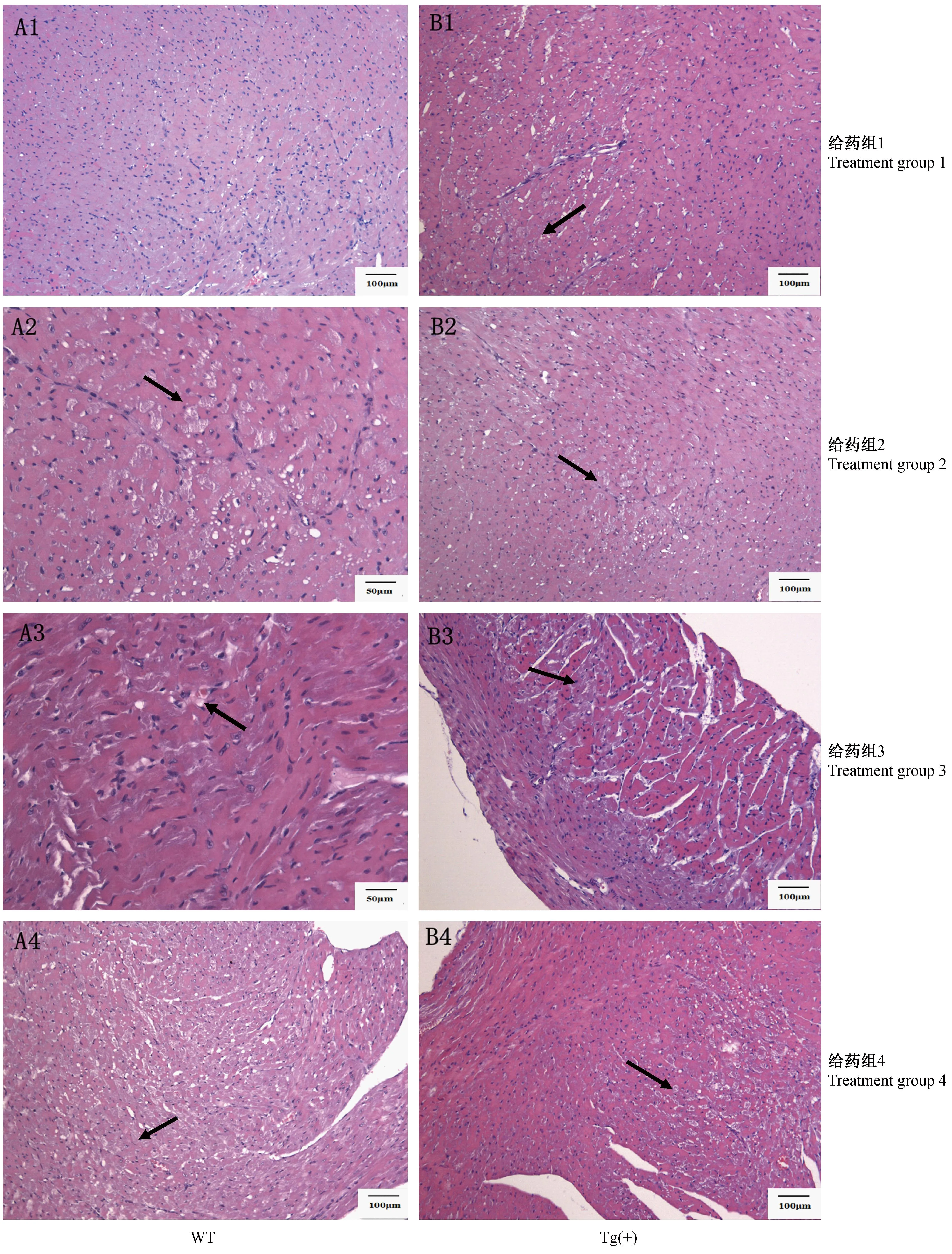
注:A1-A4:WT型给药组1、给药组2、给药组3、给药组4;B1-B4:TG(+)型小鼠给药组1、给药组2、给药组3、给药组4;↑:心肌细胞发生颗粒变性、空泡变性和嗜酸性变形等病理变化(A2、A3:×200,A1、B1、B2、B3、A4、B4:×100)。图2 各组小鼠的心脏组织病理学变化(HE染色)Note. A1-A4: Treatment groups 1, 2, 3 and 4 of WT mice; B1-B4: Treatment groups 1, 2, 3, 4 of TG(+) mice. ↑: Granular degeneration, vacuolization and acidophilic degeneration of cardiomyocytes (A2, A3: ×200,A1, B1, B2, B3, A4, B4: ×100).Fig. 2 Pathological changes of the heart tissue of mice in each group(HE staining)

注:A1-A5:WT型溶媒对照组、给药组1、给药组2、给药组3、给药组4;B1-B5:TG(+)型溶媒对照组、给药组1、给药组2、给药组3、给药组4;C1-C5:sTG(+)型溶媒对照组、给药组1、给药组2、给药组3、给药组4。图3 各组小鼠心脏组织中CX43的表达(×400)Note. A1-A5: Solvent control group and treatment groups 1, 2, 3, and 4 of the WT mice; B1-B4: Solvent control group and treatment groups 1, 2, 3, and 4 of the TG(+) mice;C1-C5: Solvent control group and treatment groups 1, 2, 3, and 4 of the sTG(+) mice.Fig. 3 Expression of connexin 43 in the mouse heart tissue of each group (×400)
心脏组织HE染色可见Tg(+)和WT型小鼠只有部分的少数心肌细胞存在病理改变,且sTg(+)型小鼠的心肌结构未见异常。CX43是一种主要存在于心脏组织心室肌的闰盘上的缝隙连接蛋白,其正常表达与分布决定了心脏缝隙连接通道的正常电活动以及心肌的正常舒缩[10]。本实验选用CX43抗体对各组小鼠的心脏进行免疫组织化学染色,验证CX43是否在心脏中表达异常。CX43表达数量和染色程度的差异证实了CX43在心脏组织中表达数量的异常与西布曲明引起的心脏毒性有密切关系,三种小鼠的死亡与心脏系统传导阻滞引起的心律失常等有关,且Tg(+)型小鼠对药物引起的心脏毒性比WT型小鼠更为敏感,而sTg(+)型小鼠则是一个很好的心脏保护模型。
基因修饰动物模型是国内外实验室研究的热点,本实验中Tg(+)型小鼠不仅可以更真实地评价药物的毒性作用,而且相对于WT型小鼠,在具有潜在心脏毒性作用的药物毒性评价中灵敏性更高,有望在心血管系统的药物安全性评价中广泛应用,提高药物临床前评价结果与临床的相关性,减少临床用药风险。
参考文献
[1]Knockaert L, Descatoire V,Vadrot N, et al. Mitochondrial CYP2E1 is sufficient to mediate oxidative stress and cytotoxicity induced by ethanol and acetaminophen [J]. Toxicol in Vitro, 2011, 25(2): 475-484.
[2]Neafsey P, Ginsberg G, Hattis D, et al. Genetic polymorphism in CYP2E1: population distribution of CYP2E1 activity [J]. Toxicol Environ Health B Crit Rev, 2009, 12(5-6): 362-388.
[3]Pugsley MK, Gallacher DJ, Towart R, et al. Methods in safety pharmacology in focus [J]. J Pharmacol Toxicol Methods, 2008, 58(2): 69-71.
[4]Foster WR, Chen SJ, He A, et al. A retrospective analysis of toxicogenomics in the safety assessment of drug candidates [J]. Toxicol Pathol, 2007, 35(5): 621-635.
[5]O’Shea D, Davis SN, Kim RB, et al. Effect of fasting and obesity in humans on the 6-hydroxylation of chlorzoxazone: a putative probe of CYP2E1 activity [J]. Clin Pharmacol Ther, 1994, 56(4): 359-367.
[6]Kathirvel E, Chen P, Morgan K, et al. Oxidative stress and regulation of anti-oxidant enzymes in cytochrome P4502E1 transgenic mouse model of non-alcoholic fatty liver [J]. Gastroenterol Hepatol, 2010, 25(6): 1136-1143.
[7]Scheen AJ. Controversy about the cardiovascular safety of sibutramine [J]. Drug Safety, 2010, 33(7): 615-618.
[8]Scheen AJ. Sibutramine on cardiovascular outcome [J]. Diabetes Care, 2011, 34(Suppl 2): S114-119.
[9]Chen GL, Li L, Yan SX, et al. Anti-obesity effect of sibutramine hydrochloride in alimentary obesity rats [J]. Chin J Clin Pharmacol Ther, 2003, 8(1): 55-58.
[10]Kieken F, Mutsaers N, Dolmatova E, et al. Structural and molecular mechanisms of gap junction remodeling in epicardial border zone myocytes following myocardial infarction [J]. Circ Res, 2009, 104(9): 1104-1112.
Exploration of the use of heart-specificCYP2E1 genetically modified mice in evaluation of drug-induced cardiotoxicity
PEI Yan-yu, SUN Jing-jiang, ZHAO Xian-li, HE Yin-li, WEI Ruo-yao, GAO Hong*
(Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences ( CAMS) &Comparative Medicine Center, Peking Union Medical College ( PUMC), Beijing 100021, China)
【Abstract】ObjectiveTo select more sensitive animal model to evaluate the cardiotoxicity of drugs, we used the heart-specific CYP2E1 genetically modified mice (α-MHC CYP2E1 transgenic mice [Tg(+) mice] and α-MHC CYP2E1 silencing transgenic mice [sTg(+) mice] ) to evaluate the drug sibutramine-induced cardiotoxicity. Methods The 8-week old male Tg(+), sTg(+), and C57BL/6 mice (wild type, WT), 50 mice in each group, were randomly divided into 5 groups: the solvent control group (intragastric gavage of pure drinking water), and the four sibutramine (50 mg/kg, 100 mg/kg, 150 mg/kg and 300 mg/kg) treatment groups, respectively. The general condition of the mice was observed and the survival rate was determined during the drug treatment period. At 15 days after the sibutramine administration, the blood biochemical indicators of cardiotoxicity lactate dehydrogenase (LDH), creatine kinase (CK), and creatine kinase isoenzyme (CK-MB) were assessed, and then the mice were sacrificed and heart tissue samples were taken for pathological examination and immunohistochemical observation of the expression of connexin 43 (CX43). Results(1) The blood biochemical indicators in the sibutramine 50 mg/kg and 100 mg/kg Tg(+) treated mice were significantly higher than those in the WT mice (P<0.05 or P<0.01), and significantly higher in the 50 mg/kg, 100 mg/kg and 150 mg/kg sibutramine treated Tg(+) mice than in the sTg(+) mice (P<0.05 or P<0.01). However, when the sibutramine was given at a dose of 300 mg/kg, the values of those indicators in the Tg(+) mice were significantly lower than that in the WT and sTg(+) mice (P<0.05 or P<0.01), with the lowest level in the sTg(+) mice. (2) The pathological examination revealed cardiotoxic changes in the Tg(+) and WT mice. (3) The immunohistochemical analysis showed that alongside with the increasing drug dose, the expression of CX43 was decreased in the intercalated disks of cardiomyocytes in the Tg(+), sTg(+) and WT mice, and the color staining intensity was mostly decreased in an order of Tg(+)>WT>sTg(+) mice. Conclusions Tg(+) mice may have a higher sensitivity in the evaluation of potential cardiotoxicity than WT mice, and sTg(+) mouse is a good model of protection against cardiotoxicity.
【Key words】Cytochrome P450 2E1; Gene modification; Sibutramine; Drug toxicity
[收稿日期]2015-09-09
Corresponding author:GAO Hong, E-mail: gaoh@cnilas.org
Doi:10.3969/j.issn.1005-4847.2016.01.010
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016) 01-0053-07
[作者简介]裴彦宇(1990-),女,硕士研究生,主要从事药物临床前安全性评价研究。[通讯作者]高虹 (1968-),女,硕士生导师,从事药物临床前安全性评价研究。E-mail: gaoh@cnilas.org
[基金项目]十二五重大新药创制科技项目(编号:2013ZX09302302)。
