小麦叶片表皮粉质化的遗传定位
2016-04-13耿小红武艳芍
耿小红,武艳芍,余 马
(1.运城农业职业技术学院,山西运城044000;2.西南科技大学生命科学与工程学院,四川绵阳621010)
小麦叶片表皮粉质化的遗传定位
耿小红1,武艳芍1,余 马2
(1.运城农业职业技术学院,山西运城044000;2.西南科技大学生命科学与工程学院,四川绵阳621010)
为发掘小麦中影响叶片表面粉质化的关键位点,对小麦茎叶表皮粉质化蜡质的基因进行遗传定位。以141份重组自交系群体为材料,利用已构建的高密度遗传图谱对四川推广品种川麦32的叶片表皮粉质化进行基因型鉴定。结果表明:目标性状在重组自交系群体中表现为单基因遗传,且被定位于2D染色体短臂上。
小麦;遗传定位;叶片表皮粉质化
植物表皮蜡质是联系植物和环境的界面,主要由超长链脂肪酸、酯类、伯醇、仲醇、脂肪醛及酮类组成[1]。化学成分及显微结构特征表明蜡质具有降低植物表皮湿度并形成具有清洁植物表层的功能[2]。此外,作为植物与环境间的屏障,植物蜡质结构最外层具有提高植物生物及非生物胁迫抗性,以降低植物在干旱、虫害、病原菌侵染、太阳辐射和冻害等逆境条件下的伤害[3-4]。小麦作为小春作物,广泛分布于温带、热带及亚热带地区,是人类最重要的粮食作物之一。在热带及亚热带地区,高温气候会对小麦造成严重减产。据统计,气温较生长适温每升高1℃,小麦产量降低3%~20%[5-6]。干旱也是长期威胁小麦产量的限制因素,近期世界范围内的气候变化使这一环境威胁更为严重和频繁。因此,提升小麦环境适应性以应对环境恶化和满足人类需求迫在眉睫。有研究表明,部分小麦资源的叶片、茎段及麦穗表皮具有蜡质,并形成肉眼可辨的粉质化特征[7]。Ishag研究认为,叶片蜡质可以阻挡热量侵入以降低叶面温度[8]。另外,小麦和大麦表层蜡质(或粉质)具有抗高剂量辐射、提高水分利用效率及增加产量等作用[9-10]。但是目前对小麦表皮粉质化特征的遗传机制及遗传位点发掘报道甚少,因此,发掘小麦表皮粉质化相关遗传位点对小麦抗性改良及产量提升意义重大。笔者以人工合成小麦和四川审定品种为亲本构建的重组自交系群体及其亲本为材料,同时利用已构建的高密度遗传连锁图谱对小麦叶片表面粉质化进行遗传定位研究,旨在发掘小麦中影响叶片表面粉质化的关键位点,为剖析叶片表面粉质化的小麦资源适应性提供遗传基础及理论依据。
1 材料与方法
1.1 供试材料
试验材料为170份重组自交系群体(SHW-L1×川麦32,简称SC群体)。该群体亲本SHW-L1系人工合成六倍体小麦,该亲本人工合成途径(D基因组供体亲本AS60,AB基因组供体亲本AS2255)参照张连全等的方法进行合成[11]。川麦32为四川省审定且主要推广品种,系四川省农业科学院作物研究所选育。供试材料均由四川农业大学小麦研究所提供。
1.2 田间设计
70份重组自交系群体、人工合成小麦SHW-L1及川麦32于2012—2013年种植于四川农业大学温江校区试验农场。田间采用单粒播种,种植行长1.5m,单株间距0.1m,行距0.3m,每株系种植3行,常规肥水管理及病虫害防治。
1.3 表型鉴定
待株系中50%以上植株开始抽穗时,定期观察植株叶片表面粉质情况。各株系叶片表面粉质结构性状与亲本SHW-L1一致的群体株系记为A,与亲本川麦32一致的群体株系记为B。
1.4 标记-性状连锁分析
方差分析采用SPSS16.0分析软件。SC群体遗传连锁图谱数据及各株系基因型数据来源于四川农业大学小麦研究所[12]。重组自交系群体遗传图谱共包括1 862个标记位点,全长3 766.9cM,平均标记密度为2cM每个位点。因mapmaker/EXP软件不能处理高通量的高密度图谱数据,故目标性状基因染色体定位采用Joinmap分析软件对图谱标记位点及目标性状进行群体划分,以识别到与目标性状连锁紧密的标记位点连锁群。目标性状在该连锁群的遗传定位采用mapmaker/EXP 3.0软件分析。
2 结果与分析
2.1 SC群体及亲本表型特征
重组自交系群体亲本川麦32叶片表皮披有肉眼可见的白色粉质,人工合成小麦SHW-L1叶片表皮无粉状结构。SHW-L1的A、B基因组供体亲本AS2255及D基因组供体亲本同SHW-L1表型一致。因本参试群体亲本间遗传差异较大,各株系抽穗期从3月下旬持续到6月上旬,且该期间降雨较多,造成30份株系未能记录性状,因此未纳入分析。纳入表型记录的141份重组自交系群体中,75份株系叶片表皮有白色粉状结构,与川麦32表型一致。66份株系叶片表皮肉眼判断无粉状结构,其表型性状与SHW-L1表型一致。卡方检验结果表明,表皮粉质结构在参试重组自交系群体中分离比例为1∶1,因此该性状复合单基因遗传分离模式。
2.2 目标性状染色体定位
小麦叶片表皮粉状结构的染色体定位分析结果表明,目标性状被划分到2D染色体所在连锁群。该染色体由99个遗传位点构成,其中SSR位点13个,DArT位点86个。目标性状遗传位点与2D染色体上0~35.6cM区段内15个标记位点最为紧密(图示)。利用目标位点关联区段内的15个标记位点对群体亲本SHW-L1及其合成亲本AS60和AS2255进行基因型鉴定分析发现,15个位点在异源六倍化过程中均按孟德尔遗传规律进行传递。
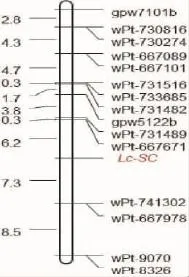
图示 小麦叶片表皮粉质化在2D染色体短臂上的遗传定位Fig. Genetic mapping of leaf glaucousness on chromosome 2DS in wheat
3 结论与讨论
对小麦茎秆及叶片表皮粉质化结构及无粉质化结构表型遗传分析发现,该性状是由控制蜡质合成基因(W1基因和W2基因)及抑制蜡质合成基因(Iw1和Iw2)两类基因控制。W1基因及对应的Iw1基因被定位于2B染色体短臂上,且成紧密连锁分布[13]。W2基因被定位于2D染色体着丝粒附近,而Iw2基因则被定位于2D染色体短臂末端处。来源于野生二粒小麦(Triticumdicoccoides)的Iw3基因及Ws基因则分别被定位于1B染色体短臂及1A染色体短臂上[14]。Iw3基因及Ws基因主要控制小麦穗部表皮的蜡质结构生产。近年来,对小麦蜡质的QTL定位也有报道,Bennett等[15-16]研究表明,位于3A及7A上旗叶粉质相关主效QTL;Borner[17]等利用ITMI群体在1A、1D、2D、4A、4B、6A、7A及7D上都发掘到叶片粉质相关的微效位点;Mondal等[18]报道,染色体1B、3D和5A上旗叶叶片蜡质化相关QTL,2D、3B和5A上旗叶叶片温度降低相关QTL,3B、5A和5B上穗部温度降低相关QTL的存在。表明,小麦植株表皮粉质化相关遗传机制较为复杂。本研究发掘到的叶片表皮粉质化为单基因遗传,该位点可能与Iw2基因及Borner、Kulwal及Mondal等在2D上报道的位点具有等位性。川麦32系国外引进资源杂交后所得,其具有较高环境适应性,且农艺性状和产量性状优良。因此,深入发掘该品种抗性相关遗传位点以进行小麦适应性改良非常重要。
遗传定位研究中,目标性状的遗传力及群体大小对定位结果影响较大[19]。本研究中目标性状可视化效果明显,在多年多点试验中均独立于环境表达。因此,群体大小是研究结果可靠程度的主要影响因素。本研究参试群体仅有141份重组自交系,该群体可以满足目标性状的初步定位。目前,四川农业大学小麦研究所针对2D染色体建立精细化的代换系群体,有必要进一步进行目标性状精细化定位及表达验证研究。
[1]KUNST L,SAMUELS A L.Biosynthesis and secretion of plant cuticular wax[J].Prog Lipid Res,2003,42:51-80.
[2]BARTHLOTT W,NEINHUIS C.Purity of the sacred lotus or escape from contamination in biological surfaces[J].Planta,1997,202:1-7.
[3]EIGENBRODE S D,ESPELIE K E.Effects of plant epicuticular lipids on insect herbivores[J].Ann Rev Entomol,1995,40:171-194.
[4]JENKS M A,ASHWORTH E N.Plant epicuticular waxes:function,production,and genetics[J].Hortic Rev,1999,23:1-68.
[5]LOBELL D B,BURKE M B,TEBALDI C,et al.Prioritizing climate change adaptation needs for food security in 2030[J].Science,2008,319:607-610.
[6]MONDAL S,SINGH R P,CROSSA J,et al.Earliness in wheat:a key to adaptation under terminal and continual high temperature stress in South Asia[J].Field Crops Res,2013,151:19-26.
[7]JENSEN N F,DRISCOLL C J.Inheritance of the waxless character in wheat[J].Crop Sci,1962,2:504-505.
[8]ISHAG H M.Genotypic differences in heat stress in wheat in the irrigated gezira scheme.In:Saunders DA,Hettel GP(eds)Wheat in heat stressed environments:irrigated,dry areas and rice wheat cropping systems[M].Mexico:CIMMYT,2003:170-174.
[9]GONZALEZ A,AYERBE L.Effect of terminal water stress on leaf epicuticular wax load,residual transpiration and grain yield in barley[J].Euphytica,2010,172:341-349.
[10]KING R W,VON WETTSTEIN-Knowles P.Epicuticular waxes and regulation of ear wetting and preharvest sprouting in barley and wheat[J].Euphytica,2000,112:157-166.
[11]ZHANG L Q,LIU D C,YAN Z H,et al.Rapid changes of microsatellite flanking sequence in the allopolyploidization of new synthesized hexaploid wheat[J].Science in China Ser.C Life Sciences,2004,47:553-561.
[12]YU M,MAO S L,CHEN G Y,et al.QTLs for uppermost internode and spike length:whether they affect wheat height at an individual QTL level in two RIL populations?[J].Euphytica,2014,200(1):95-108.
[13]TSUNEWAKI K.Comparative gene analysis of common wheat and its ancestral species.2.Waxiness growth habit and awnedness[J].Jap J Bot,1966,19:175-254.
[14]GADALETA A,GIANCASPRO A,GIOVE S L,et al.Genetic and physical mapping of new EST-derived SSRs on the A and B genome chromosomes of wheat[J].Theor Appl Genet,2009,118:1015-1025.
[15]BENNETT D,IZANLOO A,EDWARDS J,et al.Identiication of novel quantitative trait loci for days to ear emergence and lag leaf glaucousness in a bread wheat(TriticumaestivumL.)population adapted to southern Australian conditions[J].Theor Appl Genet,2012,124:697-711.
[16]MASON R E,MONDAL S,BEECHER F W,et al.QTL associated with heat susceptibility index in wheat(TriticumaestivumL.)under short-term reproductive stage heat stress[J].Euphytica,2010,174:423-436.
[17]BORNER A,SCHUMANN E,FURSTE A,et al.Mapping of quantitative trait loci determining agronomic important characters in hexaploid wheat(TriticumaestivumL.)[J].Theor Appl Genet,2002,105:921-936.
[18]MONDAL S,MASON R E,TREVIS H,et al.QTL on wheat(TriticumaestivumL.)chromosomes 1B,3D and 5Aare associated with constitutive production of leaf cuticular wax and may contribute to lower leaf temperatures under heat stress[J].Euphytica,2015,201:123-130.
[19]COLLARD B C Y,JAHUFER M Z Z,BROUWER J B,et al.An introduction to markers,quantitative trait loci(QTL)mapping and marker-assisted selection for crop improvement:The basic concepts[J].Euphytica,2005,142:169-196.
(责任编辑:姜 萍)
Genetic Mapping of Leaf Glaucousness in Wheat
GENG Xiaohong1,WU Yanshao1,YU Ma2
(1.YunchengVocationalandTechnicalCollegeofAgriculture,Yuncheng,Shanxi044000;2.SchoolofLifeScience andEngineering,SouthwestUniversityofScienceandTechnology,Mianyang,Sichuan621010,China)
In order to explore the key loci influencing leaf glaucousness in wheat,genetic mapping of leaf glaucousness for commercial variety of Chuanmai32was conducted based on 141recombinant intercross lines(RILs)and a high density genetic map.Results:The inheritance of leaf glaucousness in RILs population followed a monogenic inheritance,and the genetic locus for target trait was located on chromosome 2DS.
wheat;genetic mapping;leaf glaucousness
S512
A
2016-01-25;2016-08-26修回
西南科技大学博士基金项目“小麦杂种优势利用研究”(13ZX7155)
耿小红(1969-),女,讲师,硕士,从事小麦遗传育种研究。E-mail:gengxiaohong126@126.com
1001-3601(2016)09-0368-0001-03
