T1期非小细胞肺癌肺叶切除和亚肺叶切除的临床疗效比较
2016-04-12马千里刘德若郭永庆石彬田燕雏宋之乙梁朝阳
马千里 刘德若 郭永庆 石彬 田燕雏 宋之乙 梁朝阳
T1期非小细胞肺癌肺叶切除和亚肺叶切除的临床疗效比较
马千里 刘德若 郭永庆 石彬 田燕雏 宋之乙 梁朝阳
目的探讨肺叶切除和亚肺叶切除在T1期非小细胞肺癌(NSCLC)(肿瘤直径≤3cm)外科治疗中的应用价值。方法收集2007年1月至2014年12月在北京中日友好医院胸外科接受手术治疗的278例T1期NSCLC患者的临床资料。患者平均年龄(60.7±10.4)岁。其中亚肺叶切除61例(楔形切除35例,肺段切除26例),肺叶切除217例。腺癌占81.7%,鳞癌占12.9%,其他占5.4%;高分化癌占8.6%,中分化癌占27.0%,低分化癌占20.5%,不能确定占43.9%。在腺癌中,浸润前病变占4.0%,微浸润腺癌占7.5%,浸润性腺癌占88.5%。T1N0M0占86.7%,T1N1M0占1.1%,T1N2M0占12.2%。结果与肺叶切除组比较,亚肺叶切除组患者年龄较大、手术时间较短、病变≤2cm的比例较高,两组间比较差异均有统计学意义(t=0.496,P=0.009;t=8.082,P=0.029;χ2=2.105,P=0.002)。但两组间在1秒钟用力呼气容积(FEV1)、FEV1%,以及手术方式和术后并发症发生率方面,差异均无统计学意义(t=0.065,P=0.713;t=2.12,P=0.085;χ2=0.399,P=0.274;χ2=0.438,P=0.490)。对于T1N0M0的NSCLC患者,亚肺叶和肺叶切除组患者的5年生存率分别为73.9%和83.5%,差异无统计学意义(P=0.883)。亚肺叶切除组内分析显示:楔形切除组和肺段切除组患者的5年生存率分别为79.4%和70.6%,差异无统计学意义(P=0.979)。多因素分析显示:仅有年龄和纵隔淋巴结转移N2为预后不良的危险因素(HR=1.07,P=0.048;HR=5.56,P=0.011)。亚肺叶切除组患者的5年生存率与肺叶切除组比较差异无统计学意义(HR=1.38,P=0.552)。结论对于T1N0M0的NSCLC患者,亚肺叶切除虽然不可能完全替代肺叶切除手术,但是对于肺功能储备较差的老年患者可能逐渐成为主流术式。
非小细胞肺癌; 亚肺叶切除; 肺叶切除; 早期
无论是发达国家还是发展中国家,肺癌的发病率都呈现明显上升的趋势,在全球范围而言,肺癌导致的病死率已经超过其他恶性肿瘤,位居第一位[1]。根据组织病理学分类,肺癌可分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non small cell lung cancer,NSCLC),其中NSCLC比例接近80%[2]。尽管肺叶切除术自1995年起便已成为切除早期NSCLC的标准术式[3],但是在过去的80年中肺癌疾病谱发生了很大的变化,影像学上表现为外周型肺磨玻璃影(ground glass opacity,GGO)的早期肺癌越来越多。随着老龄化社会的到来,肺功能储备和肺癌复发风险较低以及生命预测值较少的70岁以上的老年患者也逐渐增多。另外,肺部同侧、双侧多发病变的发生率以及肺部再发病变者也在增加,肺叶切除后这类患者有可能丧失了二次手术机会。基于以上问题,肺叶切除+纵隔淋巴结清扫术还是这部分早期肺癌患者的标准术式吗?近年来,能够保留更多肺功能的亚肺叶切除术是否可以作为替代术式成为研究的热点。
资料与方法
一、临床资料
收集2007年1月至2014年12月在北京中日友好医院胸外科接受治疗的278例T1期NSCLC患者的临床资料。其中男性165例,女性113例;年龄26~77岁,平均(60.7±10.4)岁。手术方式:亚肺叶切除61例,肺叶切除217例;亚肺叶切除组包括楔形切除35例,肺段切除26例。腺癌227例(81.7%),鳞癌36例(12.9%),其他15例(5.4%);高分化癌24例(8.6%),中分化癌75例(27.0%),低分化癌57例(20.5%),不能确定122例(43.9%)。在腺癌中,浸润前病变9例(4.0%)(非典型腺瘤样增生AIH 2例,原位癌AIS 7例),微浸润腺癌MIA17例(7.5%),浸润性腺癌201例(88.5%)(亚型包括附壁生长为主型68例,腺泡型62例,乳头型41例,微乳头型10例,实体型20例)。术后病理TNM分期显示:T1N0M0 241例(86.7%),T1N1M0 3例(1.1%),T1N2M0 34例(12.2%)。
二、术前评估和入组标准
(一)术前评估
所有患者有完整的病史及随访资料,包括年龄、性别、原发灶的部位、大小、手术日期、手术方式、肿瘤病理类型、术后病理TNM分期、辅助治疗〔包括术前新辅助治疗、术后化疗和(或)放疗〕、存活状态(无瘤或带瘤)及生存期。术前检查包括胸部X线片、胸部CT、腹部B超(或CT)、支气管镜检查、肺功能测定、头颅磁共振、骨扫描、PET-CT和常规血液检查。用纵隔镜或支气管内超声引导下经支气管针吸活检(endobronchial ultrasound guided transbronchial needle aspiration,EBUS-TBNA)用来评估术前是否存在纵隔淋巴结转移(N2)。
(二)入组标准
1.纳入标准:(1)术前检查排除远处转移;(2)手术方式为肺叶切除、肺段切除或者楔形切除术;(3)按照国际肺癌研究学会(IASLC)第七版TNM分期标准,术后病理分期为T1期(肿瘤直径≤3cm)。
2.排除标准:(1)术后病理分期非T1期患者;(2)病理检查显示为小细胞肺癌患者。
(三)随访要求
术后通过门诊或者住院复查、信件和电话等形式完成随访。观察起点为手术日,终点为肿瘤复发或死亡,复发包括胸腔内局部复发和胸腔外转移性复发,复发时间以初次复发病灶为准。随访时间自观察起始点至末次随访或观察终点。所有入组患者均签署了知情同意书,此项目获得北京中日友好医院伦理委员会的批准。
三、麻醉、体位及手术步骤
手术在气管双腔插管、患侧肺萎陷的条件下进行。患者取健侧卧位,腋下垫枕,调整手术床为折刀位。胸腔镜手术为KARL STORZ一体化手术室及高清胸腔镜系统(德国KARL STORZ公司生产)。手术切口需依据病情难易程度以及术者习惯来选择,可选择2~4个切口。观察孔一般位于腋中线第8肋间,长1.5cm;体重指数偏大者膈肌水平往往较高,可以根据胸部正位X线片将观察孔提高至第7肋间。主操作孔位于腋前线第4或第5肋间,直径4.0~5.0cm;左侧主操作孔由于心脏的遮挡,可以向腋中线靠近。副操作孔的选择可以根据术者习惯而定,一般选择肩胛下角线第7或8肋间长1.5cm切口。探查明确病变位置后,如选择楔形切除术则用腔镜直线型切割缝合器切除病变;如选择肺段或肺叶切除手术,则分别解剖段或叶静脉、动脉、支气管并以腔镜直线型切割缝合器处理。
四、统计学方法
结 果
一、肺叶切除组与亚肺叶切除组临床特征比较
亚肺叶切除组患者年龄较肺叶切除组患者大7岁,差异有统计学意义(t=0.496,P=0.009。与肺叶切除组比较,亚肺叶切除组患者1秒钟用力呼气容积(forced expiratory volume in one second,FEV1)减少0.5L/s,FEV1%减少10%,但差异均无统计学意义(t=0.065,P=0.713;t=2.12,P=0.085)。与肺叶切除组比较,亚肺叶切除组手术时间缩短47min,差异有统计学意义(t=8.082,P=0.029);亚肺叶切除组病变≤2cm的比例显著高于肺叶切除组,差异也有统计学意义(χ2=2.105,P=0.002)。两组在手术方式和术后并发症发生率方面,差异均无统计学意义(χ2=0.399,P=0.274;χ2=0.438,P=0.490)(表1)。两组中的N2患者术后辅助治疗策略无差异,均进行术后化疗和纵隔放疗;本组病例中,亚肺叶切除组没有N1患者。两组间局部淋巴结复发比例差异也无统计学意义差异(P=0.668)。
二、生存率分析
对于T1N0M0的NSCLC患者,亚肺叶和肺叶切除组患者的5年生存率分别为73.9%和83.5%,差异无统计学意义(P=0.883)(图1)。亚肺叶切除组内分析显示:楔形切除组和肺段切除组患者的5年生存率分别为79.4%和70.6%,差异无统计学意义(P=0.979)(图2)。多因素分析显示:仅有年龄和纵隔淋巴结转移N2为预后不良的危险因素(HR=1.07,P=0.048;HR=5.56,P=0.011)。亚肺叶切除组患者的5年生存率于肺叶切除组比较差异无统计学意义(HR=1.38,P=0.552)(表2)。
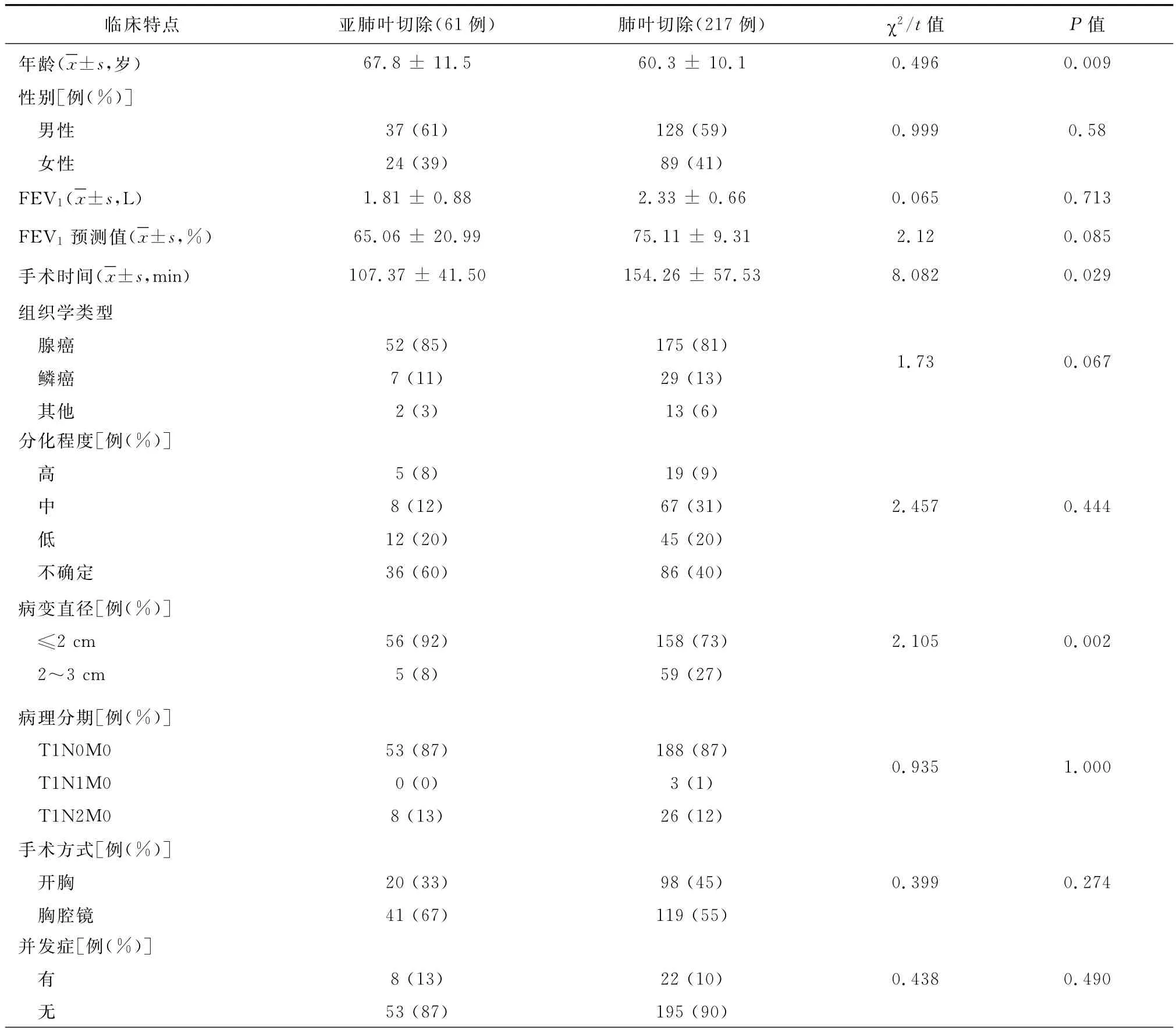
表1 肺叶切除组与亚肺叶切除组临床特点比较
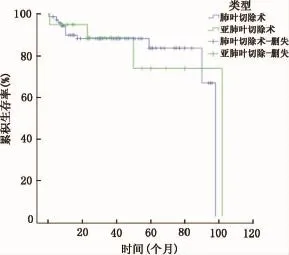
图1 亚肺叶切除与肺叶切除组患者的生存曲线比较(5年生存率分别为73.9%和83.5%,P=0.883)
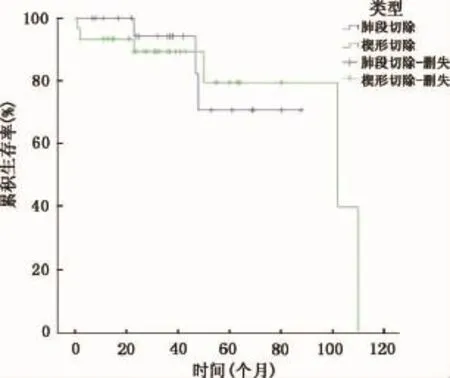
图2 楔形切除组与肺段切除组患者的生存曲线比较(5年生存率分别为79.4%和70.6%,P=0.979)

表2 NSCLC患者单因素及多因素生存分析
讨 论
相对于肺叶切除,亚肺叶切除的范围毕竟有所缩小,理论上术后长期生存率应该较肺叶切除差。但是,亚肺叶切除术比较容易掌握,手术时间短,患者麻醉相关并发症减少,术中大出血等因为解剖肺门结构而引发的严重并发症发生率有所减少。尤其是针对肿瘤体积小、肺门及纵隔淋巴结转移率低的早期NSCLC患者而言,亚肺叶切除术后长期生存率是否劣于肺叶切除仍存在着争议。Yendamuri等[4]对早期NSCLC的亚肺叶切除和肺叶切除进行对比,结果显示随着时间的变化,与亚叶切除相比,肺叶切除术后的生存优势逐渐缩小,2005—2008年的数据显示亚叶切除与肺叶切除的总生存率与无病生存期无明显差异。Yang和D'Amico[5]报道,与胸腔镜肺叶切除术相比,胸腔镜肺段切除术的并发症发生率、肿瘤复发率、生存率相当,术后肺功能和活动能力明显提高。日本学者Tsutani等[6]报道Ⅰa期肺腺癌患者可以行肺段切除,其生存率与行肺叶切除的患者无明显差异。2012年Fan等[7]进行的Meta分析结果显示,虽然Ⅰ期患者亚叶切除组生存率较低;而当肿瘤最大径≤2cm时,亚叶切除组的生存率与肺叶切除组无明显差异。
早期NSCLC亚肺叶切除病例选择的标准和可能受益的人群应该从患者的年龄、肺功能情况,以及病变的大小、部位、性质来综合分析,具体包括:(1)年龄>75岁,术后肺功能代偿程度有限;(2)心肺功能较差,FEV1%<50%;(3)并发症较多,预计无法耐受肺叶切除术;(4)作为肺叶切除术后再发癌的手术方式;(5)合并不同肺叶内小结节需同期手术切除;(6)周围型病变:最大径≤3cm,位于肺外侧1/3或局限于单一肺段内(肿瘤距离段间平面超过2 cm);(7)高分辨率CT显示纵隔和肺门无肿大淋巴结,和(或)FDG-PET显示纵隔和肺门淋巴结无示踪剂浓聚;(8)术中冰冻病理:N1、N2组淋巴结阴性,切除肺边缘病理证实为阴性。禁忌证:(1)病变位于段间裂;(2)一般情况差,肺功能受限,全身麻醉风险大;(3)术中纵隔淋巴结活检冰冻病理提示阳性;(4)肺切除边缘冰冻病理提示阳性或者距离肿瘤小于1cm。
亚肺叶切除的手术方式依据其部位深浅决定,对于靠近肺脏层胸膜的外周型病灶,可以直接行肺楔形切除术;如果肺内病灶远离脏层胸膜而靠近肺门,距离支气管、肺动脉、肺静脉近,楔形切除困难的患者,则可以直接进行解剖性肺段切除术。亚肺叶切除的手术顺序应该首先对肺门及纵隔淋巴结进行采样,下叶采集第7~9组,左侧上叶采集第5、6组(第4组部分患者采集),右上叶采集第2~4组。而后送快速冰冻病理,若为阳性则行肺叶切除,若为阴性则行亚肺叶切除。切除的病变送冰冻病理,按照目前最新肺腺癌的分类,若为不典型腺瘤样增生、肺原位腺癌、微小浸润性腺癌和贴壁生长为主的浸润性腺癌可以考虑行解剖性肺段切除。肺段的边缘再次送冰冻病理确定是否有肿瘤细胞残留,若有残留,需要继续切除肺叶。肺段切除方法通常从肺根部血管向远端解剖,明确肺段的供应血管后先处理肺段静脉,然后依据不同肺段依次处理肺段动脉和支气管,或者先处理肺段支气管再处理肺段动脉,最后依据肺段范围切断肺组织,有些患者可以选择肺段静脉连同肺组织一并处理。由于下叶背段及舌段解剖比较固定、变异小,切除相对容易,最常用的肺段切除手术是左侧舌段切除和双侧下叶背段切除,其次是左侧固有上叶切除和基底段切除[8]。虽然上叶前段、后段切除较少用,但在技术上完全可行,单纯的下叶某个基底段切除较为少用[9]。
综上所述,随着越来越多的早期NSCLC患者被发现,老龄化社会的到来以及同侧或者双侧多发肺部小结节的出现,亚肺叶切除虽然不可能完全替代肺叶切除手术,但是对于肺功能储备较差的老年患者而言可能逐渐成为主流术式。
1 Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
2 Jentsch TJ,Stein V,Weinreich F,et al.Molecular structure and physiological function of chloride channels[J].Physiol Rev,2002:82(2):503-68.
3 Ginsberg RJ,Rubinstein LV.Randomized trial of lobectomy versus limited resection for T1N0non-small cell lung cancer[J].Ann Thorac Surg,1995,60(3):615-623.
4 Yendamuri S,Sharma R,Demmy M,et al.Temporal trends in outcomes following sublobar and lobar resections for small(≤2cm)non small cell lung cancers—a surveillance epidemiology end results database analysis[J].J Surg,Res,2013,183(1):27-32.
5 Yang CF,D'Amico TA.Thoracoscopic segmentectomy for lung cancer[J].Ann Thorac Surg,2012,94(2):668-681.
6 Tsutani Y,Miyata Y,Nakayama H,et al.Oncologic outcomes of segmentectomy compared with lobectomy for clinical stageⅠA lung adenocarcinoma:propensity score-matched analysis in a multicenter study[J].J Thorac Cardiovasc Surg,2013,146(2):358-364.
7 Fan J,Wang L,Jiang GN,et al.Sublobectomy versus lobectomy for stageⅠnon-small-cell lung cancer,a meta-analysis of published studies[J].Ann Surg,Oncol,2012,19(2):661-668.
8 D'Amico TA.Thoracoscopic segmentectomy:technical considerations and outcomes[J].Ann Thorac Surg,2008,85(2):S716-S718.
9 Sienel W,Stremmel C,Kirschbaum A,et al.Frequency of local recurrence following segmentectomy of stageⅠA non-small cell lung cancer is influenced by segment localisation and width of resection margins-implications for patient selection for segmentectomy[J].Eur J Cardiothorac Surg,2007,31(3):522-527;discussion 527-528.
Comparison of outcomes between sublobar resection and lobectomy for T1 non-small cell lung cancer
Ma Qianli,Liu Deruo,Guo Yongqing,Shi Bin,Tian Yanchu,Song Zhiyi,Liang Chaoyang.Department of Thoracic Surgery,China-Japan Friendship Hospital,Beijing 100029,China
Liu Deruo,Email:deruoliu@vip.sina.com
ObjectiveTo compare the outcomes between sublobar resection and lobectomy for T1 non-small cell lung cancer(NSCLC)(tumor diameter≤3cm).MethodsThe clinical data of 278patients with T1NSCLC undergoing surgery in Department of Thoracic Surgery in China-Japan Friendship Hospital between January 2007and December 2014were collected.The mean age of these patients was(60.7±10.4)years.Sixty-one patients received sublobar resection(wedge resection,n=35;segmentectomy,n=26),and the other 217underwent lobectomy.There was 81.7%of adenocarcinoma,12.9%of squamous cell carcinoma,and 5.4%of cancer of other types.High differentiated,moderate differentiated and poor differentiated cancer accounted for 8.6%,27.0%and 20.5%,respectively,and there were 43.9%cases with undermined differentiation status.In cases of adenocarcinoma,there were 4.0%preinvasive lesions,7.5%minimally-invasive lesions and 88.5%invasive adenocarcinoma.There were 86.7%cases with T1N0M0,1.1%cases with T1N1M0and 12.2%cases with T1N2M0.ResultsCompared with lobectomy group,patients were much elder,the duration of operation was much shorter,and the percentage of lesion≤2cm was significantly larger in sublobar resection group(t=0.496,P=0.009;t=8.082,P=0.029;χ2=2.105,P=0.002).There was no significant difference in forced expiratory volume in one second(FEV1),FEV1%,surgical procedure and incidence of postoperative complications between two groups(t=0.065,P=0.713;t=2.12,P=0.085;χ2=0.399,P=0.274;χ2=0.438,P=0.490).For NSCLC patients with T1N0M0,the 5-year survival of sublobar resection group and lobectomy group were 73.9%and 83.5%,respectively,with no significant difference(P=0.883).In sublobar resection group,the 5-year survival of patients undergoing wedge resection and segmentectomy were 79.4%and 70.6%,respectively,with no significant difference(P=0.979).Multivariate analysis indicated that only age and mediastinal lymph node metastasis N2were risk factors for poor prognosis(HR=1.07,P=0.048;HR=5.56,P=0.011).There was no significant difference in 5-year survival between sublobar resection group and lobectomy group(HR=1.38,P=0.552).ConclusionsFor NSCLC patients with T1N0M0,though sublobar resection can not totally substitute lobectomy,it may become a main surgical procedure for senior patients with poor pulmonary reserve.
Non-small cell lung cancer; Sublobar resection; Lobectomy; Early stage
2016-01-06)
(本文编辑:周珠凤)
10.3877/cma.j.issn.2095-8773.2016.01.029
100029 北京中日友好医院胸外科
刘德若,Email:deruoliu@vip.sina.com
马千里,刘德若,郭永庆,等.T1期非小细胞肺癌肺叶切除和亚肺叶切除的临床疗效比较[J/CD].中华胸部外科电子杂志,2016,3(1):29-34.
