红花混悬液抗D-氨基半乳糖致大鼠肝细胞凋亡的机理研究
2016-04-06娜仁满都拉白梅荣乌日汉巴根那内蒙古民族大学蒙医药学院内蒙古通辽028000
娜仁满都拉, 白梅荣, 桂 荣, 乌日汉, 巴根那(内蒙古民族大学蒙医药学院,内蒙古通辽028000)
红花混悬液抗D-氨基半乳糖致大鼠肝细胞凋亡的机理研究
娜仁满都拉, 白梅荣*, 桂 荣, 乌日汉, 巴根那
(内蒙古民族大学蒙医药学院,内蒙古通辽028000)
摘要:目的 初步探讨红花混悬液对D-氨基半乳糖(D-Ga1N)诱导的大鼠急性肝损伤的保护作用机理。方法 以D-Ga1N诱导建立大鼠急性肝损伤模型,观察红花混悬液对血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、谷胱甘肽过氧化物酶(GSH-Px)、肝细胞凋亡及肝组织病理作用变化。结果 红花混悬液明显降低急性肝损伤大鼠血清ALT、AST活性,提高血清和肝组织GSH-Px含有量,降低细胞凋亡程度,有效减轻D-Ga1N所致的肝组织病理改变。结论 抑制肝细胞凋亡是红花抗急性肝损伤的作用机制之一。
关键词:红花混悬液;D-氨基半乳糖;大鼠;细胞凋亡;肝损伤
红花是菊科植物红花(Carthamus tinctorius L.)的干燥花,是蒙医临床常用的药材之一。在传统蒙药学理论指导下的红花被誉为“肝脏之好”,在保肝作用的常用蒙药复方古日古木-13、古日古木-7、额力根汤等十几个蒙药复方的配伍组成中扮演着“君药”作用[1]。红花被《中华本草·蒙药卷》(2004年版)收载,性凉、味微苦、具有重、钝、柔、和、固等性能;具有凉血、锁脉、调经、清肝、强身、止痛、消肿作用等功效。主要用于肝热,月经不调,呕血,鼻衄,外伤出血,血热疼痛,心热,血热等病症[2]。本实验以建立大鼠D-氨基半乳糖(D-Ga1N)急性肝损伤模型,观察红花对血清和肝组织谷胱甘肽过氧化物酶(GSHPx)含有量变化及防止急性肝损伤细胞凋亡的作用,初步探讨其红花混悬液抗急性损伤的作用机理。
1 实验材料
1.1 动物 SD种雄性大鼠,体质量为(200±10)g,由长春市亿斯实验动物技术有限责任公司提供,SCKK(吉)-2011-0004。
1.2 药品与试剂 红花由内蒙古民族大学提供,护肝片(广东康尔丹制药有限公司,批号Z20054567);D-Ga1N购自北京拜迪生物有限公司;Annexin V-FITC细胞凋亡试剂盒、血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒均购自南京建成生物科技有限公司;羧甲基纤维素钠(CMC-Na)购自国药集团化学试剂有限公司。Annexin V-FITC细胞凋亡检测试剂盒(G0033)、PBS(ST476)、无毒环保HE染液(D006)均购自南京建成生物工程研究所。无水乙醇(天津市德恩化学试剂有限公司);二甲苯(天津市天力化学试剂有限公司)。
1.3 仪器 罗氏全自动生化分析仪(上海同舸医疗器械有限公司);TGL-20B型离心机(上海安亭科学仪器厂);BD Ca1ibur型流式细胞仪(北京东迅天地医疗仪器有限公司);CX31型显微镜成像系统(北京瑞科中仪科技有限公司);KD1508型轮转式切片机(浙江金华科迪仪器设备有限公司)。
2 实验方法
2.1 红花混悬液制备方法 红花混悬液小剂量的制备方法为把人的每天口服剂量5 g(设人标准体质量为70 kg)按体表面积的计算方法换算为大鼠的剂量0.43 g/kg。即称取0.43 g红花粉末,加0.5% CMC-Na溶液20 mL(每100 g体质量大鼠灌胃2 mL溶液),配制成为0.021 5g/mL溶液;红花混悬液大剂量的制备方法为根据预实验结果,设大剂量为小剂量的9倍。即称取3.87 g红花粉末,加0.5% CMC-Na溶液20 mL,配制成为0.193 5 g/mL溶液。
2.2 实验动物分组及处理 将50只大鼠按体质量随机分为5个组,即正常对照组、模型对照组、红花混悬液大剂量组(3.87 g/kg)、红花混悬液小剂量组(0.43 g/kg)、护肝片阳性对照组(0.36 mg/kg),每组10只。从实验第1天开始,各给药组灌胃相应的药物溶液,每日灌胃1次,连续灌胃21 d,正常对照组和模型对照组灌胃给予等量CMC-Na溶液。末次给药0.5 h后,除了正常对照组外,其余各组按照300 mg/kg剂量腹腔注射D-Ga1N生理盐水溶液,建立急性肝损伤模型。禁食不禁水的条件下,20 h后用10%的水合氯醛麻醉动物,从腹主动脉取血,3 500 r/mim离心10 min分离血清,测定AST、ALT和GSH-Px值,取部分肝组织在10%甲醛中固定,按HE染色常规要求进行修块、脱水、浸蜡、包埋,待观察各组病理组织学变化;取部分肝组织-80℃冻存,待测定肝组织GSH-Px值,并观察肝细胞凋亡变化。
2.3 流式细胞仪分析 取大鼠肝组织,分离肝细胞,用PBS洗涤细胞1次(1 000 r/min离心5 min)收集并调整细胞密度为1×106/mL的混悬液;Fa1con试管中加入100 μL细胞混悬液;依次加入500 μL结合液、5 μL Annexin V及5 μL核酸染料;轻轻混匀,室温(20~25℃)避光处放置10 min。流式细胞仪检测凋亡率。
2.4 统计学分析 采用SPSS 17.0统计软件进行数据分析。实验数据以均数±标准差(±s)表示,进行单因素方差分析及t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 红花混悬液对血清ALT,AST水平的影响 与正常对照组比较,模型对照组大鼠血清AST和ALT活性均显著升高,差异显著,有统计学意义(P<0.01)。表明急性肝损伤模型复制成功。与模型对照组比较,阳性对照组大鼠血清AST和ALT活性均显著降低,差异显著,有统计学意义(P<0.05)。与模型对照组比较,红花混悬液大剂量组和小剂量组大鼠血清AST和ALT活性均显著降低,差异显著,有统计学意义(P<0.05)。结果见表1。
表1 红花混悬液对大鼠血清ALT和AST水平的影响(±s,n=8)

表1 红花混悬液对大鼠血清ALT和AST水平的影响(±s,n=8)
注:与模型对照组比较,*P<0.05,**P<0.01
组别 ALT/(U·L-1) AST/(U·L-1)正常对照组 35.91±10.09** 94.31±15.00**模型对照组 627.51±282.81 622.43±257.12阳性对照组 295.17±85.52* 315.90±84.63*红花混悬液小剂量组 292.46±161.53* 333.05±151.51*红花混悬液大剂量组 285.52±155.86* 381.82±174.31*
3.2 红花混悬液对血清和肝组织GSH-Px水平的影响 与正常对照组比较,模型对照组肝组织和血清GSH-Px活性明显降低,差异显著,有统计学意义(P<0.05)。与模型对照组比较,红花混悬液小、大剂量组肝组织和血清GSHPx活性明显升高,差异显著,有统计学意义(P<0.05)与模型对照组比较,阳性对照组血清GSH-Px明显升高,差异显著,有统计学意义(P<0.05),但肝组织GSH-Px有升高趋势,但无统计学意义(P>0.05)。结果见表2。
表2 红花混悬液在小鼠血清和肝组织中GSH-Px的含有量变化(±s,n=8)
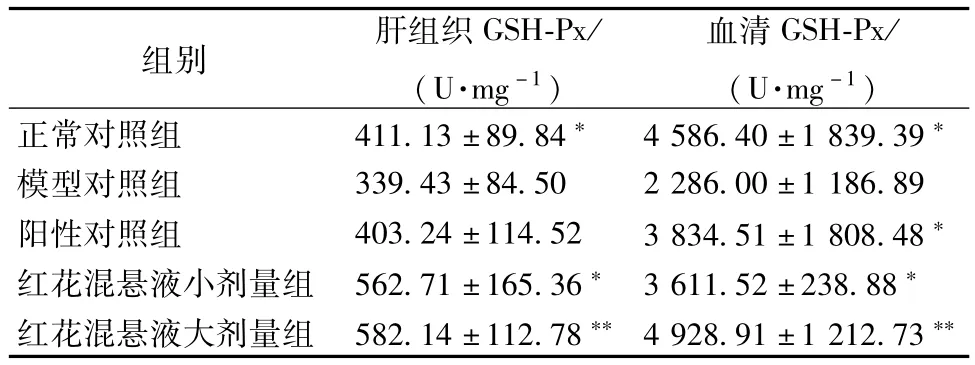
表2 红花混悬液在小鼠血清和肝组织中GSH-Px的含有量变化(±s,n=8)
注:与模型对照组比较,*P<0.05,**P<0.01
组别 肝组织GSH-Px/ (U·mg-1)血清GSH-Px/ (U·mg-1)正常对照组 411.13±89.84* 4 586.40±1 839.39*模型对照组 339.43±84.50 2 286.00±1 186.89阳性对照组 403.24±114.52 3 834.51±1 808.48*红花混悬液小剂量组 562.71±165.36*3 611.52±238.88*红花混悬液大剂量组 582.14±112.78**4 928.91±1 212.73**
3.3 红花混悬液对D-Ga1N所致大鼠急性肝损伤组织病理变化的影响 正常对照组肝小叶结构清晰,细胞索排列整齐,肝窦正常,肝细胞无明显病变,核结构清晰。模型对照组肝小叶处肝细胞明显坏死或变性,损伤较重的肝细胞坏死严重,在坏死细胞周围见到炎性细胞浸润,在肝小叶间及肝窦处见到肿胀血管。红花大剂量肝小叶结构较完整,肝总管及肝窦处血管肿胀现象明显缓解且炎细胞浸润减少,见少量坏死肝细胞;红花小剂量组肝小叶结构恢复不全面,肝小叶及肝总管周围仍见到变性肝细胞、炎细胞及少量的坏死和肿胀肝细胞。阳性对照组肝小叶结构趋于正常,肝总管及肝窦处可见少量的肿胀血管及炎细胞,可见到新生双核肝细胞。见图1。
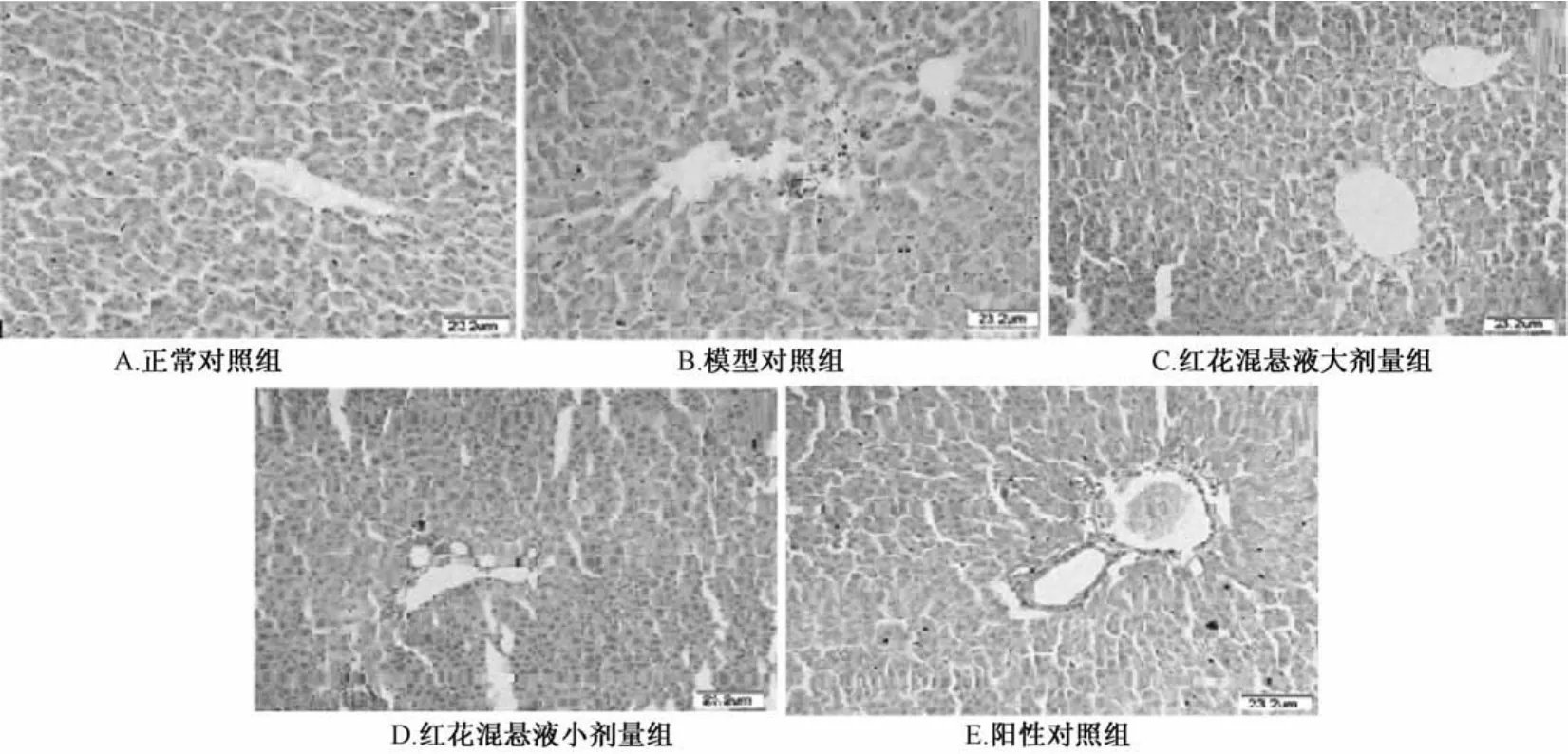
图1 光学显微镜下检测各组大鼠肝组织病理变化(HE染色,×100)
3.4 红花混悬液对肝细胞凋亡的影响 与正常对照组比较,模型对照组的肝细胞凋亡数目显著增多,有统计学意义(P<0.01)。与模型组比较,阳性对照组和小、大剂量红花混悬液组细胞凋亡数目显著降低,有统计学意义(P<0.01)。提示红花混悬液具有抑制肝细胞凋亡作用。结果见表3、图2。
表3 红花混悬液对D-GalN诱导急性肝损伤细胞凋亡的影响(±s,n=8)
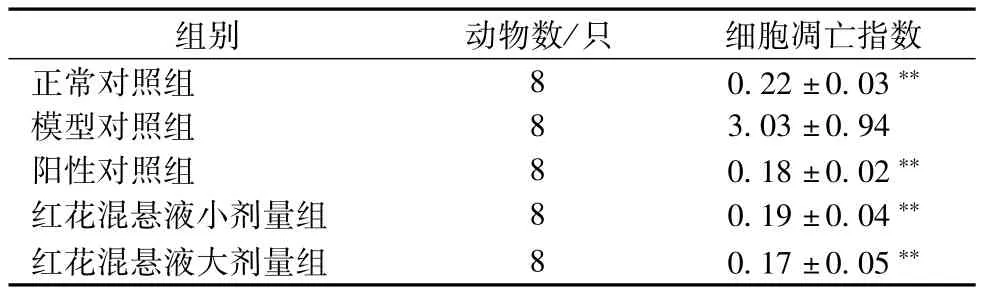
表3 红花混悬液对D-GalN诱导急性肝损伤细胞凋亡的影响(±s,n=8)
注:与模型对照组比较,**P<0.01
组别 动物数/只 细胞凋亡指数正常对照组 8 0.22±0.03**模型对照组 8 3.03±0.94阳性对照组 8 0.18±0.02**红花混悬液小剂量组 8 0.19±0.04**红花混悬液大剂量组 8 0.17±0.05**
4 讨论
蒙医学是以三根学说(赫依、希拉、巴达干,近似中医的气、热、寒)解释机体生理和病理现象,而蒙药是蒙医防治疾病的有力武器。大部分蒙药材来源与中药材相同。蒙药主要以蒙医基础理论和蒙药药性理论为指导,在加工制作和用法上具备了蒙药特色。即蒙药以蒙药的十七种效能来补偏救弊,调整机体内部的“三根”的偏盛和偏衰,可达到防病、治病和健身的目的。红花虽然是中蒙药通用的药材,但在蒙药药性理论和蒙医基础理论的指导下,在肝脏疾病的治疗中发挥着重要的作用。因而被誉为“肝脏之好”[3]的美名。大量的临床资料也均证实,红花为君药的蒙药复方制剂是肝脏的急性和慢性疾病的首选药物。
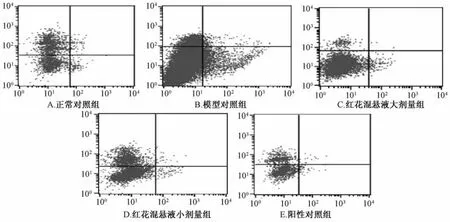
图2 流式细胞仪检测细胞凋亡情况
肝细胞的异常凋亡在急、慢性肝损伤的发病机制中起着重要作用[4-5],从肝细胞异常凋亡的角度观察保肝药物的作用及机制具有重要意义。在某些类型肝病中,肝细胞凋亡实际上引起了炎症和坏死,肝脏中的嗜中性白细胞炎症完全依赖于细胞凋亡的这一始发事件。因此阻止细胞凋亡可能是一个新的控制炎症的治疗途径。
本实验研究表明,红花混悬液大、小剂量组均明显抑制肝细胞凋亡数。说明抑制凋亡是红花抗肝损伤、保护肝细胞的作用机理之一。本实验可为红花保肝作用的进一步系统研究提供科学依据。
红花性凉、味微苦、具有重、钝、柔、和、固等性能;具有凉血、清肝等功效。蒙医临床资料显示,在蒙医理论指导下的红花可用于防治多种因素导致的肝脏疾病并效果较突出。
肝细胞的损伤是一种由多因素介导的复杂的生物学过程,损伤的结果是肝细胞可能发生凋亡或坏死[6-8]。细胞凋亡是细胞死亡的形式之一,亦称程序性死亡[9],由于其特殊的生物学意义而逐步成为一个新的研究热点。近年来的研究表明,细胞凋亡在肝细胞损伤中发挥着重要的作用。关于肝细胞死亡机制的研究将对肝脏疾病的预防和治疗起重要的作用[10]。D-氨基半乳糖模型机制可耗竭肝细胞内三磷酸尿嘧啶核苷,抑制INA合成[11-13]而达到肝细胞凋亡,近几年的研究认为D-氨基半乳糖模型机制还与肝细胞膜的
完整性、过氧化损伤、谷胱甘肽耗竭[14]及肿瘤坏死因子[15]有关。机体存在阻止过氧化作用的防御体系,GSH-Px是细胞内抗脂质过氧化作用的酶性保护系统的主要成分,可催化过氧化脂质(LPO)分解生成相应的醇,防止LPO均裂和引发脂质过氧化作用的链式支链反应,减少LPO的生成,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。本实验结果表明,造模剂D-G1aN可致大鼠肝细胞大量凋亡、同时显著降低其GSH-Px水平。红花混悬液大小剂量组均明显抑制肝细胞凋亡,并明显提高了血清和肝组织GSH-Px的含有量。因此,认为D-G1aN致急性肝损伤的机制可能通过对肝细胞的过氧化损伤而引发了肝细胞的大量凋亡。而通过恢复GSH-Px抗氧化功能其保护肝细胞膜结构和功能完整性为红花抑制肝细胞凋亡而起到保肝作用的目的。
参考文献:
[1] 王秀梅,韩晓静,白梅荣,等.HPLC法测定红花地上部分羟基红花黄色素A和木犀草素的含量[J].中国民族民间医药,2014,8(2):29-30.
[2] 国家中医药管理局《中华本草》编委会.中华本草:蒙药卷[M].上海:上海科学技术出版社,2004:9.
[3] 韩晓静,双 荣,白梅荣,等.红花茎醇提物的保肝作用机理研究[J].内蒙古中医药,2014,4(2):101-102.
[4] 姜泽群,姚志华,邓正亭,等.凉血化瘀方拮抗内质网应激引起的L02肝细胞凋亡作用及机制研究[J].中国中药杂志,2013,38(20):3544-3548.
[5] 王凤林,杨宏志,李杨湄,等.基于茵陈蒿汤及大承气汤的清下法防治急性内毒素性肝损伤大鼠肝细胞凋亡的机制研究[J].中药材,2014,37(5):848-852.
[6] 张虹莉,胡少青,伍义行,等.苦参素对D-氨基半乳糖苷诱导的肝细胞凋亡的干预研究[J].安徽农业科学,2013,41(14):6130-6133.
[7] 张向颖,郭媛媛,张 莉,等.氧化应激介导糖原合成酶激酶-3β促进肝细胞凋亡[J].细胞与分子免疫学杂志,2015,31(1):27-31.
[8] Liu LM,Zhang JX,Luo J,etal.A ro1e of ce11apoptosis in 1ipopo1ysaccharide(LPS)-induced non1etha1 1iver injury in D-ga1actosamine(D-Ga1N)-sensitized rats[J].Dig Dis Sci,2008,53(5):1316-1324.
[9] 李素婷,吴淑彦,杜 超,等.山楂叶总黄酮对酒精性肝损伤小鼠肝细胞凋亡的影响[J].中国老年学杂志,2015,35(7):1889-1891.
[10] 刘 浩,郑 勇,陈卫刚,等.内源性硫化氢对肝硬化大鼠肝细胞凋亡的影响[J].世界华人消化杂志,2012,20 (8):670-674.
[11] Watanabe T,Jono H,Han J,et al.Synergistic activation of NF-kappaB by nontypeab1e Haemophilus influenzae and tumor necrosis factor a1pha[J].Proc Natl Acad Sci USA,2004,101 (10):3563-3568.
[12] 李达民,关养时.梗阻性黄疸致肝细胞凋亡的研究进展[J].中国普通外科杂志,2014,32(7):967-971.
[13] Kepp1er D,Fröh1ich J,Ieutter W,et al.Changes in uridine nuc1eotides during 1iver perfusion with D-ga1actosamine[J]. FEBS Lett,1969,4(4):278-280.
[14] 阎 宁,许瑞龄.马来酸二乙酯对半乳糖胺脂多糖致小鼠急性肝损伤发生中核转录因子表达的影响[J].山西医药杂志,2003,32(6):538-539.
[15] Stach1ewitz I F,Seabra V,Bradford B,etal.G1ycine and uridine prevent D-ga1actosamine hepatotoxicity in the rat:ro1e of Kupffer ce11s[J].Hepatolotgy,1999,29(2):737-745.
*通信作者:白梅荣(1972—),女(蒙古族),教授,从事蒙药药理毒理学研究。Te1:15804758404
作者简介:娜仁满都拉(1990—),女(蒙古族),从事蒙药物质基础研究。E-mai1:15247533325@163.com
基金项目:通辽市科技合作项目(SXYB2012030);内蒙古民族大学校级研究生资助项目(NMDSS1436)
收稿日期:2015-03-17
doi:10.3969/j.issn.1001-1528.2016.03.037
中图分类号:I285.5
文献标志码:B
文章编号:1001-1528(2016)03-0655-04
