脊柱转移瘤患者的预后因素分析
2016-04-05曾思翔郭池华张党锋支力强
曾思翔,郭池华,张党锋,支力强,马 巍
(西安交通大学第一附属医院骨科,陕西西安 710061)
脊柱转移瘤患者的预后因素分析
曾思翔,郭池华,张党锋,支力强,马 巍
(西安交通大学第一附属医院骨科,陕西西安 710061)
目的 研究脊柱转移瘤的预后因素,试图找出影响患者预后的独立因素。方法 对2009年1月1日至2014年9月31日收治的脊柱转移瘤患者进行随访,共105名患者获得满意随访,随访时间5~56月。采用Kaplan-Meier生存曲线,行单因素分析,再将结果中与患者预后相关的因素纳入COX比例风险回归模型中,行多因素分析。运用SPSS20.0软件进行统计学分析,以α=0.05为检验水准。结果 单因素分析结果显示,原发肿瘤类型、累及椎体数目、脊柱外骨转移、内脏转移、治疗前一般状况(Karnofsky评分)、神经功能状态(Frankel分级)、行走功能、大小便功能等与患者的预后相关;多因素分析显示,原发肿瘤类型、内脏转移、治疗前Karnofsky评分及行走状态是影响患者预后的独立因素。结论 原发肿瘤类型、内脏转移、治疗前Karnofsky评分及行走状态是影响脊柱转移瘤患者预后的独立危险因素。
脊柱转移瘤;预后因素;生存分析;Kaplan-Meier曲线;COX比例风险回归模型
脊柱肿瘤中绝大多数都是转移瘤[1],同时脊柱也是骨转移瘤最好发的部位[2]。最容易产生脊柱转移的恶性肿瘤为乳腺癌、肺癌、前列腺癌、肾癌、胃肠道肿瘤和甲状腺癌。最易出现的部位是胸椎,其次为腰椎和颈椎[3]。脊柱转移瘤已成为严重威胁患者生命的一类疾病[4]。此类患者多属恶性肿瘤晚期,生活质量差且生存时间短,大多数患者只能存活数月至数年[5]。近年来治疗手段逐渐多样化,如何选择确切治疗方式则成为了临床焦点问题之一。随着外科技术及理念的快速发展,手术已成为重要的治疗方式之一,但也只能适用于一部分患者[6]。对于预期寿命较短的患者应尽量选择保守或创伤较小的治疗手段。而对于一般状况较好、预期寿命较长的患者,其治疗目标为控制病灶、减轻疼痛和恢复神经功能,手术则是必要的。由此可见,准确判断患者的预后是选择治疗方式的关键。本研究将在已有的研究基础上,选取11项可能影响患者预后的因素,应用Kaplan-Meier生存曲线和COX比例风险回归模型,确定影响患者预后的独立因素。
1 资料与方法
1.1 纳入及排除标准
纳入标准:2009年1月1日至2014年9月31日收治于西安交通大学第一附属医院骨科的患者;术后病理结果证实为脊柱转移瘤或虽行保守治疗但病理活检及原发肿瘤均明确的患者;有完整住院治疗资料并获得随访者。排除标准:出院后死于如车祸、灾难等其他意外因素的患者;单纯行活检术且并未接受规范治疗的患者;住院期间转出至其他科室治疗的患者;自动放弃治疗的患者。
1.2 临床资料
本次研究中共纳入了105名患者,男性57名,女性48名。年龄最小为34岁,最大为85岁,平均年龄(61.3±11.4)岁,中位年龄66岁。依据Tomita评分原则,原发肿瘤生长快速的71例,生长速度中等的19例,生长缓慢的15例;原发灶由多至少,前6位依次是肺癌、原发灶不明、肝癌、肾癌、前列腺癌和乳腺癌。
40例为单发椎体转移,65例为多发椎体转移。58例伴有脊柱外骨转移。18例伴有内脏转移,内脏转移由头颅、胸部、腹部CT扫描、腹部彩色多普勒超声等检查结果确定。入院时患者的一般状况(Karnofsky评分)为:41例较差(10~40分),57例中等(50~70分),7例较好(80~100分),平均为(51.45±14.68)分。
100例有不同程度的腰背部疼痛,其中71例处于难以忍受的状态。77例存在不同程度的神经功能障碍。46例无法行走或者行走困难,行走功能障碍多是由于处于完全瘫痪、双下肢肌力低于Ⅳ级、腰背部疼痛及双下肢放射痛难以忍受等因素引起,其中13例为完全瘫痪。27例存在大小便功能障碍。
所有患者中81例接受手术治疗,24例接受保守治疗,大多以缓解疼痛、恢复或保留神经功能、加强脊柱稳定性及局部控制肿瘤病灶等为目的。手术治疗主要以姑息性病灶切除椎板减压术和椎体后凸成形术为主;保守治疗则以激素、神经营养药、脱水剂、二磷酸盐、非甾体类镇痛药等为主要用药。
1.3 随访内容及方式
所有患者均以门诊及电话相结合的方式进行随访,采用问卷方式获取相应资料。术后1、3、6月各进行1次随访,随后每隔3月电话随访1次。以患者入院确诊为起始时间,患者死亡或末次随访为终止时间,以月为单位。随访时间为5~56月,末次随访时间为2015年3月31日。
1.4 统计方法
采用Kaplan-Meier法,对脊柱转移瘤患者的预后行单因素分析,复习文献资料后选取性别、年龄、原发肿瘤类型(根据Tomita评分分为缓慢、中等及快速生长3类)、累及椎体的数目、有无脊柱外骨转移、有无内脏转移、治疗前一般状况(Karnofsky评分)、疼痛级别(McAfee疼痛分级)、神经功能状态(Frankel神经功能分级)、行走功能、大小便功能等11个因素,利用Log-Rank对生存曲线进行显著性检验并计算各不同影响因素下患者的平均生存时间及中位生存时间;将单因素分析结果中与患者预后相关的因素纳入COX比例风险回归模型中,采用逐步回归法行多因素分析,计算各影响因素的相对危险度即风险比及其95%置信区间。运用SPSS20.0软件进行统计学分析,以α=0.05为检验水准。
2 结 果
2.1 单因素分析
截至随访结束时,本组患者中死亡82例,平均生存时间为(10.43±8.89)月,中位生存时间为8月。采用Kaplan-Meier法,绘制各影响因素下不同分组患者的Kaplan-Meier生存曲线,利用Log-Rank检验检测其显著性。未见显著差异的因素为:性别(χ2=0.241,P=0.623)、年龄(χ2=0.602,P=0.438)和疼痛分级(χ2=5.182,P=0.269)。
与患者预后有关的因素为:原发肿瘤类型(χ2=20.909,P<0.001)、累及椎体数目(χ2=6.690,P=0.01)、脊柱外骨转移(χ2=5.897,P=0.015)、内脏转移(χ2=11.040,P=0.001)、Karnofsky评分(χ2=27.303,P<0.001)、Frankel分级(χ2=13.584,P=0.001)、行走功能(χ2=12.999,P<0.001)、大小便功能(χ2=6.538,P=0.011)。其中不同原发肿瘤、有无内脏转移、不同Karnofsky评分及行走功能障碍等的患者Kaplan-Meier生存曲线见图1。
2.2 多因素分析
根据上述分析,得出8个与患者预后有关的危险因素,即原发肿瘤类型、累及椎体数目、脊柱外骨转移、内脏转移、Karnofsky评分、Frankel分级、行走状态、大小便功能。随后,采用COX比例风险回归模型检验这些因素与患者生存时间的关系,方法为逐步回归法。COX模型分析结果及不同影响因素下患者的平均生存时间及半年、1年生存率分析,影响脊柱转移瘤患者预后的独立因素为原发肿瘤类型、有无内脏转移、治疗前Karnofsky评分及行走状态(表1)。
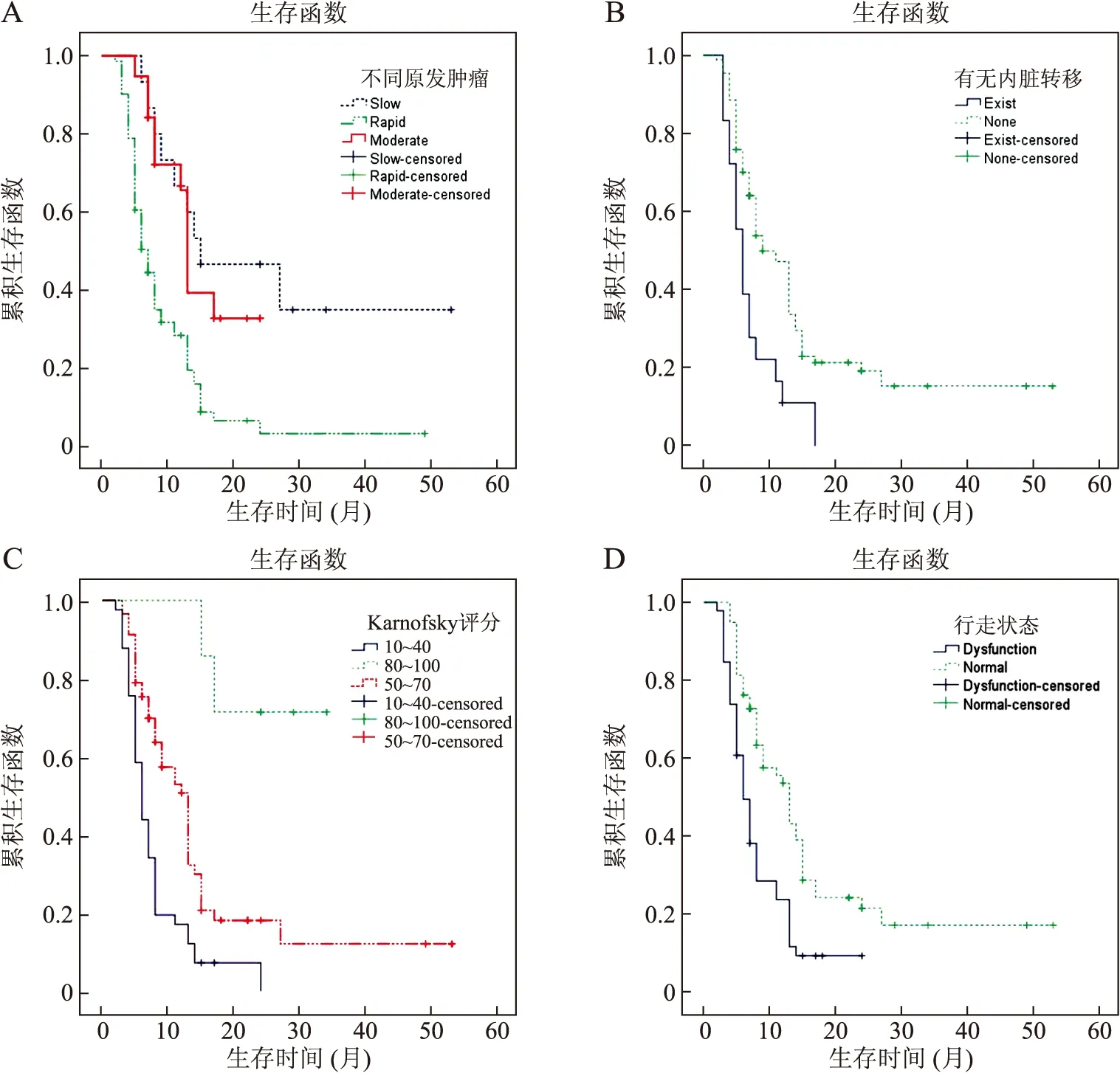
图1 脊柱转移瘤患者部分依据Kaplan-Meierl(K-M)生存曲线的单因素分析结果
Fig.1 Part of univariate analysis according to Kaplan-Meier survival curves in patients with spinal metastases
A:不同原发肿瘤;B:有无内脏转移;C:Karnofsky评分;D:行走状态。
表1 COX模型多因素分析脊柱转移瘤患者的预后因素
Tab.1 Multivariate analysis of prognostic factors in patients with spinal metastases according to COX model
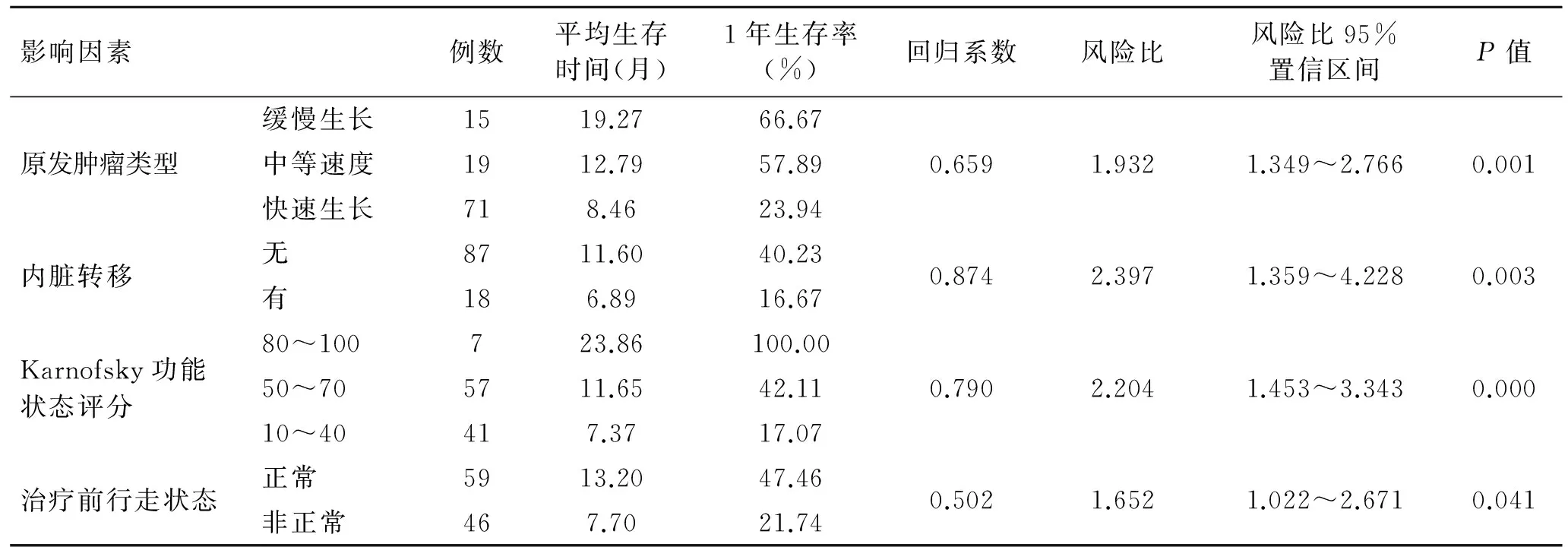
影响因素例数平均生存时间(月)1年生存率(%)回归系数风险比风险比95%置信区间P值原发肿瘤类型缓慢生长1519.2766.67中等速度1912.7957.89快速生长718.4623.940.6591.9321.349~2.7660.001内脏转移无8711.6040.23有186.8916.670.8742.3971.359~4.2280.003Karnofsky功能状态评分80~100723.86100.0050~705711.6542.1110~40417.3717.070.7902.2041.453~3.3430.000治疗前行走状态正常5913.2047.46非正常467.7021.740.5021.6521.022~2.6710.041
3 讨 论
预期生存时间是制定合理治疗方式的重要参考。近年来已出现很多旨在指导治疗策略的预后评分,目前国际上认可度较高的是Tokuhashi评分和Tomita评分。最初的Tokuhashi评分包括6项指标:Karnofsky评分、脊柱外骨转移、椎体转移数、内脏转移、原发肿瘤和脊髓功能障碍。总分为12分,评分越高,预后越好。为了提高其精确性,TOKUHASHI等[7]于2005年提出了修正评分,在新系统中,总分升至15分。Tomita评分[8]包括3项指标:原发肿瘤、重要脏器转移和骨转移数量,总分为10分,评分越高预后越差,3项参数的评分都是加权分数,他们认为原发肿瘤的组织学类型与患者的预后相关性较高,因此对其有更高的评分比重。虽然已有很多研究表明这两个预后评分具有显著效果[9-11],但也存在一些不足,例如Tokuhashi评分评价项目多,且未经加权处理,在评价急性患者时可能存在一些偏倚。
除了TOKUHASHI和TOMITA外,其他学者也提出了各自的见解。SWITLYK等[12]认为原发肿瘤类型、Karnofsky评分、椎体转移数、白蛋白水平以及镇痛药的使用等与患者的预后相关。BOLLEN等[13]通过大样本分析认为原发肿瘤类型、Karnofsky评分、脊柱外转移、椎体转移灶数目及节段、神经功能等与患者的预后相关。LEE等[14]对200例接受手术和377例接受保守治疗的患者分别做了回顾性分析,认为影响手术组患者的预后因素是性别、辅助治疗方式、术后生存质量;而保守治疗组的影响因素是临床症状、重要内脏转移和原发肿瘤类型。KATAOKA等[15]认为原发肿瘤类型、重要内脏转移、脊柱转移瘤发病前未患病时间、脊柱外骨转移等是预后的相关因素,其中原发肿瘤类型最重要,预后因素可能会因为不同的原发肿瘤而相异。MOON等[16]认为术前ECOG评分和Tomita评分是患者术后生存时间的相关因素,而影响患者术后行走功能的因素是术前ECOG评分和术前行走功能。RADES等[5,17-22]近年来做了一系列临床研究,针对不同原发肿瘤提出了多种预后评分系统,起初他们认为与患者预后相关的因素包括Karnofsky评分、行走状态、其他骨转移、内脏转移、诊断至首次放疗的时间间隔、发展至行动困难的时间等。后来,通过一项关于高龄患者的临床研究,他们又将年龄和原发肿瘤类型加入到了相关因素中,评分中的项目也相应地升至9个[22]。
根据本研究多因素分析中的回归系数及风险比分析结果,影响患者预后的独立危险因素有原发肿瘤类型、有无内脏转移、治疗前Karnofsky评分及行走状态。原发肿瘤的恶性度每升高1个等级,确诊后死亡风险将增大1.93倍,Karnofsky评分每下降1个等级,死亡风险增大2.2倍,有内脏转移的患者死亡风险为无内脏转移者的2.39倍,行走状态出现障碍者的死亡风险率为正常者的1.65倍。因此,原发肿瘤恶性程度较低(如甲状腺癌、前列腺癌或乳腺癌),没有其他内脏转移、Karnofsky评分较高且行走功能未受影响患者的预后较好。如条件允许,对此类患者应施行更积极的治疗手段,以期获得更长的生存时间。
脊柱转移瘤的预后评分已成为研究热点之一。由于属于单中心回顾性研究,病例数相对较少并且缺乏对照组,本次研究可能会存在一些偏倚,还有很多不足和待改进的地方。进一步综合各种预后相关因素和治疗方式后,设计出更加完善的研究方法,进行大样本、多中心的前瞻性研究,并最终制定出适合中国患者的预后评分,造福广大患者。
[1] CHI JH, CACHOLA K, PARSA AT. Genetics and molecular biology of intramedullary spinal cord tumors[J]. Neurosurg Clin N Am, 2006, 17(1):1-5.
[2] LAUFER I, SCIUBBA DM, MADERA M, et al. Surgical management of metastatic spinal tumors[J]. Cancer Control, 2012, 19(2):122-128.
[3] MOULDING HD, BILSKY MH. Metastases to the craniovertebral junction[J]. Neurosurgery, 2010, 66(3):A113-A118.
[4] QURESHI A, SHAMS U, AKHTER A, et al. Metastatic bone disease as seen in our clinical practice-experience at a tertiary care cancer center in Pakistan[J]. Asian Pac J Cancer Prev, 2012, 13(9):4369-4371.
[5] RADES D, HUEPPE M, SCHILD SE. A score to identify patients with metastatic spinal cord compression who may be candidates for best supportive care[J]. Cancer, 2013, 4:897-903.
[6] ZAIKOVA O, FOSSA SD, BRULAND OS, et al. Radiotherapy or surgery for spine metastases?[J]. Acta Orthop, 2011, 82:365-371.
[7] TOKUHASHI Y, MATSUZAKI H, ODA H, et al. A revised scoring system for preoperative evaluation of metastatic spine tumor prognosis[J]. Spine, 2005, 30(19):2186-2191.
[8] TOMITA K, KAWAHARA N, KOBAYASHI T, et al. Surgical strategy for spinal metastases[J]. Spine, 2001, 26(3):298-306.
[9] KIM J, LEE SH, PARK SJ, et al. Analysis of predictive role and new proposal for surgical strategies based on the modified Tomita and Tokuhashi scoring systems for spinal metastasis[J].World J Surq Oncol, 2014, 12(8):777-777.
[10] WANG M, BUNGER CE, LI H, et al. Predictive value of Tokuhashi scoring systems in spinal metastases, focusing on various primary tumor groups: evaluation of 448 patients in the Aarhus spinal metastases database[J]. Spine, 2012, 37(7):573-582.
[11] PUTZ C, WIEDENHOFER B, GERNER HJ, et al. Tokuhashi prognosis score: an important tool in prediction of the neurological outcome in metastatic spinal cord compression: a retrospective clinical study[J]. Spine, 2008, 33(24):2669- 2674.
[12] SWITLYK MD, KONQSQAARD U, SKJELDAL S, et al. Prognostic factors in patients with symptomatic spinal metastases and normal neurological function [J]. Clin Oncol, 2015, 27(4):213-221.
[13] BOLLEN L, VAN DER LINDEN YM, PONDAAQ W, et al. Prognostic factors associated with survival in patients with symptomatic spinal bone metastases: a retrospective cohort study of 1 043 patients[J]. Neuro Oncol, 2014, 16(7): 991-998.
[14] LEE BH, KIM TH, CHONG HS, et al. Prognostic factor analysis in patients with metastatic spine disease depending on surgery and conservative treatment: review of 577 cases[J]. Ann Surg Oncol, 2013, 20(1):40-46.
[15] KATAOKA M, KUNISADA T, TANAKA M, et al. Statistical analysis of prognostic factors for survival in patients with spinal metastasis[J]. Acta Med Okayama, 2012, 66(3):213-219.
[16] MOON KY, CHUNG CK, JAHNQ TA, et al. Postoperative survival and ambulatory outcome in metastatic spinal tumors: prognostic factor analysis[J]. J Korean Neurosurg Soc, 2011, 50(3):216-223.
[17] RADES D, WEBER A, KARSTENS JH, et al. Number of extraspinal organs with metastases: a prognostic of survival in patients with metastatic spinal cord compression(MSCC) from non-small cell lung cancer(NSCLC)[J]. Anticancer Res, 2014, 34(5):2503-2507.
[18] RADES D, DOUGLAS S, VENINGA T, et al. A validated survival score for patients with metastatic spinal cord compression from non-small cell lung cancer[J]. BMC Cancer, 2012, 12:302-308.
[19] DOUGLAS S, SCHILD SE, RADES D. A new score predicting the survival of patients with spinal cord compression from myeloma [J]. BMC Cancer, 2012, 12:425.
[20] RADES D, WEBER A, BARTSCHT T, et al. A new prognostic factor for the survival of patients with renal cell carcinoma developing metastatic spinal cord compression[J]. Strahlenther Onkol, 2014, 190:667-670.
[21] RADES D, DOUGLAS S, VENINGA T, et al. A survival score for patients with metastatic spinal cord compression from prostate cancer [J]. Strahlenther Onkol, 2012, 188:802-806.
[22] RADES D, EVERS JN, BAJROVIC A, et al. Metastatic spinal cord compression: a validated survival score for elderly patients[J]. Strahlenther Onkol, 2014, 190(10):919-924.
(编辑 国 荣)
Analysis of prognostic factors in patients with spinal metastases
ZENG Si-xiang, GUO Chi-hua, ZHANG Dang-feng, ZHI Li-qiang, MA Wei
(Department of Orthopedics, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
Objective To evaluate the prognostic factors in patients with spinal metastases to identify the independent factors affecting prognosis. Methods We analyzed 105 patients with spinal metastases, who were treated from January 2009 to September 2014 and followed up for 5 to 56 months. To study the relationship between prognostic factors and survival time, Kaplan-Meier survival curves and COX model were used. Statistical analysis was performed with statistical software (IBM SPSS ver. 20) with α=0.05 as the standard. Results The univariate analysis according to Kaplan-Meier survival curves showed that the type of primary tumor, the number of vertebral metastases, the number of extraspinal bone metastases, visceral metastases, general conditions (according to KPS), neurological status, ambulatory status, and bowel and bladder functions were related to the patients’ survival time. The multivariate analysis according to the COX model showed that the type of primary tumor, visceral metastases, KPS before treatment and ambulatory status were independent prognostic factors. Conclusion The type of primary tumor, visceral metastases, KPS before treatment and ambulatory status are the independent prognostic factors in patients with spinal metastases.
spinal metastasis; prognostic factor; survival analysis; Kaplan-Meier survival curve; Cox proportional hazards model
2015-04-28
2015-08-23
马巍. E-mail:mawei60@126.com
R681.5
A
10.7652/jdyxb201601030
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151208.1743.012.html(2015-12-08)
