水通道蛋白-1在小鼠肾小管发育中的表达
2016-04-05薄双玲阎丽菁马太芳
薄双玲,田 鹤,阎丽菁,赵 宽,马太芳
(1. 山西医科大学汾阳学院组织学与胚胎学教研室,山西汾阳 032200;2. 辽宁医学院组织学与胚胎学教研室,辽宁锦州 121001)
水通道蛋白-1在小鼠肾小管发育中的表达
薄双玲1,田 鹤2,阎丽菁2,赵 宽1,马太芳1
(1. 山西医科大学汾阳学院组织学与胚胎学教研室,山西汾阳 032200;2. 辽宁医学院组织学与胚胎学教研室,辽宁锦州 121001)
目的 观察水通道蛋白1(aquaporin-1, AQP-1)在小鼠肾小管发育过程中的时空性表达,探讨AQP-1与肾小管发育的关系。方法 采用免疫组织化学技术结合体视学方法和免疫印迹法,测定不同胚龄(E)12、14、17、18 d 及生后日龄(P)1、3、7、14、24、40、70 d小鼠肾小管内AQP-1的表达及其含量变化。结果 免疫组织化学结果显示AQP-1在E14 d髓质部位发育中的小管即有表达,之后主要表达在近端小管、髓袢降支细段的管腔膜和侧基底膜,生肾区则无阳性表达。图像分析和体视学测量显示随着胚龄的增加,AQP-1在肾小管表达逐渐增强后趋于稳定;免疫印迹法显示AQP-1在肾脏的表达量在P 7 d达到高峰后趋于稳定。结论 AQP-1在肾小管的发育过程中存在时空性表达,对肾小管的发育和成熟起关键作用。
水通道蛋白-1;肾;发育;小鼠
水通道蛋白-1(aquaporin-1, AQP-1)属于水通道蛋白家族,广泛分布于机体组织细胞中,尤其在与体液分泌和吸收有关的上皮细胞和内皮细胞含量丰富,参与水的吸收、分泌以及细胞内外体液平衡的调节[1]。已有研究表明,AQP-1在成年大鼠肾脏主要定位于近端小管的管腔膜和侧基底膜,以及髓袢降支细段和直小血管袢,在尿液的浓缩中起重要作用[2]。
近年来,国内外关于AQP-1的研究主要集中在它与肾积水、多囊肾、肾脏肿瘤等疾病之间的关系[3-4]。关于AQP-1与肾发育方面的研究则少见报道。本研究采用免疫组织化学技术结合体视学方法及免疫印迹法检测AQP-1在小鼠肾小管发育过程中的时空表达及其含量变化,以探讨AQP-1与肾小管发育的关系。
1 材料与方法
1.1 取材及标本制备
取成年健康昆明小白鼠,按雌雄1∶1同窝饲养,每日早晚8∶00时查看雌鼠妊娠情况,观察到阴道栓脱落的最早时间计为胚龄(embryonic days, E)0 d。孕鼠分笼饲养2周开始每日早晚8∶00时各查看1次仔鼠出生情况,以仔鼠出生的最早时间计为生后(postnatal, P)0 d。孕鼠分为11组,每组4只,每只孕鼠取2只胎鼠或仔鼠(即每组8只胎鼠或仔鼠),分别取胚龄12、14、17、18 d胎鼠和生后1、3、7、14、24、40、70 d仔鼠肾。孕鼠经100 g/L水合氯醛麻醉,剖腹取出胎鼠,胚龄12 d全胚固定,胚龄14、17、18 d取其左肾固定。仔鼠麻醉后,于腹后壁取出左肾,用排刀法沿横轴将肾切开,入40 g/L多聚甲醛固定,梯度乙醇脱水,香柏油透明,石蜡定向包埋,做厚4 μm连续切片。右肾入丙酮迅速冷冻,-80 ℃保存,以备免疫印迹法测定用。
1.2 试剂
兔抗小鼠AQP-1多克隆抗体购自Santa公司;Post Vaccination(PV)兔试剂盒购自中杉金桥生物技术有限公司;蛋白提取试剂盒、Polyvinylidene Fluoride(PVDF)膜、胎牛血清、Sodium Dodecyl Sulfate(SDS)等免疫印迹试剂均购自Sigma公司。
1.3 免疫组织化学染色、灰度评分及体视学测定
石蜡切片脱蜡至水,经微波修复10 min后室温冷却,加30 mL/L H2O2室温孵育10 min去除过氧化物酶,羊血清封闭15 min,滴加AQP-1一抗(浓度1∶200)4 ℃过夜,滴加生物素标记的羊抗兔二抗室温孵育15 min,链霉菌抗生物素蛋白-过氧化酶室温15 min,DAB显色2 min。脱水、透明、封固,光镜下观察。用PBS代替一抗作阴性对照。
AQP-1免疫组织化学染色结果应用 CIAS-1000细胞图像分析系统进行分析。每个标本间隔选取5张切片,每张切片按“S”形随机选取5个阳性视野,在400倍光镜下,以切片背景色作为参照进行分析。以灰度值来表示AQP-1的表达量,灰度值越大,AQP-1表达量越少。
每个标本等间隔选取5张切片,每张切片在油镜下按“S”形选取视野,采用方格测试系统,交点计数法分别测算肾小管阳性反应表达的面密度值,公式为:Sv=2Ix/Lc(Lc=ΣPc·a),式中Ix为阳性表达的胞膜与测试方格的交点数,Pc为测试系统落在参照系(肾小管)的点数,a为方格的两点间距离,相当于实际长度的0.1 mm。
1.4 免疫印迹法
各组小鼠取冷冻待用的右肾,加入3倍体积的裂解液,碾磨后0 ℃静置2 h,离心收集上清,用考马斯亮蓝法测定总蛋白含量。每个样品取25 μg湿转至PVDF膜上。100 g/L脱脂奶粉封闭,AQP-1抗体(稀释度1∶200)4 ℃孵育过夜,碱性磷酸酶标记的二抗(稀释度1∶600)室温孵育1 h,BCIP/NBT试剂显色,扫描电泳条带,用Gene Tools软件分析电泳条带吸光度值。
1.5 统计学处理

2 结 果
2.1 免疫组织化学结果
免疫组织化学显示阳性反应物为棕黄色。AQP-1在E12 d胎鼠肾中未见阳性表达,E14 d的胎鼠肾髓质部位可见大量的间质和发育中的肾小管,部分肾小管管腔膜和侧基底膜可见阳性表达,而生肾区则无表达(图1A)。E17 d出现髓质,可见近直小管管腔膜和侧基底膜均有较强阳性表达,而皮质中未发育完善的近曲小管,管腔不明显,阳性表达弥散于胞质中(图1B)。E18 d出现明显的髓放线,但髓放线中未见明显的阳性表达,髓质中可见近直小管、髓袢降支细段强阳性表达,近曲小管胞质中阳性反应物也逐渐边集在管腔膜和侧基底膜(图1C)。P1 d、P3 d出现肾乳头,乳头处髓袢降支细段、髓放线中近直小管以及皮质中近曲小管均见强阳性表达(图1D)。从P7 d至P70 d,生肾区消失,AQP-1在肾脏中表达最多,主要定位在近端小管,髓袢降支细段以及直小血管降支(图1E、1F)。
2.2 免疫组织化学染色灰度评分结果
随着肾脏的发育,AQP-1表达的灰度值在肾小管为逐渐减小,P7d后趋于平稳(图2)。各组数值与背景(230.475±3.471)比较均有显著性差异(P<0.05)。这说明AQP-1在肾小管的表达随胚日龄的增加逐渐增强后趋于稳定。
2.3 体视学测量结果
随着胚日龄的增加,AQP-1在肾小管的面密度值逐渐增加,P24 d后趋于稳定,经统计学分析,与前一组数值比较有显著性差异(P<0.05,图3)。
2.4 免疫印迹法测定结果
应用Gene Tools软件对AQP-1蛋白表达电泳条带的分析显示,随着肾的发育AQP-1在小鼠肾组织的吸光度值逐渐增加,P7d达到顶峰后趋于稳定。经统计学分析,各组间数值的差异具有统计学意义,P<0.05(图4)。
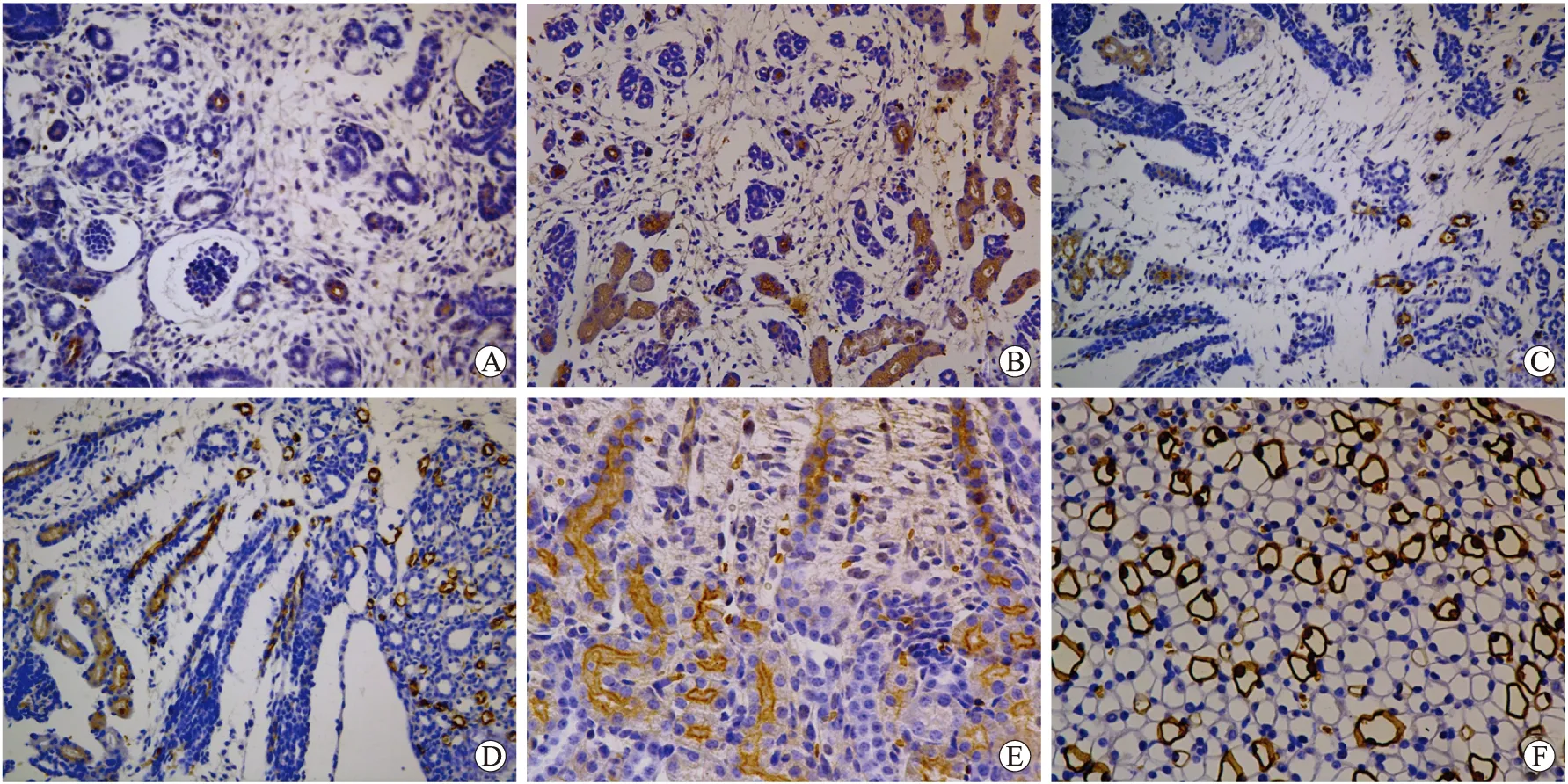
图1 AQP-1在小鼠不同发育阶段肾小管的表达
Fig.1 Immunohistochemical staining showed AQP-1 expression in the developing renal tubules
A:E14 d, ×200;B:E17 d, ×200;C:E18 d, ×200;D:P1 d, ×200;E:P7 d, ×400;F:P70 d, ×400。

图2 小鼠不同发育阶段AQP-1在肾小管表达的灰度值
Fig.2 Gray scale of AQP-1 in the developing renal tubules
与前一组比较,*P<0.05,n=200。
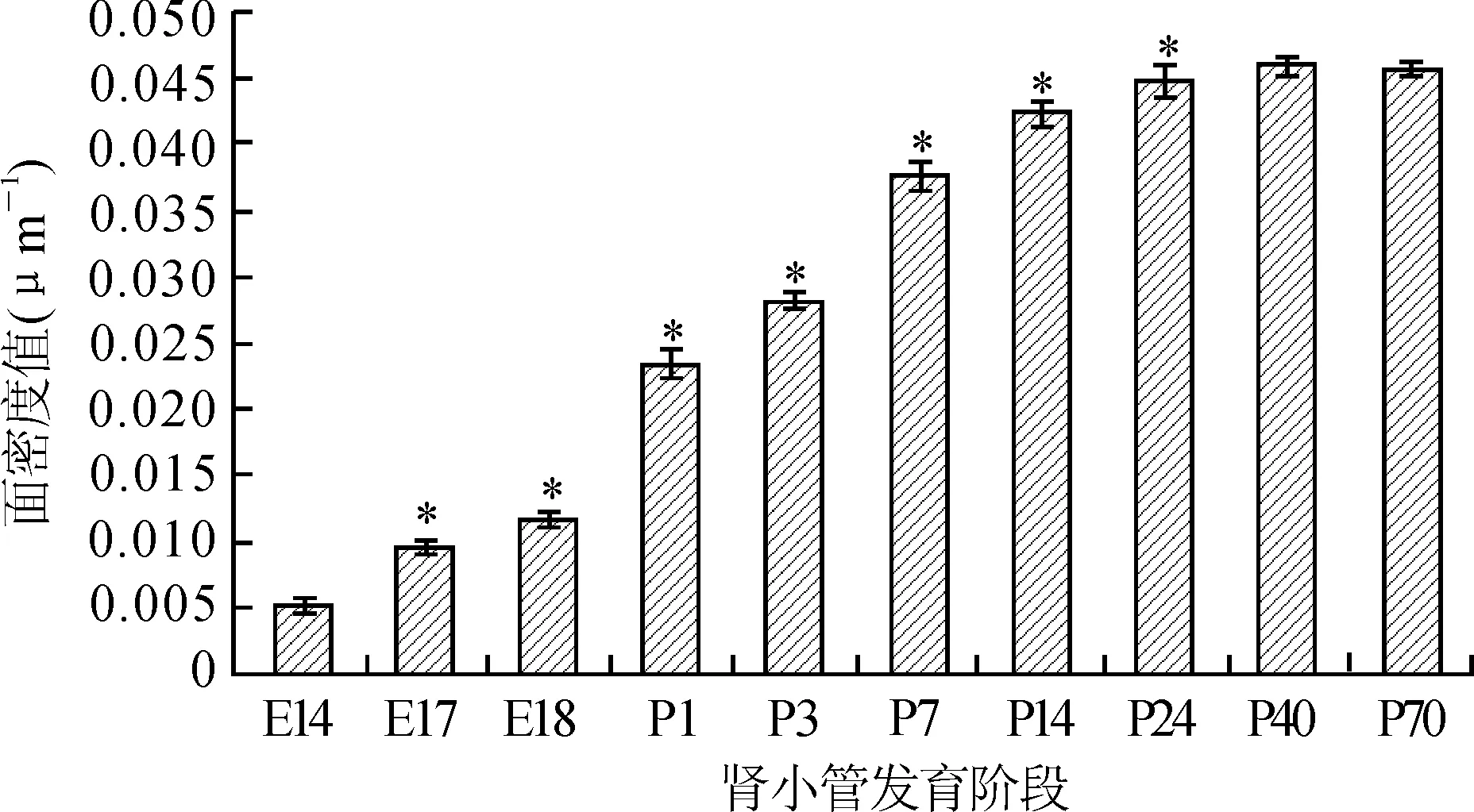
图3 小鼠发育各阶段肾小管AQP-1阳性表达的面密度值(μm-1)
Fig.3 Surface area density of AQP-1 in all stages of renal tubules (μm-1)
与前一组比较,*P<0.05,n=200。

图4 小鼠发育过程中肾内 AQP-1 表达的免疫印迹结果
Fig.4 Expression of AQP-1 in the development mouse kidney detected by immunoblot
与前一组比较,*P<0.05,n=10。A:免疫印迹蛋白条带;B:AQP-1在小鼠肾组织的A值变化。
3 讨 论
在肾脏至少有7个水通道蛋白(AQP1、2、3、4、6、7和11),它们参与了水平衡的调节,以及水平衡障碍有关疾病的病理生理过程。其中AQP-1为膜镶嵌式水分子通道蛋白,是一个存在于哺乳动物中的只传输水分子的典型水通道蛋白,有高度保守性,AQP-1在成鼠肾脏渗透性重吸收水中起着至关重要的作用[5-6]。
为探讨AQP-1与肾小管发育之间的关系,本实验通过免疫组织化学技术结合体视学方法及免疫印迹技术检测AQP-1在小鼠肾小管发育过程中的表达及其含量变化。研究结果显示,在胚胎12 d时,没有AQP-1的阳性表达,这表明在输尿管芽与生后肾组织相互诱导分支过程中没有AQP-1参与。胚胎14 d,肾脏已经形成完整的包膜,能够形成尿液,而髓质部位小管阳性表达则说明此时的肾脏已具备重吸收功能,胚胎17 d,发育中的近端小管管腔膜和侧基底膜可见其阳性表达,而皮质中发育中的近端小管表达部位弥散,散在于胞质中,这说明随着近端小管的发育,管腔出现,AQP-1逐渐从小管上皮细胞胞质表达到其管腔膜和侧基底膜,即为近端小管重吸收功能逐渐完善的过程,故推断AQP-1在肾小管功能的完善中起关键作用。胚胎18 d时可以看到明显的髓放线,但此时近直小管还处于发育早期,故髓放线中AQP-1的阳性表达不显著。P1 d到P7 d,AQP-1表达量逐渐增多,不仅表达在近曲、近直小管,而且在髓袢降支细段,直小血管降支都有强阳性表达,这与前人关于哺乳动物的研究结果是一致的[7-8],从而也说明AQP-1不仅对近端小管重吸收水分起关键作用,而且对于逆流倍增机制的形成和发挥作用也至关重要。AQP-1从胚胎14 d开始在肾小管的表达逐渐增强,随着生后7 d生肾区消失,肾小管的表达达到顶峰,而肾小管AQP-1表达的面密度值还在继续增加,生后24 d之后趋于平稳,推断这是由于在从P7d到P24 d期间,发育中的肾小管AQP-1从胞质逐渐表达到管腔膜和侧基底膜。
已有研究表明,AQP-1在肾脏的定位和水的渗透性特征是一致的,靶基因敲除小鼠近端小管水的重吸收比正常小鼠减少了8倍,从而也更直观的反映了AQP-1在水重吸收和尿生成中的作用[5]。HAN等[1]认为,AQP-1的调节大致可以分为两种方式:一种是调节AQP-1的活性,它可以磷酸化为CAMP依赖性,从而活化蛋白激酶A或C,催化水通道蛋白上的丝氨酸磷酸化,进一步增加膜对水的通透性;另一种是通过改变细胞膜上AQP-1的含量来调节跨膜水流动。依据本研究结果推测,在肾小管发育过程中,AQP-1主要是通过后者来发挥作用的,尤其是在生后7 d到生后24 d,小管上皮细胞膜上AQP-1的表达逐渐增强,肾小管的重吸收功能以及尿液浓缩的能力显著增强。所以,我们猜想AQP-1在肾胚胎发育中主要和后期肾小管重吸收功能的发育完善有关。
综上所述,在肾小管发育过程中,AQP-1的表达呈一定的时空分布性,这与肾脏在不同发育阶段对水的重吸收能力,以及髓袢对尿液的浓缩能力密切相关,有学者证实[9],生后3周的大鼠失水8 h后,其尿液最高的渗透压仅是成年大鼠50%的水平,这也说明肾脏在出生后的很长一段时间,功能才逐步完善。然而,关于这一现象的分子调节机制还有待于我们进一步研究。
[1] 程波,邹祖圣. 水通道蛋白-1的研究进展[J]. 中国眼耳鼻喉科杂志, 2007, 7(4):264-266.
[2] 王从军,王红,杨体泉,等. 水通道蛋白1在泌尿系统中表达的研究进展[J]. 实用儿科临床杂志, 2011, 26(23):1836-1839.
[3] WANG W, LI F, SUN Y, et al. Aquaporin-1 retards renal cyst development in polycystic kidney disease by inhibition of Wnt signaling[J]. FASEB J, 2015, 29(4):1551-1563.
[4] TINNING AR, JENSEN BL, SCHWEDA F, et al. The water channel aquaporin-1 contributes to renin cell recruitment during chronic stimulation of renin production[J]. Am J Physiol Renal Physiol, 2014, 307(11):1215-1226.
[5] AGARWAL SK, GUPTA A. Aquaporins: The renal water channels[J]. Indian J Nephrol, 2008, 18(3):95-100.
[6] 卫红,王贵宪,徐纪中,等. 雌、孕激素下降对大鼠肾脏组织中水通道蛋白表达的影响[J]. 郑州大学学报(医学版), 2014, 49(5):734-737.
[7] BATCHELDER CA, KEYSER JL, LEE CC, et al. Characterization of growth, glomerular number, and tubular proteins in the developing rhesus monkey kidney[J]. Anat Rec (Hoboken), 2013, 296(11):1747-1757.
[8] GEORGAS K, RUMBALLE B, WILKINSON L, et al. Use of dual section mRNA in situ hybridisation/immunohistochemistry to clarify gene expression patterns during the early stages of nephron development in the embryo and in the mature nephron of the adult mouse kidney[J]. Histochem Cell Biol, 2008, 130(5):927-942.
[9] NIELSEN S, MARPLES D,KWON TH, et al. Aquaporins in the kidney: From molecules to medicine[J]. Physiol Rev, 2002, 82:205-244.
(编辑 韩维栋)
Expression of AQP-1 in the developing renal tubules of mice
BO Shuang-ling1, TIAN He2, YAN Li-jing2, ZHAO Kuan1, MA Tai-fang1
(1. Department of Histology and Embryology, Fenyang College of Shanxi Medical University, Fenyang 032200; 2. Department of Histology and Embryology, Liaoning Medical College, Jinzhou 121001, China)
Objective To observe the temporal and spatial expression of aquaporin-1 (AQP-1) in the developing renal tubules of mice so as to investigate the relationship between AQP-1 and development of renal tubules. Methods The expression and content of AQP-1 in the renal tubules of mice were examined by immunohistochemistry, stereological method and Western blot at embryonic days 12, 14, 17 and 18, as well as postnatal days 1, 3, 7, 14, 24, 40 and 70. Results Immunohistochemical analysis showed that AQP-1 was expressed in the developing tubules at embryonic day 14. After that it was localized on the apical and basolateral surfaces of the proximal convoluted tubules, the descending thin limbs of the loop of Henle. However, AQP-1 was not observed in the nephrogenic zone. The results of image analysis and stereology showed that during tubular development the expression of AQP-1 was increased first and then remained stable. Western blot showed that AQP-1 expression reached the peak at postnatal day 7 and then remained stable. Conclusion The expression of AQP-1 in the developing renal tubules of mice shows chronological and spatial sequence, indicating that it might play a key role in the development and maturation of renal tubules.
aquaporin-1 (AQP-1); kidney; development; mouse
2015-04-08
2015-05-06
辽宁省自然科学基金项目(No.2013022011),辽宁省教育厅科学研究一般项目(L2013331) Supported by the Natural Science Foundation of Liaoning Province (No.2013022011) and the Research Project Fund of Liaoning Provincial Department of Education(L2013331)
马太芳. E-mail: taifangma@sohu.com
R329
A
10.7652/jdyxb201601011
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151209.1639.016.html(2015-12-09)
