SALL4在肝癌中的表达及其对预后的影响
2016-04-05王亚婷何彩霞卢振辉杨少奇
王亚婷,何彩霞,卢振辉,王 琦,杨少奇,李 洋
(1. 宁夏医科大学,宁夏银川 750004;2. 宁夏医科大学总医院肝胆外科;3. 宁夏医科大学总医院消化内科,宁夏银川 750004;4. 宁夏吴忠新区医院,宁夏银川 751100)
SALL4在肝癌中的表达及其对预后的影响
王亚婷1,何彩霞1,卢振辉2,王 琦2,杨少奇3,李 洋4
(1. 宁夏医科大学,宁夏银川 750004;2. 宁夏医科大学总医院肝胆外科;3. 宁夏医科大学总医院消化内科,宁夏银川 750004;4. 宁夏吴忠新区医院,宁夏银川 751100)
目的 检测人类婆罗双树样基因4(SALL4)在肝癌中的表达情况,探讨SALL4表达与原发性肝细胞癌(HCC)患者预后的相关性。方法 应用免疫组织化学法检测60例石蜡HCC标本及其中32例癌旁组织标本SALL4蛋白的表达,分析其与HCC患者临床病理学资料及预后的关系;采用荧光定量RT-PCR、Western blot法,分别检测23例新鲜HCC及癌旁肝组织中SALL4 mRNA和蛋白的相对含量。结果 HCC组织中SALL4蛋白的表达率(81.67%,49/60)显著高于癌旁组织(6.25%,2/32),差异有统计学意义(χ2=48.047,P<0.01);SALL4蛋白在HCC中的表达与甲胎蛋白水平有关(P<0.05);SALL4高表达和低表达组患者的平均生存时间分别为(26.20±2.37、34.05±1.26)个月,SALL4高表达组患者的1、3年生存率(75.9%、55.2%)显著低于SALL4低表达组1、3年生存率(95.0%、85.0%,χ2=5.044,P<0.05)。肝癌及癌旁组织的SALL4 mRNA的相对量分别为14.80±8.62、0.17±0.13,两组比较差异有统计学意义(t=8.14,P<0.01)。Western blot检测结果显示,SALL4蛋白在HCC中的相对量为0.354±0.103。癌旁组织中几乎不表达。结论 SALL4表达与肝癌患者预后密切相关,可作为肝癌患者判断预后的预测指标。
肝癌;SALL4基因;免疫组织化学;Western blot;实时荧光定量PCR
我国肝癌(hepatocellular carcinoma, HCC)发病率呈逐年上升趋势,肝癌术后复发转移率高居不下,使得其远期疗效并不理想[1]。因此,筛选出能指导预后的分子标记对肝癌治疗非常重要。近期大量研究认为,肝癌的复发和转移与肝癌干细胞密切相关,肝癌细胞中类干细胞或祖细胞亚型具有预后差的特征[2]。人类婆罗双树样转录因子4(spalt-like transcription factor 4, SALL4)在胚胎早期发育、器官形成以及胚胎干细胞(embryonic stem cell, ESC)增殖和多能性维持方面发挥着重要作用,是经典的干细胞标记物。SALL4在乳腺癌、胃癌、结直肠癌、食管癌等肿瘤中均表达异常[3-6],提示其与肿瘤发生发展关系密切。但在肝癌方面研究较少。本研究将探讨SALL4在肝癌中的表达和作用。
1 材料与方法
1.1 临床标本
选取宁夏医科大学总医院2010年2月~2014年12月肝胆外科手术治疗,经病理确诊的60例HCC石蜡标本及其中32例癌旁组织标本、10例胆管细胞性肝癌标本、10例肝血管瘤标本。其中男性44例,女性16例,年龄范围:26~74岁,平均年龄50岁。分化程度:高分化11例,中、低分化49例。术后当日即为随访开始,通过住院记录和电话进行随访,随访截止时间为2015年2月。另有2013年2月至2014年10月经手术切除的新鲜HCC标本23例及相应癌旁组织(距离癌组织2 cm)。标本取得后立即转移至液氮罐中,随后置于-80 ℃冰箱中冻存。以上病例均有完整的临床病理学资料,术前均未进行化疗或放疗。研究经医院伦理委员会批准并征得病人或家属同意。
1.2 实验试剂
SALL4鼠抗人单克隆抗体,购自Abcam公司。免疫组化试剂盒、鼠抗人beta-actin单克隆抗体均购自北京中杉金桥生物技术有限公司。全蛋白提取试剂盒、BCA蛋白含量检测试剂盒购自南京凯基生物科技发展有限公司。总RNA提取试剂盒购自Omega公司。ECL发光试剂盒、RNA反转录试剂盒、荧光RT-PCR试剂盒均购自Thermo公司。荧光RT-PCR为罗氏LightCycler®480 RT-PCR仪。
1.3 实验方法
1.3.1 免疫组化Elivision二步法 石蜡包埋组织连续切片(厚4 μm),置于65 ℃烤箱中过夜。石蜡切片常规脱蜡、水化,间接蒸汽修复抗原20 min,抗原修复液为EDTA(pH 8.0);依次滴加30 mL/L H2O2,室温20 min;山羊血清封闭液,20 min;SALL4鼠抗人单克隆抗体(1∶100),4 ℃过夜;聚合物辅助剂20 min。辣根酶标记抗小鼠IgG多聚体30 min;DAB显色;常规脱水,透明,封片。PBS代替一抗作为阴性对照。结果判定:每张切片选取5个高倍镜视野,胞核内无显色为阴性(-);25%~50%的细胞核显色、染色颗粒较淡为弱阳性(+);50%~75%细胞核显色、染色颗粒较深为中度阳性();>75%细胞核染色,且染色颗粒深为强阳性()。
1.3.2 荧光定量RT-PCR检测SALL4 mRNA的表达 ①根据GenBank提供的SALL4基因序列(NM_020436.3),由上海生工生物有限公司设计合成SALL4引物,上游:5′-AACGCCACTGTCTCCAAGAT-3′;下游:5′-CACGCAAGTTCTCCCTTAGC-3′;内参GAPDH引物,上游:5′-CAAGGTCATCCATGACAACTTTG-3′;下游:5′-GTCCACCACCCTGTTGCTGTAG-3′。②总RNA提取及逆转录:取60 mg组织按试剂盒说明提取总RNA,经NanoDrop 2000分光光度计检测总RNA质量及浓度,取2 μg总RNA,进行逆转录反应合成cDNA。③严格按照试剂说明操作,PCR反应体系为25 μL。其中SYBR Green qPCR master mix 12.5 μL,上下游引物各1 μL,模板2 μL,置于罗氏LightCycler®480 PCR扩增仪上,反应条件:95 ℃预变性10 min、95 ℃变性15 s、60 ℃退火30 s,40次循环后72 ℃延伸30 s。④mRNA含量采用相对定量法:获得各样本待测基因及同样本GAPDH的Ct值后用2-△△Ct方法计算[7]。定量PCR反应产物同时进行电泳鉴定,实验共重复3次。
1.3.3 Western blot法 提取肝癌及癌旁组织总蛋白,BCA法测定蛋白浓度;上样蛋白为50 μg,SDS-PAGE凝胶电泳后,400 mA 1.5 h转至硝酸纤维素膜;50 g/L脱脂奶粉室温封闭1 h;一抗鼠抗人SALL4单克隆抗体(1∶500)4 ℃孵育过夜,二抗(1∶5 000)室温下孵育2 h,曝光成像。以凝胶定量软件Quantity-one分析灰度值。同时检测内参beta-actin(1∶1 000)的表达。
1.4 统计学方法

2 结 果
2.1 SALL4蛋白的定位与表达
SALL4蛋白主要定位于细胞核。HCC组织中SALL4的表达率(81.67%,49/60)显著高于癌旁组织(6.25%,2/32),差异有统计学意义(χ2=48.047,P<0.01);在10例胆管细胞性肝癌的表达率为80%。SALL4在肝血管瘤组织中不表达(表1、图1)。
表1 不同肝组织标本中SALL4蛋白的表达阳性率(例)
Tab.1 The positive expressions rate of SALL4 in different tissues [n(%)]

标本例数阴性阳性+阳性率(%)肝细胞性肝癌601110281181.67肝胆管细胞性肝癌10224280.00肝癌癌旁组织32302006.25肝血管瘤肝组织10100000.00

图1 SALL4蛋白在肝组织中的表达情况
Fig.1 Expression of SALL4 protein in the liver tissues (×400)
A:SALL4蛋白在HCC组织中呈阳性表达;B:SAll4蛋白在癌旁组织中无表达;C:SALL4在胆管细胞性肝癌中呈阳性表达;D:SAll4蛋白在肝血管瘤中无表达。
2.2 SALL4表达与患者临床特征及生存时间的关系
在60例HCC组织中,SALL4蛋白表达与性别、年龄、部位、肿瘤最大径、分化程度、HBsAg、门静脉癌栓、TNM分期无明显关系(P>0.05),与甲胎蛋白水平有关(P<0.05,表2)。将60例肝癌组织分为阴性表达组(-,n=11)、低表达组(+,n=10)、高表达组(或,n=39)。总体生存时间显示,截止到36个月,SALL4高表达组患者平均生存时间为(26.20±2.37)个月,95%可信区间(CI为21.56~30.85),1、3年累计生存率分别为75.9%,55.2%;SALL4低表达组患者平均生存时间为(34.05±1.26)个月,95%可信区间CI为(31.58~36.52),1、3年累计生存率分别为95.0%,85.0%;SALL4阴性组患者平均生存时间为(35.09±0.87)个月,95%可信区间CI为(33.39~36.79),1、3年累计生存率分别为100%,90.9%。SALL4高表达组患者的生存率明显低于低表达组,差异有统计学意义(χ2=5.044,P=0.025<0.05)(图2)。
2.3 荧光定量RT-PCR检测结果
在23例肝细胞癌中有21例表达SALL4 mRNA,对应癌旁组织中10例表达SALL4 mRNA。SALL4 mRNA在23例肝癌组织中的相对表达量为14.80±8.62,癌旁组织的相对表达量为0.17±0.13,经t检验,两组统计学差异显著(t=8.14,P<0.01)(图3、图4)。
表2 SALL4表达情况与临床病理特征的关系
Tab.2 Relationship between SALL4 expression and clinicopathologic characteristics in hepatocellular carcinoma tissues
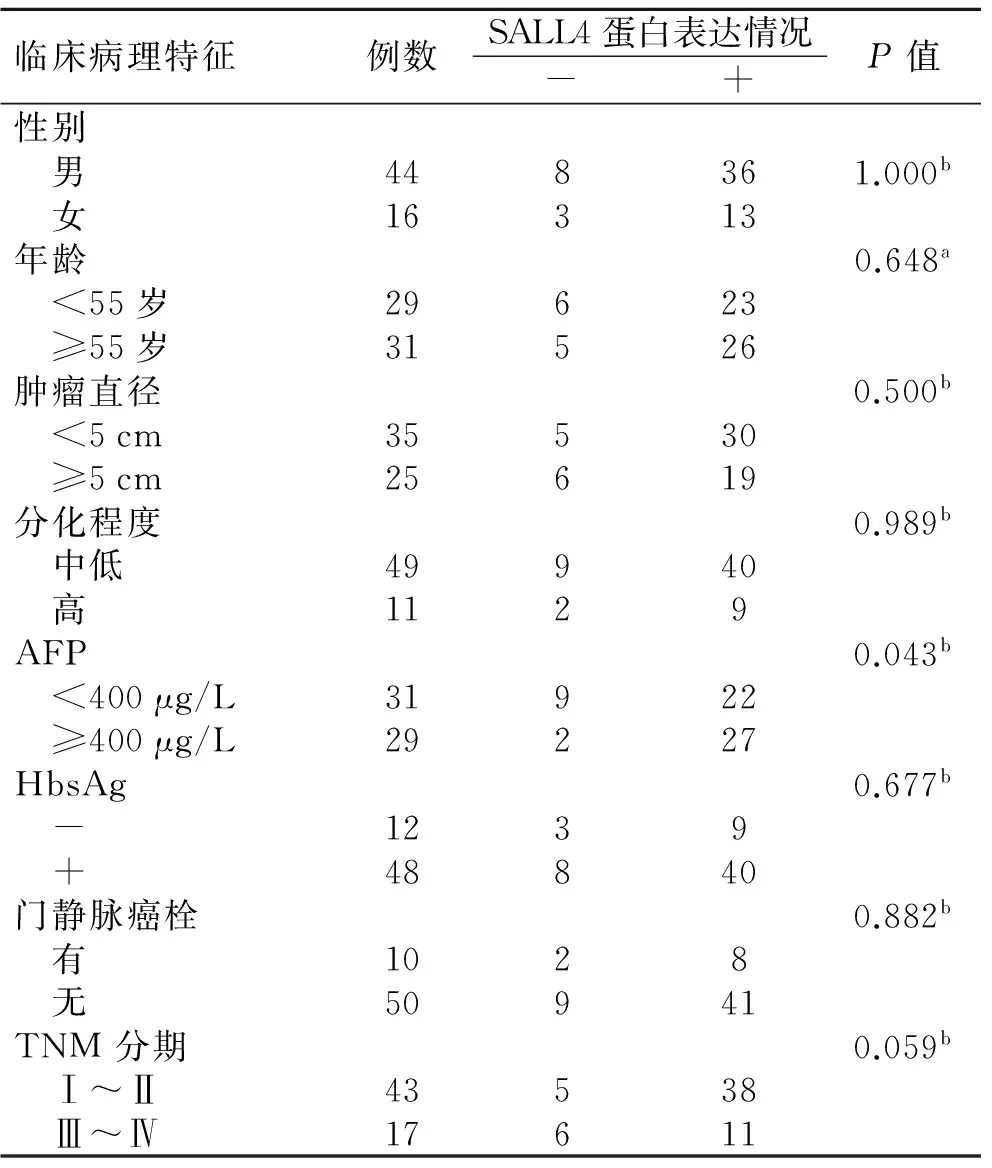
临床病理特征例数SALL4蛋白表达情况-+P值性别 男448361.000b 女16313年龄0.648a <55岁29623 ≥55岁31526肿瘤直径0.500b <5cm35530 ≥5cm25619分化程度0.989b 中低49940 高1129AFP0.043b <400μg/L31922 ≥400μg/L29227HbsAg0.677b -1239 +48840门静脉癌栓0.882b 有1028 无50941TNM分期0.059b Ⅰ~Ⅱ43538 Ⅲ~Ⅳ17611
a为卡方检验;b为Fisher’s精确概率检验法(n<40或有理论数<1)。
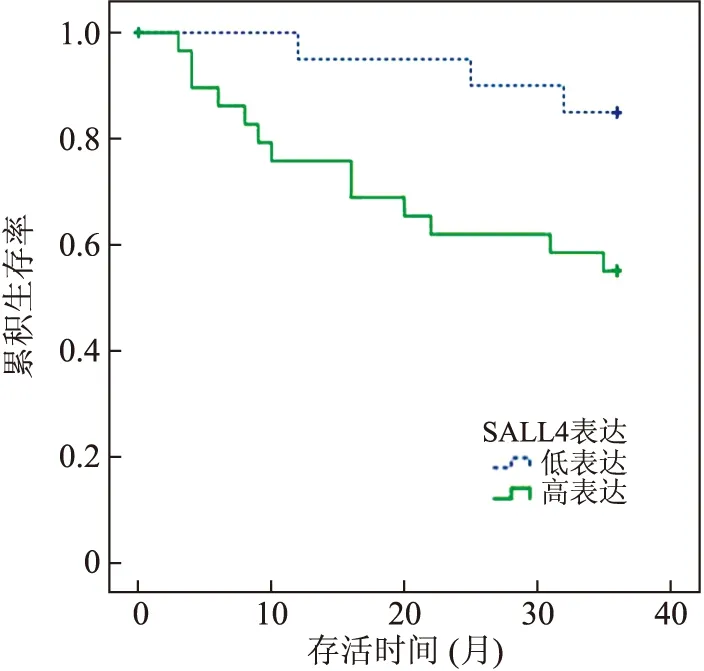
图2 SALL4高表达与低表达组患者的总体生存曲线
Fig.2 Overall survival curve in high SALL4 expression group and low SALL4 expression group

图3 荧光定量RT-PCR反应扩增曲线
Fig.3 The amplification curve graph by FQ-RT-PCR

图4 荧光定量RT-PCR反应溶解曲线
Fig.4 The melt curve graph by FQ-RT-PCR
2.4 Western blot检测结果
SALL4蛋白在23例肝癌组织中的相对表达量为0.354±0.103。癌旁组织中几乎不表达(图5)。
3 讨 论
人类婆罗双树样基因(SALL)家族共4个成员,人的SALL4基因定位于染色体20q13.13-q13.2,编码C2H2型锌指蛋白转录因子[8-9]。研究表明,SALL4的表达富集于胚胎和成人干细胞及类干细胞中,有助于生物发育过程中的细胞干性及肿瘤生长,是一个涉及胚胎、器官发生及肿瘤干细胞(cancer stem cell, CSC)相关的干细胞基因。SALL4与转录因子包括SOX2、Oct3/4、Nanog等相互作用共同维系了ESC的多功能性,是维持ESC无限增殖、自我更新、多向分化的重要调控基因[10]。而SALL4作为核心因素,在这个调控网络中起主导作用[11]。

图5 SALL4蛋白在肝癌及癌旁组织的表达
Fig.5 SALL4 protein expression in hepatocellular carcinoma and paracarcinoma tissues
A、C:肝癌组织;B、D:癌旁组织。
ZHANG等[4]通过功能分析表明,SALL4可上调Bmi-1和Lin28B从而促进胃上皮向间质细胞转化并获得干细胞潜质,参与胃癌的发生和转移。OIKAWA等[12]通过免疫组化证实,SALL4在胎儿及婴儿的肝细胞中高表达,20例HCC中有17例病人的SALL4蛋白表达阳性,在成人正常肝细胞及胆管细胞中未检出SALL4蛋白。本实验中,SALL4在大部分HCC呈高表达,与OIKAWA的研究结果一致。而SALL4在正常肝组织中几乎不表达的特点,提示SALL4有可能作为肝癌肿瘤标记物之一。本实验同时检测了10例胆管细胞性肝癌中SALL4的表达,其中有8例表达SALL4。研究发现SALL4的表达可诱导CK19和EPCAM的表达,CK19作为胆管上皮和胆管细胞性肝癌的特异性染色标记,提示SALL4在促进肝干细胞分化为胆管细胞的过程中可能发挥了重要作用[13]。
本实验发现SALL4表达与AFP有关,AFP作为一种癌胚蛋白,主要来自胚胎的肝细胞,在部分生殖细胞肿瘤及胃肠道肿瘤中升高,而健康成人中合成受到抑制。有趣的是,SALL4蛋白在胎儿和部分新生儿肝脏中表达,而在健康成人肝组织中无表达,但又重新表达于部分预后不良的肝癌患者体内[12]。AFP、SALL4同为癌胚胎蛋白,两者表达是否有内在关联性,有待于进一步研究。
本研究结果显示癌旁组织中SALL4 mRNA的表达与其蛋白表达一致性有差异,提示其表达强度可能受到体内诸多因素的影响,但具体机制有待于进一步研究。PCR结果表明SALL4 mRNA在HCC中呈高表达,SALL4作为干细胞群的可靠指标,它的水平在数量上提示了肝癌组织中含有干细胞的比例。大量研究表明,包括肝癌在内的一些实体恶性肿瘤存在CSC,干细胞特异性标记物呈过表达的肿瘤细胞通常具有较高的侵袭性和致瘤能力。
新近研究发现,SALL4的高表达与结直肠癌细胞的迁移和进展密切相关,SALL4可作为结直肠癌独立的生存预测因子[5]。OIKAWA等[13]发现SALL4在成年鼠成肝细胞(hepatoblast)的表达随着长大后逐渐沉默,表明在胎鼠肝脏细胞早期分化方面起到了重要的作用。进一步敲除SALL4基因可抑制移植肝肿瘤生长,提高了免疫缺陷瘤小鼠的平均存活时间。本实验Kaplan-Meier生存分析显示,SALL4高表达组肝癌患者平均生存时间(26.20±2.37月)较低表达组(34.05±1.26月)明显缩短。表明肝癌组织中SALL4蛋白表达越强,患者的生存期越短,预后越差。SALL4的表达可影响肝癌的恶性生物学行为,可能作为肝癌患者病情程度判断及预后不良的预测指标。但本研究入组病例较少,需进一步加大样本量进行深入研究。
[1] FAN ST, MAU LO C, POON RT, et al. Continuous improvement of survival outcomes of resection of hepatocellular carcinoma: a 20 year experience[J]. Ann Surg, 2011, 253(4):745-758.
[2] MA S, LEE TK, ZHENG BJ, et al. CDl33+HCC cancer stem cells confer chemoresistance by preferential expression of the Akt/P survival pathway[J]. Oncogene, 2008, 27(12):1749-1758.
[3] KOBAYASHI D, KURIBAYSHI K, TANAKA M, et al. Sall4 is essential for cancer cell proliferation and is overexpressed at early clinical stages in breast cancer[J]. Int J Oncol, 2011, 38(4):933-939.
[4] ZHANG L, XU Z, XU X, et al. SALL4, a novel marker for human gastric carcinogenesis and metastasis[J]. Oncogene, 2014, 33(48):5491-5500.
[5] FORGHANIFARD MM, MOGHBELI M, RAEISOSSADATI R, et al. Role of SALL4 in the progression and metastasis of colorectal cancer[J]. J Biomed Sci, 2013, 20(1):6-13.
[6] FORGHANIFARD MM, ARDALAN KS, JAVDANI-MALLAK A, et al. Stemness state regulators SALL4 and SOX2 are involved in progression and invasiveness of esophageal squamous cell carcinoma[J]. Med Oncol, 2014, 31(4):922-927.
[7] SCHMITTGEN TD, LIVAK KJ. Analyzing real-time PCR data by the comparative C(T) method[J]. Nature Protocols, 2008, 3(6):1101-1108.
[8] SWEETMAN D, MUNSTERBERG A. The vertebrate spalt genes in development and disease[J]. Dev Biol, 2006, 293(2): 285-293.
[9] DELOUKAS P, MATTHEWS LH, ASHURST J, et al. The DNA sequence and comparative analysis of human chromosome 20[J]. Nature, 2001, 414(6866):865-871.
[10] TSUBOOKA N, ICHISAKA T, OKITA K, et al. Roles of Sall4 in the generation of pluripotent stem cells from blastocysts and fibroblasts[J]. Genes Cells, 2009, 14(6):683-694.
[11] YANG J, CHAI L, FOWLES TC, et al. Genome-wide analysis reveals Sall4 to be a major regulator of pluripotency in murine-embryonic stem cells[J]. Proc Natl Acad Sci USA, 2008, 105(50):19756-19761.
[12] OIKAWA T, KAMIYA A, ZENIYA M, et al. Sal-like protein 4 (SALL4), a stem cell biomarker in liver cancers [J]. Hepatology, 2013, 57(4):1469-1483.
[13] OIKAWA T, KAMIYA A, KAKINUMA S, et al. Sall4 regulates cell fate decision in fetal hepatic stem/progenitor cells[J]. Gastroenterology, 2009, 136(3):1000-1011.
(编辑 韩维栋)
Expression and prognostic significance of SALL4 in hepatocellular carcinoma
WANG Ya-ting1, HE Cai-xia1, LU Zhen-hui2, WANG Qi2, YANG Shao-qi3, LI Yang4
(1. Ningxia Medical University, Yinchuan 750004; 2. Department of Hepatobiliary Surgery,General Hospital of Ningxia Medical University, Yinchuan 750004; 3. Department of Gastroenterology, General Hospital of Ningxia Medical University, Yinchuan 750004;4. Wuzhong New District Hospital, Yinchuan 751100, China)
Objective To evaluate the expression of human spalt-like transcription factor 4 (SALL4) in hepatocellular carcinoma (HCC) and its relationship with the prognosis of primary HCC. Methods Immunohistochemical method was used to detect SALL4 protein expression in 60 cases of HCC paraffin specimens and 32 cases of corresponding paracarcinoma tissue paraffin specimens. We explored the relationship of SALL4 expression with the patients’ clinicopathological data and the prognosis of HCC. Meanwhile, fluorescence quantitative reverse transcription polymerase chain reaction (FQ-RT-PCR) and Western blot were used to detect SALL4 expression in another 23 pairs of tumors and matched peritumoral samples of HCC with radical resection. Results The high expression rate of SALL4 protein (81.67%, 49/60) in HCC tissues was higher than that in paracarcinoma tissues (6.25%, 2/32), with a significant difference (χ2=48.047,P<0.01). The expression of SALL4 in HCC was correlated with AFP (P<0.05). The average survival time for patients in high SALL4 expression group and low SALL4 expression group was 26.20±2.37 and 34.05±1.26 months, respectively. Moreover, 1-year survival rate (75.9%) and 3-year rate (55.2%) in high SALL4 expression group were significantly lower than those in low expression group (95.0%, 85.0%,χ2=5.044,P<0.05). SALL4 mRNA in HCC and paracarcinoma tissues was 14.80±8.62 and 0.17±0.13, respectively, with a significant difference (t=8.14,P<0.01). Western blot results showed the relative expression of SALL4 protein in liver cancer tissues was 0.354±0.103, but SALL4 protein was hardly expressed in paracarcinoma tissues. Conclusion SALL4 expression is closely related to the postoperative prognosis of patients with HCC. Therefore, it can be used as a predictor for prognosis of liver cancer patients.
hepatocellular carcinoma; spalt-like transcription factor 4 (SALL4) gene; immunocytochemistry; Western blot; real-time fluorescence quantitative reverse transcription polymerase chain reaction (RT-PCR)
2015-04-20
2015-07-10
宁夏回族自治区对外科技合作项目 Supported by the External Technology Cooperation Projects of Ningxia Hui Autonomous Region
杨少奇. E-mail: shaoqiynh@hotmail.com
R735.7
A
10.7652/jdyxb201601022
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151209.1621.010.html(2015-12-09)
