慢性乙型肝炎患者外周血CD4CD25CD127调节性T细胞表达及其与肝组织病理、HBV-cccDNA的关系
2016-04-05晁佩佩盛慧萍石文波程玉娥刘玛潇
晁佩佩,盛慧萍,石文波,杨 岩,程玉娥,刘玛潇,翟 雪
(1. 宁夏医科大学,宁夏银川 750004;2. 宁夏医科大学总医院感染疾病科,宁夏银川 750004;3. 湖北省恩施州中心医院肿瘤Ⅱ科,湖北恩施 445000)
慢性乙型肝炎患者外周血CD4CD25CD127调节性T细胞表达及其与肝组织病理、HBV-cccDNA的关系
晁佩佩1,盛慧萍2,石文波3,杨 岩2,程玉娥1,刘玛潇1,翟 雪1
(1. 宁夏医科大学,宁夏银川 750004;2. 宁夏医科大学总医院感染疾病科,宁夏银川 750004;3. 湖北省恩施州中心医院肿瘤Ⅱ科,湖北恩施 445000)
目的 探讨慢性乙型肝炎(CHB)患者外周血CD4+CD25+CD127low/-调节性T细胞与肝组织HBV-cccDNA及HBV-DNA载量、血清HBV-DNA载量、肝脏病理及肝功能的相关性。方法 采用流式细胞仪检测30例CHB及30例健康体检者外周血CD4+CD25+CD127low/-调节性T细胞占CD4+T细胞百分率;并对其中22例患者行肝组织活检,采用实时荧光定量聚合酶链反应(FQ-PCR)检测CHB患者肝组织HBV-cccDNA、HBV-DNA载量;肝组织进行苏木素-伊红(HE)染色、Masson染色、网染、VG染色,行炎症(G)分级及纤维化(S)分期;同期检测肝功能ALT水平,并对各检测值进行比较和相关性分析。结果 CHB患者外周血CD4+CD25+CD127low/-Treg细胞的百分率为(9.27±2.07)%,明显高于健康对照组(4.96±0.97)%,差异具有统计学意义(P<0.05);CHB患者外周血CD4+CD25+CD127low/-Treg细胞与血清HBV DNA(lgIU/mL)载量呈正相关(Pearson相关系数r=0.38,P<0.05);与肝组织HBV-cccDNA及HBV-DNA(lgcps/mg)均无明显相关性(Pearson相关系数r分别为0.162、0.306,两者均P>0.05);与肝组织炎症级别及纤维化分期均无明显相关性(Spearman秩相关系数r分别为0.056、-0.047,两者均为P>0.05);与ALT亦无明显相关性(Pearson相关系数r=0.044,P>0.05)。结论 慢性乙型肝炎患者外周血CD4+CD25+CD127low/-Treg细胞水平明显升高且与血清HBV-DNA载量呈正相关,提示Treg细胞在慢性乙型肝炎中发挥着重要的负性免疫调节作用,可能是导致病毒复制持续存在的重要因素。
慢性乙型肝炎;调节性T细胞;流式细胞术;HBV-DNA;HBV-cccDNA;肝脏病理
慢性乙型肝炎(chronic hepatitis B, CHB)是由乙型肝炎病毒(hepatitis B virus, HBV)引起的免疫相关性疾病,是当今危害人类健康的常见传染病之一。机体感染HBV后是否发病、病情的严重程度及转归主要与宿主的免疫应答有关[1],其机制至今尚未完全明了,但已经公认的是CHB的发生发展与细胞免疫密切相关[2]。调节性T细胞(regulatory T cell, Treg)是一种特殊的CD4+T细胞亚群,因其独特的免疫低反应和负性免疫调节功能而称为调节性T细胞[3]。近年来,Treg细胞在HBV慢性感染中的作用受到广泛关注,但研究结果尚不一致。本研究旨在通过检测CHB外周血CD4+CD25+CD127low/-T细胞频率、肝组织HBV-cccDNA、HBV-DNA,血清HBV-DNA、ALT、肝组织炎症及纤维化分期,分析各指标间的相关性,初步探讨外周血Treg细胞在CHB发生发展过程中的意义,为CHB的发病机制及临床治疗等研究提供一些实验依据。
1 材料与方法
1.1 研究对象
选择2010年9月至2013年9月在我院感染科门诊及住院未经治疗的HBeAg阳性的CHB患者30例,其中男性患者20例,女性患者10例,年龄17~47岁,中位年龄为30岁。所有患者诊断均符合中国2010年修订的《慢性乙型肝炎防治指南》相关标准[4]。排除甲、丙、丁、戊型肝炎病毒、巨细胞病毒、人类疱疹病毒、人类免疫缺陷病毒等病毒感染,排除急性肝炎、肝癌、酒精性、药物性及自身免疫性疾病等所致肝损害,排除精神心理疾病及心、肺、肾等严重功能障碍患者。另选取同期健康对照组30例,均无肝炎病史,肝炎病原学血清标志物检测均阴性,肝功能均正常。
1.2 研究方法
1.2.1 血清样本采集 所有患者及对照组均于清晨空腹分别抽取外周血10 mL,送至我院检验科进行肝功能(ALT)、血清HBV-M、HBV-DNA等检测;同时取患者及对照组外周血4 mL用枸橼酸钠抗凝管保存,4 h内检测调节性T细胞。
1.2.2 肝穿刺活检 对实验组中的22例患者行肝穿刺活检。穿刺前告知手术可能出现的不良反应及并发症,并取得本人、家属及伦理委员会同意。在B超引导下,用美国巴德活检枪快速穿刺抽取长15~20 mm肝组织1~2条,一条放入EP管中,快速放置于-80 ℃冰箱保存用于肝组织HBV-DNA及HBV-cccDNA检测;另一条放入100 mL/L甲醛溶液中固定后送我院病理科进行苏木素-伊红(HE)染色、Masson染色、网染、VG染色,制作好的病理切片最终由西京医院病理科专家进行肝脏炎症活动度(G)及纤维化程度分级(S)评价。
1.2.3 外周血CD4+CD25+CD127low/-调节性T细胞的检测 取空腹采集的新鲜抗凝血100 μL于消毒的2 mL EP中,均依次加入20 μL FITC标记鼠抗人CD4单抗、20 μL PE标记鼠抗人CD25单抗、5 μL PerCP-Cy5.5标记鼠抗人CD127单抗,震荡混匀,25 ℃避光孵育20 min,加入溶血素2 mL,震荡混匀,避光放置10 min,2 000 r/min,离心5 min,弃上清。2 mL PBS洗涤1次后,加入40 g/L多聚甲醛磷酸盐缓冲液0.5 mL固定,制成单细胞悬液2 h内待测。每次实验均有1个正常人做对照。FACSCalibur型流式细胞仪检测以CD4+CD25+CD127low/-Treg细胞设门作鉴定,以CD4+CD25+CD127low/-调节性T细胞数占CD4+T细胞数百分比作为CD4+CD25+CD127low/-Treg计数,并保存数据。
1.2.4 肝组织HBV-cccDNA、HBV-DNA载量的测定 采用实时荧光定量PCR法检测肝组织HBV-DNA及HBV-cccDNA,严格按照说明书进行。
1.3 统计学方法
2 结 果
2.1 外周血CD4CD25CD127Treg的频率
1例健康对照者和1例CHB患者外周血CD4+CD25+CD127low/-Treg细胞结果显示见图1,频率分别为3.56%、13.5%。与健康对照组(n=30)相比,CHB组(n=30)外周血CD4+CD25+CD127low/-Treg细胞表达明显升高,分别为(4.96±0.97)%、(9.27±2.07)%,差异具有统计学意义(P=0.00)。
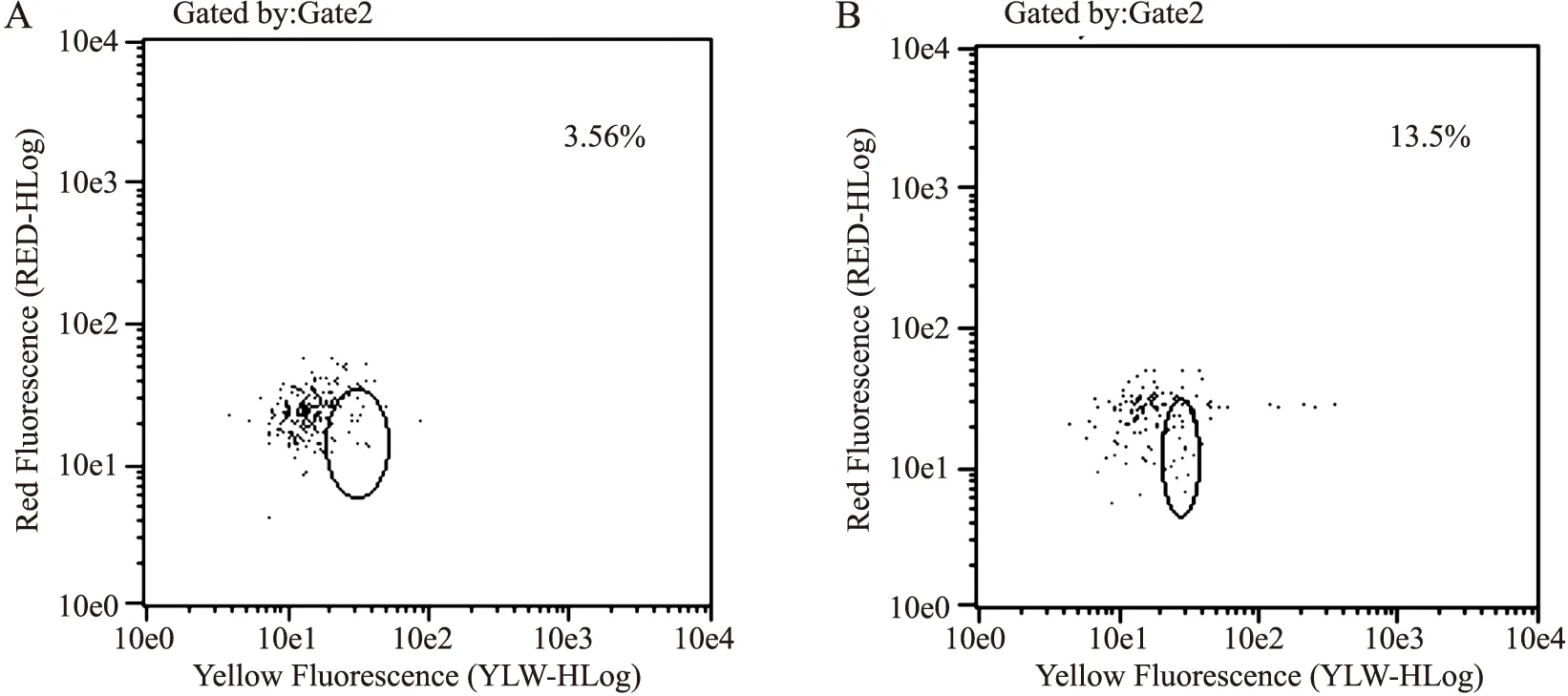
图1 外周血CD4+淋巴细胞群中CD4+CD25+CD127lowT细胞比例散点图
Fig.1 Scatter diagram of the rate of CD4+CD25+CD127low/-T cells in the peripheral blood CD4+lymphocytes
A:健康对照组;B:CHB患者。
2.2 CD4CD25CD127Treg细胞与血清HBV-DNA、肝组织HBV-cccDNA及HBV-DNA载量的关系
CHB患者血清HBV-DNA载量为(6.48±0.99)(lgIU/mL),肝组织HBV-DNA及HBV-cccDNA载量分别为(7.12±0.96)、(5.39±1.16)(lgcps/mg)。Pearson直线相关分析显示,CHB患者外周血CD4+CD25+CD127low/-Treg细胞与血清HBV-DNA(lgIU/mL)载量呈正相关(r=0.38,P<0.05);与肝组织HBV DNA及HBV cccDNA(lg cps/mg)均无明显相关性(r分别为0.31、0.16,两者均为P>0.05),见图2~4。

图2 CD4+CD25+CD127low/-Treg与外周血HBV DNA(lgIU/mL)关系散点图
Fig.2 Scatter diagram of the relationship between CD4+CD25+CD127low/-T cells and plasma HBV DNA (lgIU/mL) in CHB
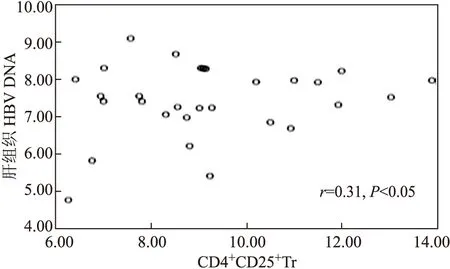
图3 CD4+CD25+CD127low/-Treg与肝组织HBV DNA(lgcps/mg)关系散点图
Fig.3 Scatter diagram of the relationship between CD4+CD25+CD127low/-T cells and intrahepatic HBV DNA (lgcps/mg) in CHB
2.3 CD4CD25CD127Treg细胞与肝组织炎症及纤维化分期的关系
Spearman秩相关分析显示,CHB患者外周血CD4+CD25+CD127low/-Treg细胞与肝组织炎症级别(G)及纤维化(S)分期均无明显相关性(秩相关系数r分别为0.056、-0.047,两者均为P>0.05)。
2.4 CD4CD25CD127Treg细胞与ALT的关系
Pearson直线相关分析显示,CD4+CD25+CD127low/-Treg细胞与ALT无明显相关性(Pearson相关系数r=0.044,P>0.05),见图5。

图4 CD4+CD25+CD127low/-Treg与肝组织HBV-cccDNA(lgcps/mg)关系散点图
Fig.4 Scatter diagram of the relationship between CD4+CD25+CD127low/-T cells and intrahepatic HBV-cccDNA (lgcps/mg) in CHB
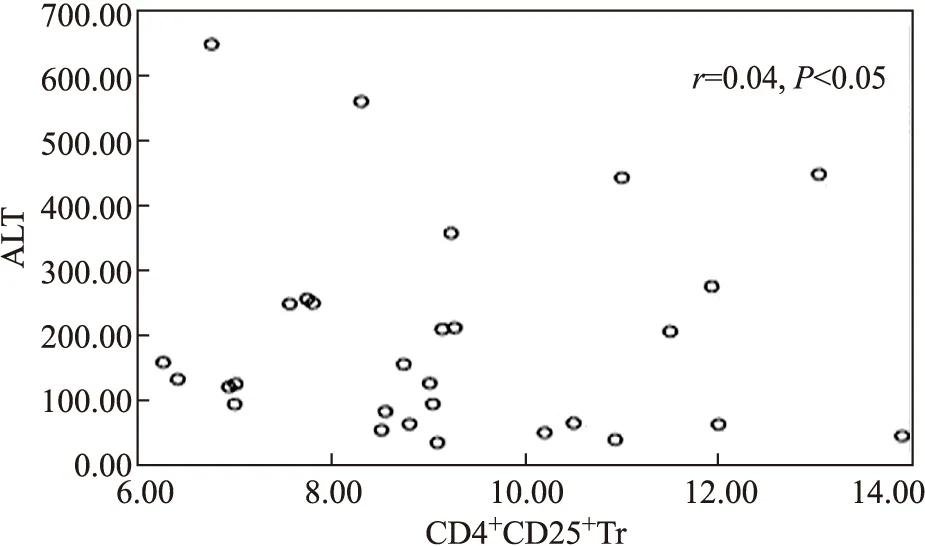
图5 CD4+CD25+CD127low/-Treg与外周血ALT(U/L)关系散点图
Fig.5 Scatter diagram of the relationship between CD4+CD25+CD127low/-T cells and peripheral blood ALT (U/L) in CHB
3 讨 论
HBV感染的慢性化问题一直以来是乙型肝炎防治的一个热点。目前普遍认为机体对HBV感染的免疫耐受是其慢性化最主要的原因之一[5]。虽然国内外学者从不同方面对机体免疫耐受的机制进行了研究,但至今仍未明确。目前比较公认的是在CHB的免疫发病机制中,细胞免疫反应占着很重要的作用[2]。 Treg细胞是近年来研究较多的一种新型免疫细胞亚群,它主要来源于胸腺,亦可以在外周诱导产生。研究表明,Treg细胞具有独特的免疫低反应性及负性免疫调节功能,在诱导自身免疫耐受、维持机体免疫平衡中起着重要作用[6]。Treg细胞的负性免疫调节功能主要是指它能够限制免疫御防中效应性T细胞或B细胞,如CD4+、CD8+T细胞的过度活化、增殖,避免正常组织损伤。其作用机制主要通过细胞与细胞间的直接接触和分泌一些抑制性细胞因子如IL-10、IL-4、TGF-β等发挥其抑制免疫炎性反应的作用[7-8]。免疫低反应性是指Treg细胞对低浓度抗原及抗原提呈细胞的刺激呈低反应状态,而在高浓度的抗原刺激下,可使其活化增殖。Treg细胞是一种高表达CD25与核内转录因子FoxP3为特征的CD4+T细胞群,其中FoxP3是目前国际公认的Treg细胞最特异性的表面标志物[9],是Treg细胞分化、发育和发挥功能的关键转录因子,但是FoxP3属于胞内蛋白,需要对细胞进行固定及穿孔后才能鉴定,因此不能用来对活的调节性T细胞纯化以及细胞的后续研究,而且MORGAN等[10]发现人类FoxP3 mRNA不仅在CD25+T细胞上表达,CD25-T细胞活化后也可短暂表达,可见并不是所有FoxP3阳性的细胞都是调节性细胞。最新研究表明,CD4+CD25+纯化的细胞中Foxp3的表达与CD127低表达呈正相关,CD4+CD25+CD127low/-三标记法可以帮助识别CD4+CD25+Treg和部分激活的CD4+T细胞,提高CD4+CD25+Treg细胞的可检出数量,并且不影响细胞活性度,是反应CD4+CD25+Treg细胞更理想的指标[11]。本研究采用新的表面标志物CD127low/-来研究调节性T细胞,能更明确的判定该群体细胞。
目前,有关外周血CD4+CD25+CD127low/-Treg细胞在CHB患者的免疫发病机制方面的研究,国内外已取得一定的成果,但研究结果尚不一致。现在多数学者认为CHB患者外周血CD4+CD25+CD127low/-Treg细胞与血清病毒载量呈正相关[12-13],也有少数学者研究得出结论与之相反[14]。本研究结果显示,CHB患者外周血Treg细胞比例明显高于健康对照组,且与血清HBV-DNA载量呈正相关,与多数学者的研究结果一致,提示HBV感染后升高的CD4+CD25+CD127low/-Treg细胞促进了HBV病毒复制,可能与其抑制了HBV特异性细胞毒性T淋巴细胞(cytotoxic T lymphocytes, CTL)的活化增殖及其细胞因子的分泌有关,从而影响了机体抗感染免疫应答,导致病毒的持续感染。我们研究还发现外周血CD4+CD25+CD127low/-Treg细胞与肝组织HBV-DNA及HBV-cccDNA间无明显的相关性,分析可能的原因是CD4+CD25+CD127low/-Treg细胞属于免疫调节细胞,主要分布在外周血,而肝组织HBV-DNA及HBV-cccDNA均在肝细胞核内,Treg细胞对细胞核内的免疫调节作用较弱所致。本研究还显示CHB患者外周血Treg细胞比例与血清ALT水平没有明显的相关性,与多数学者观点一致[15]。ALT主要位于细胞质内,在肝细胞膜受损伤或细胞溶解坏死时释放入血。ALT是判断肝脏炎症的血清指标,提示CD4+CD25+CD127low/-Treg细胞可能只是参与了免疫耐受,利于HBV的持续感染,在参与肝脏组织免疫损伤作用中较弱。鉴于肝脏组织病理学检查才是直观、准确反映肝脏病变程度的金标准,本研究对22例CHB患者进行肝穿刺病理学检查,结果显示CD4+CD25+CD127low/-Treg细胞与肝组织炎症级别及纤维化分期亦无明显相关性,而郑盛[16]研究发现慢性HBV感染者外周CD4+CD25+CD127low/-Treg细胞水平与肝组织炎症活动度分级和纤维化分期均呈负相关,这可能与病例的选择和样本含量有关。本实验仅选取了HBeAg阳性的患者,与HbeAg阴性患者的免疫状态不同,可能是造成不同结果的原因,值得我们选取不同免疫状态的CHB患者做进一步研究。
综上所述,CHB患者CD4+CD25+CD127low/-Treg细胞明显升高,且与血清HBV-DNA的复制具有较高的一致性,有望成为反映细胞免疫功能状态的参考指标,而且有助于监测病毒清除、病毒复制。或许我们可以通过降低Treg细胞数量或抑制其功能,来增强机体免疫功能,降低HBV病毒复制,这将为今后CHB的治疗提供新的思路。
[1] 吕红,潘宗琴,胡世芸,等. CD4+CD25+调节性T细胞与不同HBV感染状态的研究进展[J]. 世界华人消化杂志,2014, 22(10):1373-1377.
[2] 孙焕焕,张永宏. T细胞在慢性乙型肝炎发病机制中的作用研究进展[J]. 传染病信息, 2014, 27(4):237-239.
[3] JOSEFOWICZ SZ, LU LF, RUDENSKY AY, et al. Regulatory T cells: mechanisms of differentiation and function[J]. Ann Rev Immunol,2012, 30:531-564.
[4] 中华医学会肝病学分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南2010年更新版[J]. 中华实验和临床感染病杂志:电子版, 2011, 5(1):79-100.
[5] TAN AT, KOH S, GOH V, et al. Understanding the immunopathogenesis of chronic hepatitis B virus: an Asian prospective[J]. J Gastroenterol Hepatol, 2008, 23(6):833-843.
[6] CHRUSCINSKI A, SADOZAI H, ROIAS-LUENQAS V, et al. Role of regulatory T cells (Treg) and the Treg effector molecule fibrinogen-like protein 2 in alloimmunity and autoimmunity[J]. Rambam Maimonides Med J, 2015, 6(3):e0024.
[7] O’CONNOR RA, ANDERTON SM. Foxp3+ regulatory T cells in the control of experimental CNS autoimmune disease[J]. J Neuroimmunol, 2008, 193(1-2):1-11.
[8] 程爱荣,程焱,孙保亮,等. 调节性T细胞及其免疫抑制机制[J]. 中国临床神经科学, 2014, 22(4):438-444.
[9] HAIQI H, YONG Z, YI L, et al. Transcriptional regulation of Foxp3 in regulatory T cells[J]. Immunobiology, 2011, 216(6):678-685.
[10] MORGAN ME, VANBILSEN JH, BAKKER AM, et al. Expression of FOXP3 mRNA is not confined to CD4+CD25+T regulatory cells in humans[J]. Hum Immunol, 2005, 66(1):13-20.
[11] MOORE C, SAUMA D, REYES PA, et al. Dendritic cells and B cells cooperate in the generation of CD4+CD25+FOXP3+allogeneic T cells[J]. Transplant Proc, 2010, 42(1):371-375.
[12] NAN XP, ZHONG Y, YU HT, et al. Circulating CD4+CD25high regulatory T cells and expression of PD-1 and BTLA on CD4+T cells in patients with chronic hepatitis B virus infection[J]. Viral Immunol, 2010, 23(1):63-70.
[13] YU XP, GUO RY, SU ML, et al. Dynamic changes of Treg and Th17 cells and related cytokines closely correlate with the virological and biochemical response in chronic hepatitis B patients undergoing nucleos(t)ide analogues treatment[J]. Hepat Mon,2013,13(12):e15332.
[14] LÜ G, YING L, MA WJ, et al. Dynamic analysis of CD127 expression on memory CD8 T cells from patients with chronic hepatitis B during telbivudine treatment[J]. Virol J, 2010, 7:207-212.
[15] 彭国平,孙雯,孙箴. 乙型肝炎病毒感染不同阶段患者外周血CD4+CD25+调节性T细胞的测定[J]. 中华传染病杂志,2008,26(1):40-45.
[16] 郑盛. 慢性乙型肝炎病毒感染者外周血CD4+CD25+CD127(low/-)调节性T淋巴细胞表达水平及其与肝脏病理关系[J]. 西部医学, 2014, 26(9):1137-1140.
(编辑 韩维栋)
Association of expression of peripheral CD4+CD25+CD127low/-regulatory T cells with liver pathology and HBV-cccDNA in patients with chronic hepatitis B
CHAO Pei-pei1, SHENG Hui-ping2, SHI Wen-bo3,YANG Yan2, CHENG Yu-e1, LIU Ma-xiao1, ZHAI Xue1
(1. Ningxia Medical University, Yinchuan 750004; 2. Department of Infectious Diseases,the Affiliated Hospital of Ningxia Medical University, Yinchuan 750004; 3. Department Ⅱ of Oncology, Central Hospital of Enshi Autonomous Prefecture, Enshi 445000, China)
Objective To investigate the expression level of CD4+CD25+CD127low/-regulatory T cells in the peripheral blood of patients with chronic hepatitis B (CHB) and its association with liver HBV-cccDNA and HBV-DNA, HBV-DNA of the peripheral blood, liver pathology and liver function. Methods We enrolled 30 CHB patients and 30 healthy controls. The percentage of peripheral blood CD4+CD25+CD127low/-regulatory T cells in CD4+T cells were detected by flow cytometry. And 22 patients underwent liver biopsy; the quantities of intrahepatic HBV cccDNA and HBV DNA were detected by real-time fluorescent quantitative PCR. The liver tissue was dyed with HE dyeing, Masson dyeing, Nets dyeing and VG dyeing. Inflammatory grading and fibrosis staging were performed. The level of alanine aminotransferase (ALT) was collected simultaneously. Results The frequency of the peripheral blood CD4+CD25+CD127low/-Treg in CHB was (9.27±2.07)%, which was significantly higher than that in healthy controls [(4.96±0.97)%,P<0.05]. The peripheral blood CD4+CD25+CD127low/-Treg in CHB was positively correlated with the plasma HBV DNA (lgIU/mL) (r=0.38,P<0.05), and there was no significant correlation with the level of liver inflammation or fibrosis stage (r=0.056, -0.047 respectively, bothP>0.05). Also there were no significant correlation with ALT (r=0.044,P>0.05). Conclusion The expression of CD4+CD25+CD127low/-regulatory T cells in the peripheral blood of CHB patients increased significantly, which suggested that Tregs plays a negative role in immune regulation of CHB and may be an important factor of the persistence of viral replication.
chronic hepatitis B; regulatory T-lymphocyte; flow cytometry; HBV-DNA; HBV-cccDNA; hepatic pathohistology
2015-03-27
2015-08-10
宁夏回族自治区科技攻关项目[No.(2011)25] Supported by the Science and Technology Key Project of Ningxia Hui Autonomous Region [No.(2011)25]
杨岩. E-mail: yangyan6660@163.com;盛慧萍与晁佩佩为共同第一作者。
R512.6
A
10.7652/jdyxb201601017
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151209.1624.012.html(2015-12-09)
