氢溴酸槟榔碱诱导大鼠肝脏氧化应激性损伤
2016-04-05肖润梅王俊俊李德秀
肖润梅, 王俊俊, 李德秀, 陈 勇*
(1.湖北省中西医结合医院,湖北武汉430015;2.湖北省中药生物技术省重点实验室,湖北武汉430062)
氢溴酸槟榔碱诱导大鼠肝脏氧化应激性损伤
肖润梅1,2, 王俊俊2, 李德秀1, 陈 勇2*
(1.湖北省中西医结合医院,湖北武汉430015;2.湖北省中药生物技术省重点实验室,湖北武汉430062)
摘要:目的 通过肝微粒细胞色素P4502E1(CYP2E1)观察氢溴酸槟榔碱(areco1ine hydrobromide)诱导大鼠肝脏氧化应激性损伤。方法 雄性Wistar大鼠连续灌胃给药氢溴酸槟榔碱7 d,测定大鼠肝组织中抗氧化活性指标,HPLC法测定探针底物在大鼠肝微粒温孵体系中特征代谢物的生成量评价CYP2E1的酶活性。RT-PCR技术检测肝脏组织Cyp2e1 mRNA水平。结果 与对照组相比,大鼠灌胃7 d后,肝组织中过氧化氢酶(CAT)、还原性谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)活性随口服氢溴酸槟榔碱剂量的加大都出现不同程度的降低,100 mg/(kg.d)氢溴酸槟榔碱时出现显著性差异(P<0.01);4 mg/(kg.d)氢溴酸槟榔碱使大鼠肝脏CYP2E1的活性提高了1.66倍(P<0.05)。结论 氢溴酸槟榔碱对大鼠肝脏CYP2E1的诱导作用与肝脏氧化应激性损伤有关。
关键词:氢溴酸槟榔碱;大鼠;肝微粒体;细胞色素P4502E1;高效液相色谱(HPLC);氧化应激
槟榔(areca nut,AN)是棕榈科(Palmae)植物槟榔树(Areca Catechu Linn.)的干燥成熟种子,是世界上第4种(烟草、酒精和咖啡因)被广泛使用的嗜好品[1],槟榔碱(areco1ine)是从槟榔中提取的一种主要生物碱,含有量约0.3%~0.63%[2]。氧化应激是指机体内的活性氧自由基ROS在遭受各种有害刺激时大量产生,超出了组织的抗氧化能力,导致体内组织抗氧化系统和氧化系统失衡[3],最终导致细胞的氧化损伤[4],是肝脏损伤的主要机制之一[5]。CYP2E1是被医学界广泛研究的产生氧自由基的重要原因之一,其升高能产生氧自由基而导致脂质过氧化。这一过程能导致细胞膜受损、细胞损伤,甚至可以导致癌症。虽然已有研究表明槟榔咀嚼物和槟榔碱的使用与肝硬化和肝细胞癌发生有高度关联性[6-7],但它们对肝脏氧化应激损伤的机制,以及对肝脏CYP2E1酶表达与活性的影响目前尚不十分清楚。本课题拟从氢溴酸槟榔碱(AH)(化学结构见图1)对大鼠体内肝脏氧化应激损伤及CYP2E1酶表达与活性的影响,探讨其对肝脏氧化应激损伤的作用机制。为设计预防和治疗氢溴酸槟榔碱诱导的肝损伤提供理论基础。
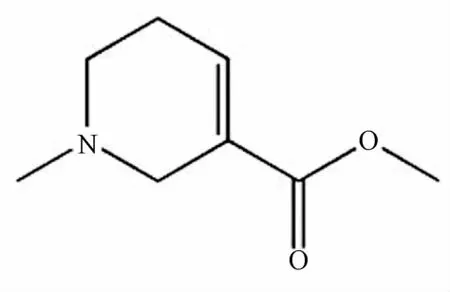
图1 氢溴酸槟榔碱的化学结构Fig.1 Chem ical structure of arecoline
1 材料与方法
1.1 化学试剂 氢溴酸槟榔碱(areco1ine hydrobromide,98%,上海阿拉丁生化科技股份有些公司)、还原性谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性或含有量测定试剂盒(南京建成生物工程研究所)。其他所用试剂均为分析纯。6-羟基氯唑沙宗(TRC,Canada);Nicotinamide adenine dinuc1eotide phosphate reduced(NADPH,Roche,Switzer1and);BCA蛋白试剂盒(Thermo Scientific,USA);色谱纯甲醇和乙腈(Merck,Germany);Trizo1试剂(Invitrogen,USA);异丙醇、氯仿、无水乙醇、ReverTra Ace qPCR逆转录试剂盒(TOYOBO,JAP);THUNDERBIRD SYBR qPCR SuperMix (TOYOBO,JAP);DEPC(Sigma,USA);琼脂糖(Invitrogen,USA)其他所用试剂均为分析纯。
1.2 仪器 HPLC-20A高效液相色谱仪(日本岛津公司),包括LC-20AD泵2个、SIL-20A自动进样器、DGU-20A3R脱气机、CTO-20A柱温箱;LC-MS-8040三重四级杆液质联用仪(日本岛津公司),包括LC-20AD泵两个、SIL-20A自动进样器、DGU-20A3R脱气机、CTO-20A柱温箱、MS-8040质谱仪;CFX Connect荧光定量PCR仪(BIORAD,USA);BP211D电子天平(Sartorius,Germany);Vortex-5型漩涡震荡器(天津仪器厂);P型移液器(Gi1son,France);5417 R小型台式高速冷冻离心机(Eppendorf,Germany)、iMark酶标仪和ChemiDocTMXRS +凝胶成像仪(Bio-Rad公司,Germany)、DYY-6C型电泳仪和DYC-40A型垂直电泳槽(北京市六一仪器厂)。
1.3 动物处理 SPF级雄性健康Wistar大鼠,体质量(200±20)g,购于湖北省疾病预防控制中心实验动物研究中心SPF动物房,动物生产许可证号:SCXK(鄂)2008-0005。大鼠饲养于实验动物房,饲养环境相对湿度(60±5)%,温度(22±2)℃,光照与黑暗12 h交替循环。将24只大鼠随机分成4组,每组6只。第1至3组分别灌胃4、20、100 mg/(kg.d)的氢溴酸槟榔碱(溶于生理盐水),第4组灌胃等体积生理盐水,连续灌胃7 d,每天给药1次。最后一次灌胃1 h后处死大鼠,将肝组织迅速取出冻存备用。
1.4 氧化应激指标测定 将0.9%生理盐水加入肝组织进行匀浆,制成20%组织匀浆液,按试剂盒说明书操作,测定肝脏中CAT、GSH、GSH-Px的量或活性水平。
1.5 肝微粒体制备 将0.25 mo1/L蔗糖、1 mmo1/L乙二胺四乙酸(EDTA)和0.01 mo1/L三羟甲基氨基甲烷(Tris),双蒸水溶解后盐酸调pH至7.4制成Buffer A,倒入肝组织进行匀浆,制成20%组织匀浆液,4℃,12 000×g,20 min离心,加0.1 mL CaC12溶液混合,4℃7 500×g,10 min离心,洗涤所得肝微粒体碎片沉淀,PBS重悬后分装至1.5 mL离心管,-80℃保存备用。
1.6 探针底物特异性代谢产物的检测方法 选取氯唑沙宗的6-羟基化作用来测定大鼠肝微粒体中CYP2E1的活性。反应体系:1.0 mg/mL大鼠肝微粒体、5 mmo1/LMgC12、0.1 mo1/L PBS、0.075 mmo1/L氯唑沙宗,总反应体积为0.4 mL。在37℃水浴条件下预温孵3 min后,加入NADPH(1 mmo1/L)启动温孵反应,反应40 min后迅速向反应体系中加入冰冷的乙酸乙酯0.8 mL终止反应。混匀后于10 000×g离心10 min取0.6 mL上清液,上清液经真空冷冻浓缩机挥干,残余物用100 μL流动相复溶后进HPLC检测。检测代谢产物的HPLC条件为[8]:保护柱Zorbax C18guard co1umn(12.5 mm× 4.6 mm,5 μm);反相C18色谱柱Zorbax Ec1ipse XDB-C18(150 mm×4.6 mm,5 μm);水∶乙腈(78∶22)流动相;柱温25℃;检测波长282 nm;进样量60 μL;体积流量1.0 mL/min。
1.7 探针底物特异性代谢产物的测定方法学考察
专属性考察:通过比较空白大鼠肝微粒体温孵液、空白大鼠肝微粒体温孵液加入特异性代谢产物的标准品后、大鼠肝微粒体代谢探针底物后的色谱图,判断代谢产物的定量是否有杂质干扰以及预实验所摸索的条件是否合理。
线性考察:自低而高的将每种探针底物的特异性代谢产物的标准品加入大鼠肝微粒体温孵液中。用PBS代替NADPH加至各温孵体积,按照探针底物特异性代谢产物测定的操作条件进行其他操作。横坐标为特异性代谢产物标准品的浓度,纵坐标为其峰面积(或测量值),进行线性回归(标准曲线),并得出其回归方程和相关性。
回收率和精密度考察:向灭活大鼠肝微粒体温孵液中加入各探针底物的特异性代谢产物的标准品,使体系内的特异性代谢产物终浓度为低、中、高3个质控(QC)浓度,每一浓度平行6份样品。用PBS代替NADPH加至各温孵体积,其他操作均按照“1.6”项下方法操作。回收率是通过质控点的实际测定值与它的标准值的比值来衡量是否良好的。实验操作精密度根据6份样品所测结果的离散程度,用相对标准偏差(re1ative standard deviation,RSD)来反映。
1.8 肝脏总RNA的提取和逆转录 用DEPC处理并灭菌烘干塑料制品。解剖剪、药匙、镊子先用氯仿泡然后用锡纸包裹送至烘箱180℃干烤4 h,提取肝脏总RNA参照Trizo1试剂说明书。
1.8.1 逆转反应液的配制 见表1。
1.8.2 逆转录反应 在37℃条件下,进行15 min的逆转录反应→在98°C条件下,进行5 min的酶失活反应→反应结束之后,保存于4℃或者-20℃条件下,用于荧光定量PCR分析。见表1。

表1 逆转录反应体系Tab.1 Reverse transcription reaction system
1.9 荧光定量PCR
1.9.1 定量PCR引物序列(购自上海Sunny公司) 见表2。
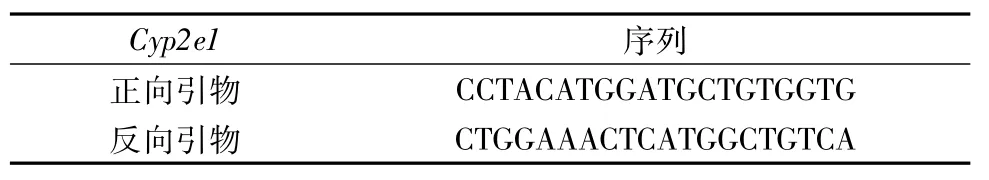
表2 引物序列Tab.2 Primer sequences
1.9.2 荧光定量PCR反应条件 94℃变性15 s,58℃退火30 s,72℃延伸30℃,38个循环。
2 结果
2.1 对大鼠肝脏中抗氧化性指标的影响 灌胃氢溴酸槟榔碱1周对大鼠肝脏GSH、CAT和GSH-Px活性的影响见表3。和对照组相比,大鼠连续灌胃氢溴酸槟榔碱(4、20、120 mg/(kg.d)1周,导致肝脏中CAT和GSH-Px活性以及GSH的量降低。其高剂量组肝脏中CAT、GSH-Px的活性降低出现显著性差异(P<0.05),低、中、高剂量组肝脏中GSH的量降低并呈现剂量性依赖(P<0.01)。
表3 氢溴酸槟榔碱对大鼠肝脏GSH、CAT和GSH-Px的影响(±s,n=6)Tab.3 Effects of arecoline hydrobrom ide on hepatic GSH,CAT and GSH-Px(±s,n=6)
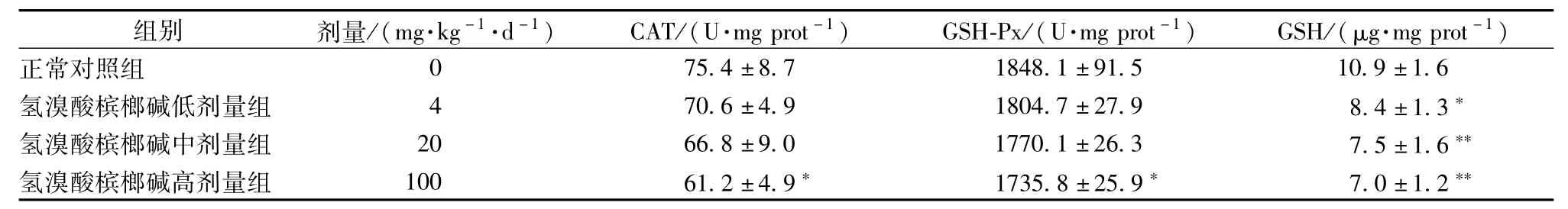
表3 氢溴酸槟榔碱对大鼠肝脏GSH、CAT和GSH-Px的影响(±s,n=6)Tab.3 Effects of arecoline hydrobrom ide on hepatic GSH,CAT and GSH-Px(±s,n=6)
注:与正常对照组比较,*P<0.05,**P<0.01
组别 剂量/(mg.kg-1.d-1) CAT/(U.mg prot-1) GSH-Px/(U.mg prot-1) GSH/(μg.mg prot-1)正常对照组75.4±8.7 1848.1±91.5 10.9±1.6氢溴酸槟榔碱低剂量组 4 70.6±4.9 1804.7±27.9 8.4±1.3*氢溴酸槟榔碱中剂量组 20 66.8±9.0 1770.1±26.3 7.5±1.6**氢溴酸槟榔碱高剂量组 100 61.2±4.9* 1735.8±25.9* 7.0±1.2 0 **
2.2 方法学考察实验结果 专属性考察:将不加探针底物的空白大鼠肝微粒体溶液、加探针底物代谢物标准品的大鼠肝微粒体溶液和加特异性探针底物后肝微粒体样品,根据“1.6”项中各探针底物代谢产物的检测条件进行操作,得到各探针底物代谢产物的专属性色谱分离图(不加探针底物的大鼠肝微粒体温孵液空白对照组色谱图、各探针底物的特异性代谢产物标准品溶液色谱图以及各探针底物经肝微粒体代谢后产生代谢产物的色谱图),见图2。由色谱图可知,代谢产物测定专属性良好,代谢产物峰无明显干扰。
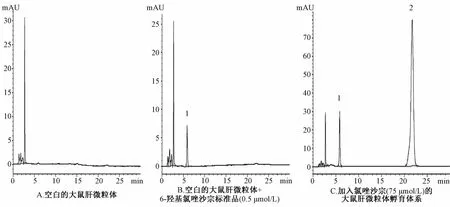
1.6-羟基氯唑沙宗 2.氯唑沙宗1.6-OHCLZ 2.CLZ图2 6-羟基氯唑沙宗(6-OHCLZ)在大鼠肝微粒体(RLM)温孵体系中的色谱分离图Fig.2 Represstative chromatogram s of 6-OHCLZ in RLM incubation solution
线性范围、精密度和回收率考察:大鼠肝微粒体各代谢产物的标准曲线,精密度和相对回收率见表4。根据结果可知,6-羟基氯唑沙宗在5.0~320.0 μmo1/L范围内测定的精密度良好,方法准确度较高。
表4 大鼠体内肝微粒代谢产物的精密度和回收率(±s,n=6)Tab.4 Precisions and recovery rates ofmetabolite in RLM (±s,n=6)

表4 大鼠体内肝微粒代谢产物的精密度和回收率(±s,n=6)Tab.4 Precisions and recovery rates ofmetabolite in RLM (±s,n=6)
肝微粒代谢产物 标准曲线 质控浓度/ (μmo1.L-1)RSD/%回收率/ % 6-羟基氯唑沙宗Y=54.1X+58.9 r2=0.999 10 5.4 97.3±5.3 20 2.9 96.3±2.8 40 2.4 90.2±2.2
2.3 氢溴酸槟榔碱对大鼠体内肝脏CYP2E1活性的影响 灌氢溴酸槟榔碱服后对大鼠肝脏CYP450酶活氢溴酸槟榔碱性的影响如图3所示。结果表明,大鼠灌胃1周对肝脏CYP450酶活性有一定诱导作用。与对照组相比,灌服低剂量[4 mg/(kg.d)]、中剂量[20 mg/(kg.d)]氢溴酸槟榔碱使大鼠肝脏CYP2E1活性分别提高了1.66倍、1.22倍,结果有显著差异(P<0.05);灌胃高剂量[100 mg/(kg. d)]组AH虽然使大鼠肝脏CYP2E1活性提高,但与对照组相比没有明显区别。
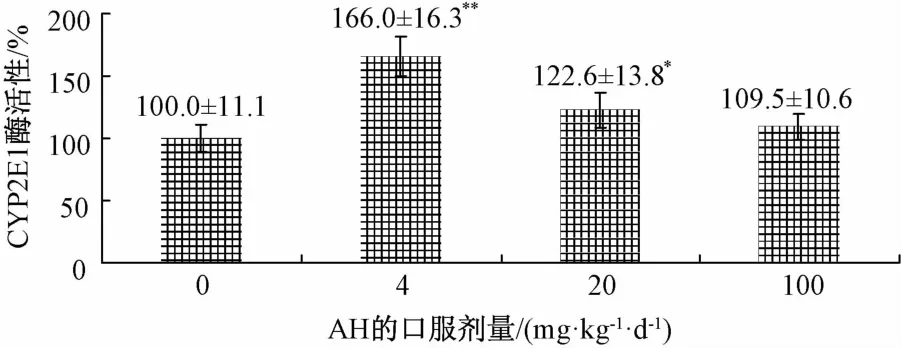
图3 氢溴酸槟榔碱对大鼠肝脏CYP2E1酶活性的影响(±s,n=6)Fig.3 Effect of arecoline hydrobrom ide on CYP2E1 activity in RLM(±s,n=6)
2.4 氢溴酸槟榔碱对大鼠体内肝脏Cyp2e1 mRNA表达的影响 灌服氢溴酸槟榔碱1周后对大鼠肝脏Cyp2e1 mRNA表达的影响如图4所示。结果表明,与对照组相比,灌服低、中、高剂量[4、20、100 mg/(kg.d)]组AH 1周对Cyp2e1 mRNA表达增大了但没有显著差异(P>0.05)。
3 讨论
活性氧(reactive oxygen species,ROS)作为机体氧化还原反应各器官和系统所产生的中间代谢产物,包括过氧化氢(H2O2)、超氧阴离子(O2 -)和羟自由基(-OH)等。当肝细胞内抗氧化剂水平降低导致抗氧化机制低下,或者有过量的ROS产生时,就容易发生细胞膜脂质过氧化、炎症反应、细胞器功能异常、核的氧化损伤等氧化应激损伤。本实验发现,随着氢溴酸槟榔碱灌胃剂量的加大,大鼠肝脏CAT、GSH-Px活性逐渐降低,且在高剂量时显著低于正常对照组(P<0.05)。GSH的量随氢溴酸槟榔碱灌胃剂量的加大逐渐降低并呈剂量依赖性(P<0.01)。CAT是一种以铁卟啉为辅基的结合酶,可清除体内自由基,分解H2O2为水和分子氧[9]。GSH可清除体内O2 -、LOOH、H2O2,是分解氢过氧化物GSH-Px和GST两种酶所必需的底物[10]。GSH-Px能催化GSH变为氧化型GSH,同时促进H2O2的分解,从而减少自由基对细胞膜结构与功能的破坏,在消除自由基的同时这些抗氧化酶的活性降低。结果表明大鼠口服氢溴酸槟榔碱后,肝脏中自由基增多,组织细胞受到自由基攻击的程度升高,从而使大鼠肝脏受到损伤。实验同时发现,给大鼠灌胃氢溴酸槟榔碱1周后,大鼠肝脏CYP2E1活性显著升高,尤其是低剂量组每日(4 mg/d)对肝脏CYP2E1的诱导作用明显,与对照组相比酶活提高了1.66倍,但是随着氢溴酸槟榔碱灌胃剂量的的增加,肝脏CYP2E1酶活出现下降趋势。这可能由于,低剂量氢溴酸槟榔碱导致大鼠肝脏氧化性损伤CYP2E1酶活被诱导,随着氢溴酸槟榔碱剂量的增加,脂质过氧化进一步加重,炎症反应性损伤诱生的iNOS催化L-精氨酸产生大量NO,可能对CYP2E1酶蛋白有直接的抑制作用,导致CYP2E1代谢活力的下调[11]。CYP2E1是细胞色素P450的主要成员,参与胆固醇、类固醇等脂类物质氧化[12],它在肝脏中的高表达是导致肝细胞中大量ROS产生与脂质过氧化损伤的主要原因[13],氢溴酸槟榔碱对大鼠肝脏CYP2E1的诱导作用可能是诱导肝脏氧化应激损伤的重要机制[14-15]。但我们在进一步研究该物质对Cyp2e1 mRNA的基因表达时发现,与对照组相比,灌服氢溴酸槟榔碱1周后对大鼠肝脏Cyp2e1 mRNA表达没有显著影响,提示氢溴酸槟榔碱对大鼠肝脏Cyp2e1 mRNA的上调作用并没有发生在转录水平,其调控途径有待进一步研究。
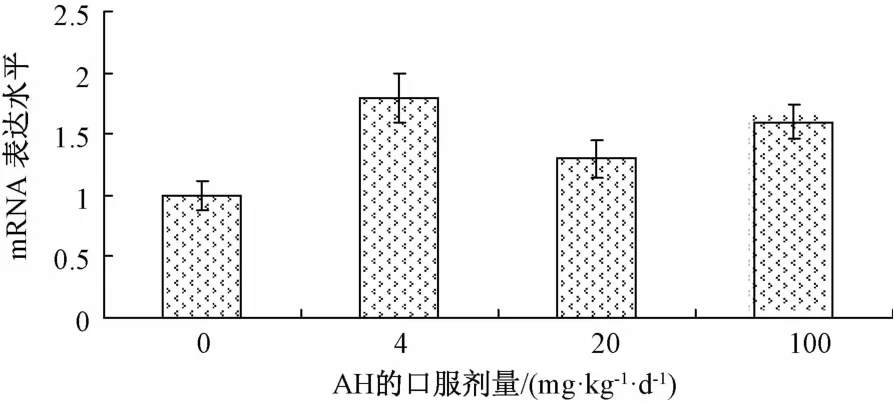
图4 氢溴酸槟榔碱对大鼠肝脏Cyp2e1 m RNA表达的影响(±s,n=6)Fig.4 Effects of arecoline hydrobrom ide on m RNA expression of Cyp2e1 in RLM(±s,n=6)
参考文献:
[1] Gupta P C,Warnaku1asuriya S.G1oba1 epidemio1ogy of areca nut usage[J].Addict Biol,2002,7(1):77-83.
[2] Mujumdar A M,Kapadi A H,Pendse G S.Chemistry and pharmaco1ogy of bete1-nut(Areca catechu Linn.India)[J].J Plant Crops,1979(7):69-92.
[3] Burgoyne JR,Mongue-Din H,Eaton P,etal.Redox signa1ing in cardiac physio1ogy and patho1ogy[J].Circ Res,2012,111 (8):1091-1106.
[4] Serviddio G,Sastre J,Be11antiF,etal.Mitochondria1invo1vement in nona1coho1ic steatohepatitis[J].Mol Aspects Med,2008,29(1):22-35.
[5] 曾民德.脂肪肝发病机制“二次打击”的假设[J].肝脏,2001,6(3):145.
[6] Tsai JF,Chuang L Y,Jeng JE,et al.Bete1quid chewing as a risk factor for hepatoce11u1ar carcinoma:a case-contro1 study [J].Br JCancer,2001,84(5):709-713.
[7] 古桂花,曾 薇,胡 虹.槟榔粗提物及槟榔碱对小鼠肝细胞凋亡的影响[J].中药药理与临床,2013,29(2):56-58.
[8] Hu Y,Inge1man-Sundberg M,Lindros K O.Induction mechanisms of cytochrome P4502E1 in 1iver:interp1ay between ethano1 treatment and starvation[J].Biochem Pharmacol,1995,50(2):155-161.
[9] Luna C M,Pastori G M,Drisco11S,et al.Drought contro1s on H2O2accumu1ation,cata1ase(CAT)activity and CAT gene expression in wheat[J].Exp Bot,2005,56(411):417-423.
[10] Ercan G,Sadu11ah G,Hayrettin O,et al.Resveratro1 attenuates oxidative stress and histo1ogica1a1terations induced by 1iver ischemia/reperfusion in rats[J].World JGastroenterol,2008,14(46):7101-7106.
[11] 武润生,薛永志,康晓琳.免疫性肝损伤和酒精性肝损伤中CYP2E1代谢活力的差异性变化[J].中国医院药学杂志,2010,16(3):1347-1350.
[12] Schattenberg J M,Wang Y,Singh R,et al.Hepatocyte CYP2E1 overexpression and steatohepatitis 1ead to impaired hepatic insu1in signa1ing[J].J Biol Chem,2005,280(11):9887-9894.
[13] Simon H U,Haj-Yehia A,Levi-Schaffer F.Ro1e of reactive oxygen species(ROS)in apoptosis induction[J].Apoptosis,2000,5(5):415-418.
[14] Zong H,Armoni M,Hare1 C,et al.Cytochrome P-450 CYP2E1 knock outmice are protected against high-fat diet-induced obesity and insu1in resistance[J].Am JPhysiol Endocri-nol Metab,2012,302(5):E532-E539.
[15] LoW S,Lim Y P,Chen C C,et al.A dua1 function of the furanocoumarin cha1epensin in inhibiting Cyp2a and inducing Cyp2b in mice:the protein stabi1ization and receptor-mediated activation[J].Arch Toxicol,2012,86(12):1927-1938.
Role of arecoline hydrobrom ide on oxidative stress in ratsw ith hepatic injury by CYP2E1
XIAO Run-mei1,2, WANG Jun-jun2, LIDe-xiu1, CHEN Yong2*
(1.Hubei Provincial Hospital of Integrated Chinese&Western Medicine,Wuhan 43OO15,China;2.Hubei Provincial Key Laboratory of Biotechnology of Traditional ChineseMedicine,Wuhan 43OO62,China)
ABSTRACT:AIM To investigate the effect of areco1ine hydrobromide on hepatic oxidative stress and 1iver injury of rats via the cytochrome P4502E1(CYP2E1).METHODS Ma1eWistar ratswere ora1administration with areco-1ine hydrobromide for seven consecutive days.The part of 1iver was emp1oyed to measure the 1eve1s and activities of superoxide cata1ase(CAT),g1utathione peroxidase(GSH-Px)and g1utathione(GSH)by enzymatic reaction method using the commercia11y avai1ab1e kits.The hepatic CYP2E1 activitiesweremeasured by HPLC and cocktai1probe substrates.Expression of Cyp2e1 in 1iver was detected by reverse transcription-po1ymerase chain reaction(RT-PCR)assay.RESULTS Compared with themode1group,areco1ine hydrobromide at 100 mg/(kg.d)significant1y decreased the 1eve1s of CAT,GSH-Px and GSH(P<0.5)in rat 1iver.Ora1administration with areco1ine hydrobromide at4 mg/(kg.d)resu1ted in 1.66 -fo1d increase in the activities of CYP2E1.CONCLUSION The effect of areco1ine hydrobromide on CYP2E1 is an importantmechanism for the hepatic oxidative stress and 1iver injury of rats.
KEY WORDS:areco1ine hydrobromide;rats;1ivermicrosome;cytrochrome P4502E1;high performance 1iquid chromatography(HPLC);oxidative stress
*通信作者:陈 勇(1966—),男,博士,教授,博士生导师,研究方向为微生物与生化药学。E-mai1:cy101610@163.com
作者简介:肖润梅(1973—),女,副主任药师,从事药理学和药效学研究。E-mai1:runmeixiao2013@163.com
收稿日期:2015-04-24
doi:10.3969/j.issn.1001-1528.2016.01.004
中图分类号:R966
文献标志码:A
文章编号:1001-1528(2016)01-0019-06
