Micro RNA-132对结肠癌细胞生物学功能的作用
2016-03-26赵继明彭健中南大学湘雅医院湖南长沙410008
赵继明,彭健(中南大学湘雅医院,湖南长沙410008)
Micro RNA-132对结肠癌细胞生物学功能的作用
赵继明,彭健
(中南大学湘雅医院,湖南长沙410008)
摘要:目的探讨microRNA-132(miR-132)对结肠癌细胞系LOVO生物学功能的作用。方法通过体外转染miR-132 mimic的方式进行获得性功能实验。以细胞计数检测(CCK-8)、平板克隆形成、流式细胞凋亡检测以及划痕实验分析miR-132过表达对LOVO细胞增殖与侵袭的影响。结果LOVO细胞中,外源性过表达miR-132能够抑制其生长,且抑制率呈时间、浓度依赖性,50 nmol/L miR-132 mimic处理72 h后,抑制率达30%。流式细胞凋亡检测发现miR-132过表达诱导细胞凋亡。miR-132过表达可以抑制LOVO细胞体内的外克隆形成能力。体外平板克隆形成实验显示,miR-132过表达使LOVO细胞克隆形成率从21%降至7%。划痕修复实验结果显示,高表达miR-132各组细胞的迁移能力降低。结论miR-132过表达能显著抑制结肠癌细胞LOVO发生细胞凋亡及增殖,还能削弱结肠癌细胞LOVO的克隆形成能力。
关键词:microRNA-132;凋亡;增殖;迁移;克隆形成
MicroRNA-132(miR-132)是高度保守miRNA,其通过转录因子cAMP效应元件结合蛋白,从人类17号染色体上基因间隙区域转录而来[1]。大多数研究表明,miR-132的调节作用和生物学功能来源于神经元[2]。miR-132在炎症、细胞转化和肿瘤生成等病理过程中的作用也被学者们研究证实[3]。有研究指出,不同类型的人类癌症中miR-132表达上调或下调[4]。但是,关于miR-132对结肠癌细胞生物学行为作用的系统研究较为少见。
由于不同结肠癌细胞内源性miR-132表达水平可能存在差异,为排除内源性miR-132对实验的干扰,本研究采用荧光实时定量逆转录酶联免疫反应检测6株结肠癌细胞株(HCT116、HCT8、HT29、LS174T、LOVO及SW480)和HCo EpiC正常结肠细胞株中miR-132的表达。选取内源性miR-132表达水平最低的细胞株作为研究对象,将miR-132mimics转染至该细胞株,建立miR-132过表达结肠癌细胞模型。检测miR-132过表达对结肠癌细胞增殖、凋亡、细胞周期及迁移能力等生物学行为的影响,以期进一步了解miR-132在结肠癌发生、发展中的作用。
1 材料与方法
1.1实时定量聚合酶链反应
实时定量聚合酶链反应(polymerase chain reaction,PCR)检测结肠癌细胞株和正常结肠黏膜上皮细胞株中miR-132的表达。人结肠上皮细胞HCo EpiC、人结肠癌细胞系HCT116、HCT8、HT29、LS174T、LOVO及SW480购自中国科学院上海细胞库,常规培养于含10%小牛血清的无血清细胞冷冻保存(dulbecco modified eagle medium,DMEM)高糖培基中。依照RNA提取试剂盒说明书提取HCT116、HCT8、HT29、LS174T、LOVO、SW480及HCoEpiC细胞中总RNA。紫外分光光度仪测定总RNA浓度与纯度,A260/A280值为1.8~2.0,1%琼脂糖凝获电泳检测质量。分别取HCT116、HCT8、HT29、LS174T、LOVO、SW480及HCo EpiC总RNA各1μg,逆转录酶混合液lμl,5×逆转录酶缓冲液4μl,加无RNA酶水至反应体积为20μl。37℃温浴60 min,95℃、5 min,终止反应。2×PCR预混液25μl,10×通用引物5μl,10×特异引物Assay 5μl(hsa-miR-132引物序列代号为MS00004276,U6引物穿列代号为MS00007497,以U6为内参,德国Qiagen公司提供),cDNA模板2μl,加光RNA酶水定容至总反应体积50μl。反应条件:95℃预变性15 min,94℃变性15 s,55℃退火30 s,70℃延伸34 s,共8个循环。相同条件下实验重复3次。
1.2实验分组
由于miR-132在结肠癌LOVO细胞中的表达最低,因此本研究后续以LOVO细胞为研究对象来探讨miR-132对结肠癌细胞生物学行为的作用。miR-132 mimics购自美国Ambion公司。转染时细胞分为4组:①空白组,不作任何处理,继续常规培养;②阴性对照组,转染时加入无关序列Scramble mimics+脂质体2000;③实验组,转染时加入miR-132 mimics+脂质体2000;④羧基荧光素(Carboxyfluorescein,FAM)对照组,转染时加入FAM-mimics control,该组用来检测转染效率,不再进行后续实验。
1.3细胞克隆形成实验
将空白组、阴性对照组及实验组细胞培养至指数生长期,细胞悬液浓度调整为1×106个/ml,接种至双琼脂平板,待上层琼脂凝固后,常规培养2周。将细胞培养皿放置在倒置显微镜下,观察细胞克隆数,计算形成率。克隆形成率=(克隆数/接种细胞数)×100%。
1.4细胞活力检测
空白组、阴性对照组及实验组细胞培养至指数生长期,以1 000个/孔的密度接种于96孔细胞培养板,设6个平行孔,每孔体积为0.2 ml。分别于1、2、3和4 d各取一块96孔板培养板,超净台内弃去原培养液,加入按9∶1混合的培养液与细胞计数检测(cell counting kit-8,CCK-8)反应液,96孔板继续培养箱内孵育1 h后取出,轻轻震荡10 min,用酶标仪于450 nm处检测各孔吸光度值(optical delnsity,OD值),并按以下公式计算相对细胞增殖率:相对细胞增殖率(%)=(实验孔平均OD值-空白调零平均OD值)/(对照孔平均OD值-空白调零平均OD值)×100%。实验重复3次。
1.5流式细胞仪检测
流式细胞仪检测转染miR-132 mimics对结肠癌LOVO细胞凋亡的影响。各组膜联蛋白V-异硫氰酸酯(annexin V-fluoresceine isothiocyanate,Annexin V-FITC)和碘化丙啶(propidium iodide,PI)双染,同时设置未染色空白对照管、单染Annexin VFTIC管及单染PI管。将环氧树脂(epoxy epoxide,EP)管置于冰上,避光条件下室温静置10 min,加入400μl 1×Binding Buffer,轻轻混匀,并在30 min内进行检测。以未染色空白细胞为基准调零机器,以Annexin V-FITC单染管和PI单染管做为基准参照,测定每个上样EP管的数据。采用Cell Quest 3.0软件进行参数获取和资料分析,计算凋亡细胞百分比。
1.6划痕修复实验
划痕修复实验检测miR-132 mimics对结肠癌LOVO细胞迁移能力的影响。取对数生长期的各组LOVO细胞,消化、计数,以5×105个/ml的密度接种于24孔板中,每孔500μl,培养4 h。待细胞贴壁后用小枪头沿着每孔偏中线两侧划痕,划痕应较直且宽度一致,用磷酸盐缓冲溶液(phosphate buffersaline,PBS)清洗1遍,确保清洗掉痕线上散在的细胞。每组设3个平行孔,加入含2%胎牛血清的DMEM培养液再放入培养箱内培养24、48和72 h,分别于每个时间点观察细胞向中间的迁移情况,并在显微镜下拍照记录。注意每次拍照的位置应固定,且每次拍照前用PBS洗2遍以去除漂浮的死细胞。计算闭合率以反映细胞的迁移能力,闭合率(%)=(迁移距离/划痕距离)×100%。
1.7统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间样本比较用Student’s t检验分析,P<0.05为差异统计学意义。
2 结果
2.1正常结肠细胞和结肠癌细胞中miR-132的表达
miR-132在结肠癌细胞中的表达与其在结肠癌组织中的表达基本一致,正常结肠细胞HCo EpiC中miR-132呈高表达,而6种结肠癌细胞株中miR-132表达被不同程度地抑制(见图1)。其中LOVO细胞中内源性miR-132表达水平最低。

图1 正常结肠细胞和结肠癌细胞中miR-132的表达(P=0.014)。见图3。
2.2miR-132对LOVO细胞克隆形成的作用
用miR-132 imimics(实验组)转染LOVO细胞,使其过表达miR-132,与阴性对照组(Scramble mimics组)和空白组比较,实验组克隆数明显下降,差异有统计学意义(P=0.032),而阴性对照组和空白组的克隆数比较差异无统计学意义。见图2。

图2 3组克隆数比较
2.3MiR-132对LOVO细胞增殖能力的作用
本实验采用CCK-8法绘制LOVO细胞系生长曲线,结果显示,LOVO细胞转染miR-132 mimics 72 h后,细胞增殖能力逐渐下降。实验组细胞72、96 和120 h增殖能力明显低于阴性对照组和空白组

图3 miR-132 mimics对LOVO细胞生长能力的抑制作用
2.4miR-132对LOVO细胞凋亡的作用
流式细胞仪检测细胞凋亡,结果显示,空白组、阴性对照组及实验组的凋亡率分别为(2.94±0.81)%、(3.02±1.12)%和(15.04±1.52)%。空白组与阴性对照组比较,差异无统计学意义(P=0.684);实验组和空白组比较,差异有统计学意义(P=0.003)。提示miR-132可促进LOVO细胞凋亡。见图4。
2.5miR-132对结肠癌LOVO细胞迁移能力的作用
分别于24、48和72 h观察各组细胞的划痕修复。实验组LOVO细胞迁移能力被抑制,48 h后各组迁移能力明显受到抑制,差异有统计学意义(P= 0.037)。见附表。


图4 流式细胞术检测3组细胞的凋亡率
附表 3组细胞在不同时间的闭合率比较(%,±s)
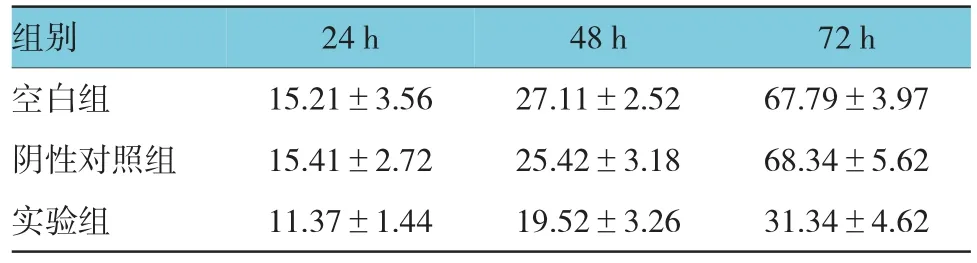
附表 3组细胞在不同时间的闭合率比较(%,±s)
组别 24 h 48 h 72 h空白组 15.21±3.56 27.11±2.52 67.79±3.97阴性对照组 15.41±2.72 25.42±3.18 68.34±5.62实验组 11.37±1.44 19.52±3.26 31.34±4.62
3 讨论
miRNA是包含19~25个碱基的小分子非编码RNAs,能够通过与靶基因mRNAs的3’-非翻译区(3’-untranslated regions,3’-UTRs)反应,反向调控靶基因表达。研究证实,miR-132具有调控多巴胺神经元分化,激活内皮细胞,发挥病理血管生成的作用[5]。还有研究表明,miR-132参与胰腺癌的发展过程[6]。
近年来,关于miR-132对肿瘤细胞生物学行为的作用的研究成果层出不穷,但是这些结果多有矛盾之处。You等[7]研究表明,miR-132在非小细胞肺癌和非小细胞肺癌组织标本中显著下降,且恢复非小细胞肺癌细胞株中的表达,能够抑制miR-132迁移和侵袭。Zhang[8]等研究发现,miR-132能够抑制乳腺癌细胞的增殖、分化和转移等。Luo等[9]研究发现,miR-132/212簇能显著抑制肺癌细胞株H1299在裸鼠皮下的成瘤能力。而Park等[10]在胰腺癌中的研究发现,miR-132在胰腺癌组织中表达增加,抑制胰腺癌细胞株中miR-132表达导致胰腺癌细胞凋亡加快,侵袭和迁移能力显著下降。本研究结果表明,恢复结肠癌细胞中MiR-132的表达,能显著抑制结肠癌细胞恶性表型。MiR-132在不同肿瘤中发挥相反作用的原因目前仍不清楚,结合以往研究结果,本实验推测其主要原因为:①肿瘤的异质性。不同肿瘤组织间的异质性,以及同类肿瘤组织中的异质性都可能导致miR-132作用的差异;②肿瘤来源不同,导致miR-132的作用也不尽相同。有的肿瘤源自内皮细胞,有的源自上皮细胞,而结肠癌细胞主要源自结肠星状细胞;③不同肿瘤组织中靶基因表达丰度不同也导致miR-132作用差异。众所周知,miRNA主要通过靶基因发挥作用,而且一种miRNA可能存在多种靶基因,而不同肿瘤组织中靶基因表达丰度不同,导致miR-132作用的靶基因也不一致,从而引起miR-132表达作用不同。
本研究发现,结肠癌LOVO细胞稳定过表达miR-132 mimics后,细胞增殖能力、体外细胞克隆形成率、抗凋亡能力、体内致瘤能力明显下降,结果提示,结肠癌细胞的恶性表型与miR-132表达缺失有关。miR-132是结肠癌治疗的潜在有效靶点。国内学者李书军等[11]也做过类似的研究工作,探讨miR-132对食管癌KYSE150细胞肿瘤调节因子FOXA1及mRNA表达的调节作用对食管癌KYSE150细胞增殖的影响,结果表明,过表达的miR-132能抑制KYSE150食管癌细胞增殖,该抑制作用至少部分与FOXA1基因的低表达有关。管娣等[12]试图识别和发现肿瘤转移相关miRNA,以期能够作为治疗靶点高效抑制肿瘤转移,其为验证miR-132与肿瘤迁移的相关性,将miR-132转染入高迁移乳腺癌细胞系MDA-MB-231细胞中,检测细胞迁移率的变化,结果发现miR-132能够抑制MDA-MB-231细胞的迁移。管娣等[12]为进一步揭示miR-132抑制细胞迁移的可能机制,通过生物信息学手段寻找并鉴定3种可能与肿瘤转移相关的miR-132的靶基因,其分别是STIP1同源性和含U框蛋白1(STIP1 homologous and U box containing protein1,STUB 1)、GTP酶激活蛋白-Src同源结构域3-结合蛋白1[GTPase activating protein-(Src homology domain 3)-bindingprotein 1, G3BP1]、GTP酶激活蛋白-Src同源结构域3-结合蛋白2[GTPase activating protein-(Src-homology domain 3)-binding protein 2, G3BP2]。管娣等[12]分别比较MCF7与MDA-MB-231细胞,以及转染miR-132和阴性对照组MDA-MB-231细胞3种基因的表达差异,结果发现,G3BP1、G3BP2可能参与miR-132对肿瘤转移的调控,与本研究结果类似。
总之,结合以往和本研究结果,miR-132有望成为结肠癌肿瘤基因治疗的潜在高效靶点。
参考文献:
[1] Kano M, Seki N, Kikkawa N, et al.MiR-145, miR-133a and miR-132b: tumor suppressive miRNAs target FSCN1in esophageal squamous cell carcinoma[J].Int J Cancer, 2010, 127(12): 2804-2814.
[2] Luikart BW, BensenN AL, Washburn EK, et al.MiR-132 mediates the integration of newborn neurons into the adult dentate gyrus[J].PLoS One, 2011, 6(5): DOI: 10.1371/journal.pone.0019077.
[3] Yang D, Li T, Wang Y, et al.MiR-132 regulates the differentiation of dopamine neurons by directly targeting Nurr1 expression[J].J Cell Sci, 2012, 125(7): 1673-1682.
[4] Hwang JY, Kaneko N, Noh KM, et al.The gene silencing transcription factor REST represses miR-132 expression in hippocampal neurons destined to die[J].J Mol Biol, 2014, 426(9): 3454-3466.
[5] TogniniI P, Pizzorusso T.MicroRNA212/132 family: molecular transducer of neuronal function and plasticity[J].The J Biochem Cell Biol, 2012, 44(1): 6-10.
[6] Formosa A, Lena AM, Markert EK, et al.DNA methylation silences miR-132 in prostate cancer[J].Oncogene, 2013, 32 (1): 127-134.
[7] You J, Li Y, Fang N, et al.MiR-132 Suppresses the migration and invasion of lung cancer cells via targeting the EMT regulator ZEB2[J].PLos One, 2014, 9(3): DOI: 10.1371/journal.pone.0091827.
[8] Zhang ZG, Chen WX, Wu YH, et al.MiR-132 prohibits proliferation, invasion, migration, and metastasis in breast cancer by targeting HN1[J].Biochem Biophys Res Commun, 2014, 454(4): 109-114.
[9] LuoO JD, Meng CC, Tang YT, et al.MiR-132/212 cluster inhibits the growth of lung cancer xenografts in nude mice[J].International Journal of Clinical and Experimental Medicine, 2014, 7(11): 4115-4122.
[10] Park JK, Henry JC, Jiang JM, et al.MiR-132 and miR-212 are increased in pancreatic cancer and target the retinoblastoma tumor suppressor[J].Biochem Biophys Res Commun, 2011, 406(4): 518-523.
[11]李书军,张秀金,侯俊峰,等.Hsa-miR-132通过靶向FOXA1基因影响食管癌细胞的增殖和侵袭[J].中国肿瘤生物治疗杂志,2011, 18: 485-489.
[12]管娣,刘春颖,陈晨等.MiR-132抑制肿瘤转移[J].生物化学与生物物理进展, 2013, 12(2): 159-164.
(童颖丹编辑)
Eeffect of miR-132 on biological characteristics of colon cancer cells
Ji-ming Zhao, Jian Peng
(Xiangya Hospital, Central South University, Changsha, Hunan 410008, China)
Abstract:Objective To investigate the effect of miR-132 on biological characteristics of conlon cancer LOVO cell line.Methods Synthetic miR-132 mimics and miRNAs cramble were transfected into LOVO cells using Lipofectamine 2000.Transwell assay was used to assess the effect of miR-132 on LOVO cell invasion and metastasis.CCK-8 assay was used to assess the effect of miR-132 on LOVO cell proliferation.Flow cytometry was used to assess the effect of miR-132 on LOVO apoptosis.Results Over-expression of miR-132 induced LOVO cell apoptosis, and subsequently inhibited LOVO cell growth and colony formation.Notably, 50 nmol/L miR-132 mimic demonstrated a potent inhibitory effect at 72 h after transfection and reduced cell viability by 30%.The colony formation ability was impared after miR-132 mimic treatment with a 14% drop of in vitro colony formation rate.Also, miR-132 inhibited the LOVO cell migration.Conclusions miR-132 could suppress colon cancer cell growth through induction of cell apoptosis.
Keywords:miR-132; apoptosis; proliferation; migration; colony formation
[通信作者]彭健,E-mail:pengjian1698@aliyun.com
收稿日期:2015-10-16
文章编号:1005-8982(2016)01-0030-05
中图分类号:R735.35
文献标识码:A
