蟾蜍灵在体内外抑制急性红白血病细胞K562增殖及下调WT1表达的研究
2016-03-24汪丽佩李天一高瑞兰杜月光赵燕娜
汪丽佩,李天一,高瑞兰,杜月光,赵燕娜
(1.浙江中医药大学基础医学院病理学教研室,浙江 杭州 310053;2.浙江中医药大学附属第一医院血液病研究所,浙江 杭州 310006)
蟾蜍灵在体内外抑制急性红白血病细胞K562增殖及下调WT1表达的研究
汪丽佩1,李天一1,高瑞兰2,杜月光1,赵燕娜2
(1.浙江中医药大学基础医学院病理学教研室,浙江 杭州310053;2.浙江中医药大学附属第一医院血液病研究所,浙江 杭州310006)
中国图书分类号:R-332;R282.74;R329.24;R329.28;R733.730.22;R979.1
摘要:目的研究蟾蜍灵在体内外抗K562细胞增殖及对WT1表达影响。方法半固体集落形成实验检测蟾蜍灵对K562细胞的增殖抑制作用,流式细胞术分析蟾蜍灵对K562细胞周期的影响,Western blot观察蟾蜍灵对WT1表达作用。通过高致瘤性K562细胞制备裸鼠皮下荷瘤模型,分组为模型组、蟾蜍灵组及高三尖杉酯碱组,比较各组皮下瘤体积与重量、病理形态学改变及WT1蛋白表达情况。结果① 半固体集落形成实验、流式及Western blot结果显示,蟾蜍灵能明显抑制K562细胞增殖,阻滞细胞在G0/G1期,并下调其WT1蛋白表达,呈剂量依赖性;② 蟾蜍灵组和阳性对照组裸鼠肿瘤的抑瘤率均明显高于模型组(P<0.05),且蟾蜍灵组和阳性对照组裸鼠皮下瘤重量均明显低于模型组(P<0.05);③ 病理切片显示,蟾蜍灵导致K562皮下瘤组织内肿瘤细胞大量坏死、凋亡,继发出血及纤维化等改变;并明显抑制K562皮下瘤组织中WT1蛋白表达水平。结论蟾蜍灵在体外可抑制K562细胞增殖及阻滞细胞周期于G0/G1期,并下调其WT1蛋白表达,在体内可明显抑制裸鼠K562皮下瘤体积和重量,导致皮下瘤组织坏死、凋亡,并可下调其WT1蛋白的表达。
关键词:蟾蜍灵;WT1;K562;细胞周期;G0/G1期;皮下瘤
蟾蜍灵(bufalin)作为传统中药蟾酥成分中的蟾毒配基之一,在体外能抑制多种肿瘤细胞生长,并能诱导多种白血病细胞分化[1]。Numazawa等[2]研究表明,蟾蜍灵以剂量依赖方式抑制白血病细胞生长,但相关机制报道较少。我们以急性红白血病细胞株K562为研究对象,体内外观察蟾蜍灵单体对K562细胞的作用及其对癌基因WT1蛋白表达的影响,从而为蟾蜍灵进一步应用于白血病治疗提供理论依据。
1材料与方法
1.1细胞株与试剂K562细胞株为本实验室保存。蟾蜍灵、琼脂粉及细胞周期试剂盒购自美国Sigma公司,高三尖杉酯碱购自北京协和药厂,DMEM培养基购自美国Gibco公司,新生牛血清购自杭州四季青生物工程材料研究所,无菌注射用水购自平湖沙普爱思制药公司,WT1抗体、羊抗兔多克隆抗体购自美国Cell Signaling Technology公司。
1.2实验方法
1.2.1K562细胞株培养在37℃、5% CO2饱和湿度培养箱中用DMEM培养液(含10%新生牛血清)培养,选取对数生长期细胞进行后续实验。
1.2.2半固体集落形成实验培养体系含30%小牛血清、1×105U·L-1青链霉素、300 mg·L-1L-谷氨酰胺及含0.3%琼脂的IMDM培养基,接种2×106·L-1细胞。以上体系中分别加入终浓度为0、0.01、0.05、0.1和0.5 μmol·L-1的不同浓度蟾蜍灵,每组设置3个复孔。置于37℃、5% CO2饱和湿度下培养5 d,倒置显微镜下计数≥50个细胞组成为1个集落。以蟾蜍灵浓度为横坐标,集落抑制率为纵坐标绘制生长曲线,同样的实验重复10次。集落抑制率/%=(对照组集落数-实验组集落数)/对照组集落数×100%。
1.2.3流式细胞术检测细胞周期各组分别取2×105个细胞,冷PBS洗涤1次,离心去上清,加入0.5 mL含PI和RNAase A的DNA染液,室温避光孵育30 min,流式细胞仪分析白血病细胞DNA含量。以PI荧光强度为横坐标,以细胞数量为纵坐标绘制曲线图,调整G0/G1期、S期和G2/M期细胞位置,排除黏连细胞后,分析目的细胞DNA表达情况。使用multicycle 软件分析,并计算亚二倍体峰的百分率,同时计算细胞增殖指数=(S+G2/M)/(G0/G1+S+G2/M)。同样的实验重复5次。
1.2.4Western blot法检测K562 细胞内WT1蛋白表达收集各组细胞,提取40 μg总蛋白,分别混合上样缓冲液,100℃加热5 min后通过10% SDS-PAGE胶分离,并转膜到PVDF膜上,1% BSA封闭后,WT1一抗4℃孵育过夜,二抗孵育2 h后,ECL显影,以β-actin为内参,每组实验重复3 次。
1.2.5高致瘤性K562细胞的制备及皮下荷瘤裸鼠模型的建立和分组取5×107/0.2 mL的对数生长期K562细胞悬液注入4~5周龄裸鼠前肢腋下外侧皮下,成瘤2周后处死裸鼠,无菌条件下取瘤块,杵状玻璃匀浆器匀碎瘤组织,并用100目孔径的不锈钢网过滤后,制成单细胞悬液,接种于100 mL培养瓶,传代10~15代,即获得高致瘤性K562细胞。将处于对数生长期的高致瘤K562细胞1×107/0.2 mL接种于4~5周龄免疫缺陷裸鼠前肢腋下外侧皮下,并随机分成3组,每组10只:① 模型组用生理盐水0.2 mL·d-1灌胃21 d;② 蟾蜍灵组1.5 mg·kg-1·d-1灌胃21 d;③ 阳性对照组高三尖杉酯碱(Hom)1 mg·kg-1·d-1腹腔注射治疗3 d。
1.2.6皮下瘤体积与重量检测治疗21 d,颈椎脱臼法处死裸鼠,用游标卡尺测量各组裸鼠瘤体最长径(a)、最短径(b)并称重,得到裸鼠皮下瘤体积V(mm3)=ab2/2,计算抑瘤率。抑瘤率计算公式:抑瘤率/%=(1-治疗组瘤体体积/对照组瘤体体积)×100%。
1.2.7肿瘤组织切片及HE染色各组裸鼠处死取瘤组织,固定后包埋、切片,进行HE染色,并在显微镜下观察瘤组织病理情况。
1.2.8免疫组化法检测肿瘤组织中WT1蛋白表达情况取上述病理石蜡切片,用1 ∶500稀释的WT1一抗及Envision加强型二抗工作液孵育后,DAB显色,以出现棕黄色颗粒为阳性显色,并用苏木精复染,光学显微镜下观察记录结果。
2结果
2.1蟾蜍灵抑制K562细胞集落生成处理K562细胞5 d后,蟾蜍灵0、0.01、0.05、0.1和0.5 μmol·L-1处理后的增殖抑制率分别为0、(21.31±2.53)%、(59.28±4.21)%、(70.53±5.10)%及(81.52±6.18)%,提示随着蟾蜍灵剂量增加,K562细胞集落生成数量明显降低(P<0.05),呈剂量依赖性(Fig 1)。
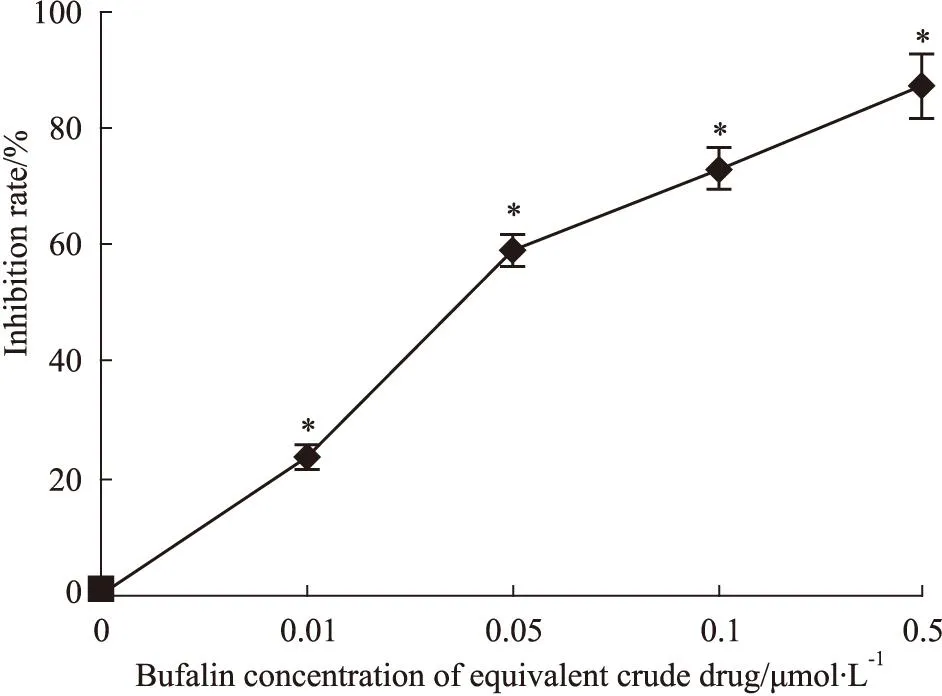
Fig 1 Bufalin inhibits colon number of K562 cell
**P<0.05vsthe untreated control
2.2蟾蜍灵阻滞K562细胞周期随着蟾蜍灵药物浓度增加,K562细胞处于G0/G1期的比例从(32.53±0.31)%逐渐升高到(58.97±2.61)%,而S期的比例则从(51.46±0.27)%逐渐降低到(30.72±1.53)%,K562细胞增殖指数从(62.27±0.51)%明显下降到(40.61±2.01)%(P<0.05,P<0.01),提示蟾蜍灵能够有效地阻滞K562细胞进入增殖周期S期,而停滞于G0/G1期(Tab 1、Fig 2)。
2.3蟾蜍灵抑制K562细胞中WT1表达K562细胞经不同浓度蟾蜍灵处理5 d后,Western blot结果显示,随着蟾蜍灵剂量增加,K562细胞中WT1蛋白表达明显下降,呈剂量依赖性(Fig 3)。
2.4蟾蜍灵在裸鼠体内抑制K562皮下瘤重量和体积裸鼠接种K562细胞株后,皮下成瘤时间平均为5~10 d,移植后d 10所有裸鼠瘤块都明显可见,达到成瘤标准,d 21时处死裸鼠并取皮下瘤,游标卡尺测量瘤体体积及称重。结果显示,蟾蜍灵组和阳性对照组裸鼠皮下瘤重量和体积均明显低于模型组(P<0.05),其抑瘤率则明显高于模型组(Tab 2)。
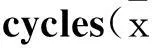
Tab 1 Effects of bufalin on K562 cell ±s,n=5)
**P<0.05,**P<0.01vsthe untreated control
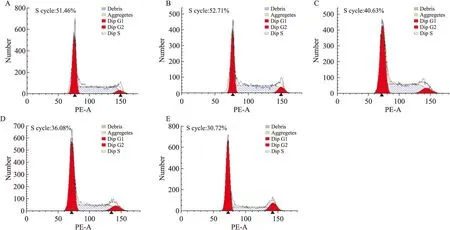
Fig 2Bufalin arrests cell cycle of
K562 cell(n=5)
A:0 μmol·L-1bufalin; B: 0.01 μmol·L-1bufalin; C:0.05 μmol·L-1bufalin; D:0.1 μmol·L-1bufalin; E:0.5 μmol·L-1bufalin
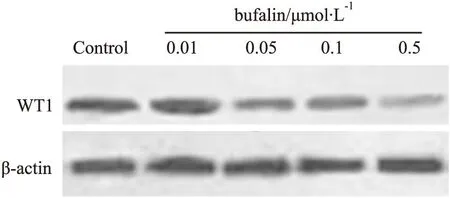
Fig 3 Expression of WT1 in K562 cells analyzed by Western blot

Tab 2 Effect of bufalin on nude mice
**P<0.05,**P<0.01vsmodel group
2.5蟾蜍灵诱导裸鼠皮下瘤坏死凋亡病理切片观察各组裸鼠皮下瘤组织,低倍镜及高倍镜下均可见模型组瘤组织白血病细胞密集,数量多且生长旺盛,细胞异型性明显,细胞核体积大,染色细腻,核质比明显增加,并常见病理性核分裂像;蟾蜍灵组皮下瘤组织中出现不同程度的细胞坏死或凋亡,其中核固缩、核碎裂及核溶解现象明显,细胞排列紊乱,结构不清,并伴随出血、间质纤维化等改变;而阳性对照组皮下瘤组织亦发生了变性和坏死现象,与蟾蜍灵组相类似(Fig 4、5)。
2.6蟾蜍灵下调裸鼠皮下瘤组织中WT1蛋白表达各组裸鼠皮下瘤组织切片通过免疫组化染色,观察瘤组织中WT1蛋白表达水平。结果显示,模型组瘤组织WT1蛋白表达呈强阳性,镜下显示所有肿瘤细胞胞质内密集大量棕黄色阳性物质,瘤细胞均出现强阳性反应“”,提示WT1蛋白在模型组中呈高表达状态;蟾蜍灵组皮下瘤组织在镜下可见肿瘤细胞内WT1蛋白阳性表达率降低,数量明显减少,其胞质内棕黄色颗粒样物质亦减少,而肿瘤细胞坏死、凋亡现象多见,呈现弱阳性“+”,提示WT1蛋白在蟾蜍灵组皮下瘤组织中表达明显降低;阳性对照组皮下瘤组织在镜下可见大多数肿瘤细胞坏死、凋亡,细胞排列紊乱,结构不清,WT1蛋白阳性表达的肿瘤细胞少见,肿瘤细胞胞质内少见棕黄色颗粒,大多数细胞WT1表达水平很低,为“±”,提示高三尖杉酯碱亦可下调WT1蛋白的表达(Fig 6、7)。
3讨论
白血病作为一种临床常见恶性肿瘤,占所有恶性肿瘤总发病率的5%左右,随着环境污染等原因,近年来发病率不断攀升[3]。现阶段白血病尤其是急性白血病的治疗仍以化疗为主,但是当前临床常用的化疗药物存在不同程度毒副作用,例如目前常用的高三尖杉酯碱对缓解及治疗白血病效果明显,但其对心血管系统尤其是心肌的毒性作用仍不容忽视[4]。中药治疗肿瘤因其生物活性广泛、作用缓和,并具有提高机体免疫力、调节内分泌功能、不易导致耐药及骨髓抑制,且服用方便经济等独特优点,日益引起国内外学者的广泛关注[5]。本实验发现蟾蜍灵在体内外均可明显抑制白血病细胞K562增殖,并可下调白血病特异性癌基因WT1蛋白表达,效果与化疗药物相当。

Fig 4 Effect of bufalin on morphology of K562 subcutaneous tumor in nude mice(100×)

Fig 5 Effect of bufalin on morphology of K562 subcutaneous tumor in nude mice(400×)

Fig 6 Expressions of WT1 in K562 subcutaneous tumor of nude mice detected by cell immunochemistry(100×)
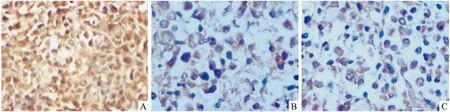
Fig 7 Expressions of WT1 in K562 subcutaneous tumor of nude mice detected by cell immunochemistry(400×)
WT1基因作为一种参与转录调控的双相调节子,是细胞生长、发育过程中的重要调控分子,因发现最初可导致儿童肾母细胞瘤(Wilms′tumor-1)而得名[6]。近年来,在白血病细胞的研究中发现WT1基因参与造血调控,与多种造血生长因子相互作用调节基因的转录速度,进而参与造血细胞增殖、分化、凋亡等各个过程。正常人外周血细胞中WT1基因表达很低或无表达,而在多种白血病细胞株及约80%左右白血病患者中,该基因存在过度表达现象,发挥着癌基因的作用。如将这些白血病患者按照FAB分型,则其中分化类型较好的患者外周血中WT1基因表达阳性率明显低于分化类型相对较差的患者,且随着病情的恶化其表达相应逐渐增高,与预后不良正相关。因此,临床上可用于白血病预后的判断和微小残留白血病(minimal residual disease, MRD)的监测[7],未来可能成为白血病基因治疗和特异性免疫治疗的新靶点。有研究显示,在体外抑制白血病细胞增殖的同时,常可出现WT1基因表达下降[8],推测通过下调WT1表达可能抑制白血病细胞增殖并阻滞其细胞周期,与本文得到结果一致,但其中具体分子机制不详,仍有待后续的进一步研究。
(致谢:本实验工作主要在浙江省中西医结合血液病研究所、国家中医药管理局“血液细胞分子生物学”三级实验室及浙江中医药大学基础医学院形态研究所的大力支持下完成,在此予以感谢!)
参考文献:
[1]Zhang L, Nakaya K, Yoshida T, et al. Induction of bufalin of differentiation of human leukemia cells HL-60, U937, and ML1 toward macrophage/monocyte-like cells and its potent synergistic effect on the differentiation of human leukemia cells in combination with other inducers[J].CancerRes, 1992,52: 4634-42.
[2]Numazawa S, Honma Y, Yamamoto T, et al. A cardiotonic steroid bufalin-like factor in human plasma induces leukemia cell differentiation[J].LeukRes, 1995, 19(12): 945-53.
[3]Krille L, Dreger S, Schindel R, et al. Risk of cancer incidence before the age of 15 years after exposure to ionising radiation from computed tomography: results from a German cohort study[J].RadiatEnvironBiophys, 2015, 54(1):1-12.
[4]刘志刚. 高三尖杉酯碱联合方案治疗高白细胞慢性粒细胞白血病疗效分析[J]. 华西医学, 2010, 25(8): 2421-2.
[4]Liu Z G. Curative effect of homoharringtonine united program on patients with chronic myelocytic leukemia[J].WestChinaMedJ, 2010, 25(8): 2421-2.
[5]赵燕娜,高瑞兰,汪丽佩,等. 白藜芦醇对K562白血病细胞抑制增殖和诱导分化的作用[J].中国药理学通报, 2014, 30(6): 853-6.
[5]Zhao Y N, Gao R L, Wang L P, et al. Effect of resveratrol on proliferation and differentiation in K562 cells[J].ChinPharmacolBull, 2014, 30(6): 853-6.
[6]Tian F, Yourek G, Shi X, et al. The development of Wilms tumor: from WT1 and microRNA to animal models[J].BiochimBiophysActa, 2014, 1846(1):180-7.
[7]Steinbach D, Bader P, Willasch A, et al. Prospective validation of a new method of monitoring minimal residual disease in childhood acute myeloid leukemia[J].ClinCancerRes, 2015, 21(6):1353-9.
[8]Li Y, Wang J, Li X, et al. Role of the Wilms' tumor 1 gene in the aberrant biological behavior of leukemic cells and the related mechanisms[J].OncolRep, 2014, 32(6):2680-6.
Bufalin inhibits proliferation and downregulates expression of WT1 in K562 cellsinvivoandvitro
WANG Li-pei1, LI Tian-yi1, GAO Rui-lan2, DU Yue-guang1, ZHAO Yan-na2
(1.DeptofPathology,CollegeofBasicMedicalSciences,ZhejiangChineseMedicalUniversity,Hangzhou310053,China;2.ResearchInstituteofHematology,theFirstAffiliatedHospital,ZhejiangChineseMedicalUniversity,Hangzhou310006,China)
Abstract:AimTo investigate the effect of bufalin on proliferation and expression of WT1 in K562 cells.MethodsThe colony number of K562 cell was detected with semi-solid culture assay. The cell cycle was measured by flowcytometry, and the expression of WT1 was observed with immunocytochemistry. Subcutaneous tumor models established by K562 cells in BALB/C nu/nu mice were divided into three groups, including model group, bufalin group and positive control group. After 21 days, the subcutaneous tumors were removed for calculating the inhibitory rate of tumor growth. HE staining and immunohistochemistry were used to observe the morphological changes and the expression of WT1.Results① Bufalin could significantly decrease the colony number of K562 cell, arrest it at G0/G1phase and down-regulate its expression of WT1 in a dose-dependent manner. ② Compared with the model group, the tumor inhibitory rate was much higher, while the volume and the weight were obviously lower in the other two groups. ③ Bufalin could induce apoptosis, necrosis, hemorrhage and fibrosis with HE staining, and down-regulate the expression of WT1.ConclusionBufalin could inhibit the proliferation, arrest the cell cycle at G0/G1phase and down-regulate the expression of WT1 in vitro. Bufalin could inhibit the tumor inhibitory rate, the volume and the weight of the subcutaneous tumors, induce apoptosis, necrosis, hemorrhage and fibrosis with HE staining and down-regulate the expression of WT1.
Key words:bufalin; WT1; K562; cell cycle; G0/G1phase; subcutaneous tumor
文献标志码:A
文章编号:1001-1978(2016)02-0229-05
doi:10.3969/j.issn.1001-1978.2016.02.016
作者简介:汪丽佩(1983-),女,博士,讲师,研究方向:中西医结合治疗血液病,E-mail:wanglipei@gmail.com;赵燕娜(1984-),女,硕士,助理研究员,研究方向:中西医结合治疗血液病,通讯作者,E-mail:zyn77@126.com
基金项目:国家自然科学基金资助项目(No 81403223);浙江省自然科学基金项目(No LQ14H290003);浙江省医药卫生科技计划项目(No 2014KYA151)
收稿日期:2015-10-26,修回日期:2015-11-30
网络出版时间:http://www.cnki.net/kcms/detail/34.1086.R.20160125.1557.032.html网络出版地址:2016-1-25 15:57
