产5α羟化紫杉二烯醇人工酵母的组合设计构建
2016-03-19翟芳宋田青肖文海丁明珠乔建军元英进
翟芳,宋田青,肖文海,丁明珠,乔建军,元英进
(系统生物工程教育部重点实验室,天津大学化工学院制药工程系,天津化学化工协同创新中心,天津 300072)
产5α羟化紫杉二烯醇人工酵母的组合设计构建
翟芳,宋田青,肖文海,丁明珠,乔建军,元英进
(系统生物工程教育部重点实验室,天津大学化工学院制药工程系,天津化学化工协同创新中心,天津 300072)
摘要:利用工程化微生物生产天然药物如紫杉醇在近年来受到研究者广泛关注。本工作研究如何设计和构建人工酵母以生产紫杉醇生物合成途径中第一个由细胞色素P450酶催化的羟化产物——5α羟化紫杉二烯醇(taxadien-5α-ol)。利用组合设计原理,选用3种不同红豆杉来源的紫杉二烯5α羟化酶和2种不同植物源的细胞色素P450还原酶,分别对其进行N端穿膜区域的预测和截短,并对还原酶使用2种不同强度启动子进行调控,所得羟化酶模块和还原酶模块之间分别表达共产生72种组合方式。然后将其分别整合入紫杉二烯生产菌株基因组中,最终在72个组合中筛选到48个可以生产5α羟化紫杉二烯醇的菌株,最高产量67.3 μg·L-1,在酿酒酵母中实现紫杉二烯C5位羟化产物的从头合成。研究结果表明,利用组合设计策略研究模块间相互作用及其与底盘间适配性将为在微生物细胞中实现细胞色素P450酶系介导的催化反应过程提供重要参考。
关键词:合成生物学;5α羟化紫杉二烯醇;组合设计;酿酒酵母;生物催化;发酵
2015-06-26收到初稿,2015-08-10收到修改稿。
联系人:肖文海。第一作者:翟芳(1990—),女,硕士研究生。
Received date: 2015-06-26.
引 言
近年来利用合成生物学构建工程化人工细胞成为生产稀缺植物源的具有复杂结构及独特性质的化合物的重要手段。研究者通过对已有的生物系统进行改造、设计并构建全新的功能模块,进行天然化合物的异源生物合成和生产[1],目前已在很多研究方向取得突破性进展[2-15]。Keasling等[2-5]通过系统的模块化构建及合成路径调控成为抗疟疾药物青蒿素前体生产研究的典范;Ajikumar等[11]开发利用多元模块代谢工程方法(multivariate-modular approach),使紫杉醇前体紫杉二烯在大肠杆菌中的产量提高了15000倍。
在紫杉醇的生物合成途径中,5α羟化紫杉二烯醇是紫杉醇母核紫杉二烯下游第一个由细胞色素P450酶催化的羟化产物[16]。该过程是在紫杉二烯5α羟化酶(taxadiene 5α-hydroxylase,T5αOH)和细胞色素P450还原酶(cytochrome P450 reductase,CPR)的共同作用下,催化底物紫杉二烯C5位双键发生迁移并同时引入羟基而完成。随后5α羟化紫杉二烯醇在酰基转移酶的作用下乙酰化,再在10β、13α、7β、2α羟化酶的作用下依次进行羟化[9,17]。DeJong 等[14]在酿酒酵母细胞中成功表达了5α羟化酶(T5αOH),5α酰基转移酶(TAT)和10β羟化酶(T10βOH),并且完成了这些酶类的表征,但没有实现从IPP到taxdiene-5α-acetate-10β-ol生物合成路径的表达;Ajikumar等[11]在高产紫杉二烯的研究基础上,利用穿膜工程在大肠杆菌中融合表达T5αOH和细胞色素P450还原酶,实现5α羟化紫杉二烯醇产量达到58 mg·L-1;最近,Zhou等[15]利用微生物混合培养策略,在大肠杆菌与酿酒酵母中对紫杉醇前体生物合成路径进行分工,在共培养条件下成功实现氧化紫杉烷化合物的生物合成,其产量达到33 mg·L-1。
目前的研究对细胞色素P450酶催化系统中氧化酶(CYP)和还原酶主要采用分别表达和融合表达两种方式。分别表达的方式可以实现对氧化酶和还原酶表达强度的分别调控,从而使两者在转录和表达水平上达到协调和相互适配[5];而融合表达策略能够缩短氧化酶和还原酶的空间距离,从而在一定程度上促进氧化还原电子传递反应的高效进行[11]。然而,细胞色素P450酶系介导的生物催化反应过程由于机理较为复杂[17-19],因而如何更有效地选择氧化酶和还原酶的表达方式和后续优化仍是现阶段研究者所面临的一个难题。
为了解决在酿酒酵母中P450催化5α羟化紫杉二烯醇生物合成这一难题,同时为了对羟化酶和还原酶的表达进行精确调控,本研究将利用组合设计原理,选取3种不同来源的紫杉二烯5α羟化酶和2种不同来源的细胞色素P450还原酶,对其进行跨膜区域不同长度截短,并采用分别表达方式,使用不同强度启动子进行调控,并将所得羟化酶模块和还原酶模块进行组合,以酿酒酵母紫杉二烯生产菌为出发菌株,对上述功能模块进行基因组特定位点整合,以筛选得到最佳适配的5α羟化紫杉二烯醇生产菌株。本研究以真核细胞酿酒酵母为底盘,相比于原核系统,酿酒酵母具备完整的内膜系统以及与植物细胞类似的电子传递系统,是适合作为包含细胞色素P450酶反应过程的复杂天然产物异源合成的宿主平台;将5α羟化紫杉二烯醇与紫杉二烯生物合成路径进行整合,能够避免采用混菌培养系统可能存在的竞争等诸多复杂相互作用关系,同时这也符合后续潜在工业发酵应用对单菌培养偏好的要求;组合设计原理的应用与基因组整合相结合,在基因表达水平上进行微调,有助于实现最佳羟化酶和还原酶的高效筛选和代谢通路优化,可为后续紫杉醇前体生物合成的研究奠定基础。该研究对构建其他天然化合物的生物合成途径或由细胞色素P450酶系介导的催化反应过程提供重要的参考。
1 实验材料和方法
1.1 基因元件载体和基因表达盒的构建
设计特异性引物,以酿酒酵母单敲菌株YNL280C (erg24Δ::kanMX4)(购自Open Biosystems ,Huntsville,AL)的基因组为模板扩增得到KanMX基因的上游部分片段kmx1、组氨酸营养标记基因his3和终止子eno2t,通过重叠延伸PCR(OE-PCR)将3个片段连接,用限制性内切酶Pst I/Bam HI酶切,酶切产物经纯化后连接到载体pRS425K[20]的相应位点,得到元件载体pRS425K-kmx1-his3-eno2t。用相同的方法构建载体pRS425K-eno2t-tef1p-gpm1t、pRS425K-gpm1t-pgi1p-gpdt-kmx2和pRS425K-gpm1t-tdh3pgpdt-kmx2,且其中启动子和第二个终止子之间留有Pme I酶切位点,用于紫杉二烯5α羟化酶或还原酶基因的连接,图1(a)所示为以zf11为例,说明元件载体的构建过程。

图1 基因表达盒zf11-T5αOH的构建过程Fig.1 Construction of gene cassette zf11-T5αOH
紫杉二烯5α羟化酶基因Tw5αOH(Taxus wallichiana var. chinensis)、Tm5αOH(Taxus x media)、Tc5αOH(Taxus cuspidata)和P450还原酶基因TcCPR (Taxus cuspidata)、AtCPR(Arabidopsis thaliana)均由金唯智公司依照酿酒酵母密码子偏好性对序列进行优化后合成。在http://www.cbs.dtu.dk/services/ TMHMM/网站中预测上述基因的穿膜区域。设计特异性引物,扩增不同长度基因片段,用CPEC方法[21]将基因片段分别连入相应的元件载体中得到完整的基因表达盒[图1(b)]。所有模块均经过测序验证碱基序列的正确性。表1所示为本实验所构建的质粒。

表1 实验中涉及的质粒Table 1 Plasmids involved in this study
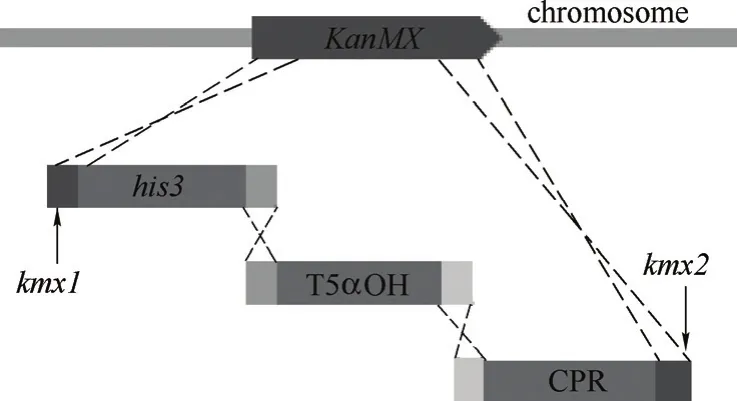
图2 5α羟化紫杉二烯醇合成模块的基因组整合Fig.2 Genomic integration of taxadien-5α-ol modules
1.2 酵母转化和筛选
用限制性内切酶Pst I/Bam HI对元件载体zf01以及所有基因表达盒进行酶切,凝胶回收得到元件模块和基因表达盒模块。将相应的羟化酶基因模块与还原酶基因模块组合,同元件模块zf01按等物质的量混合,采用醋酸锂法转化酿酒酵母紫杉二烯生产菌株SyBE_001051[13]。模块之间以终止子片段作为同源臂连接,两端通过KanMX位点同源序列与基因组该位点发生双交换同源重组(图2)。使用SD-ura-leu固体培养基进行筛选,于30℃培养2~3d,挑取单菌落在SD-ura-leu固体培养基上划线分纯,挑取分纯后的单菌落进行酵母菌落PCR,通过验证目的片段存在且大小正确,从而确定完整组装的阳性克隆。
1.3 人工酵母菌株的发酵
将100 μl液体甘油菌接入5 ml SD-ura-leu液体培养基中,30℃、220 r·min-1培养24 h后转接入5 ml SD-ura-leu液体培养基中,使其初始OD600为0.2,在30℃、220 r·min−1条件下培养至菌体对数生长中期(OD600约为5),接入50 mlYPD培养基中,使其初始OD600为0.1,在30℃、220 r·min-1条件下发酵,10 h时加入5%(体积)正十二烷进行两相培养,70 h结束发酵,将发酵液于11000 r·min-1离心5 min,收集上层有机相,除水过滤后备用GC-MS测定产物。
1.4 5α羟化紫杉二烯醇的检测与定量
使用三重四极气质联用系统(Agilent公司)测定产物。色谱条件:HP-5ms 30 m×0.25 μm×0.25 mm硅胶毛细管色谱柱(Agilent公司);恒流模式,载气氦气流速为1 ml·min-1;进样量10 μl。柱温起始温度100℃,保持1 min,以15℃·min-1升至175℃;再以4℃·min-1升至220℃,保持2 min;最后以50℃·min-1升至290℃,保持1 min;进样口温度与色谱-质谱接口温度均为250℃。质谱条件:电子轰击电离EI+;电子束能量70 eV;离子源温度250℃;溶剂延迟时间7 min;质量扫描方式:全离子扫描与SIM选择离子扫描。
采用与5α羟化紫杉二烯醇结构最为相近的化合物紫杉二烯的纯品绘制标准曲线,通过外标法对5α羟化紫杉二烯醇进行半定量。
2 实验结果与讨论
2.1 5α羟化紫杉二烯醇生物合成中组合设计原理的应用
在紫杉醇生物合成途径中,5α羟化紫杉二烯醇是紫杉二烯下游第一个由细胞色素P450单加氧酶催化的羟化产物,该催化反应由紫杉二烯5α羟化酶与细胞色素P450还原酶通过一系列电子传递过程共同完成。由于P450酶在异源宿主中都是通过膜结合而表达并发挥功能,因此相比于原核生物大肠杆菌,具有与植物细胞类似的细胞色素P450电子传递系统和完整内膜系统的真核生物酿酒酵母更加适合作为5α羟化紫杉二烯醇及其下游一系列细胞色素P450介导的氧化催化产物合成的宿主细胞,图3所示为在酿酒酵母紫杉二烯生物合成模块基础上,引入5α羟化紫杉二烯醇相关基因模块的生物合成路径。
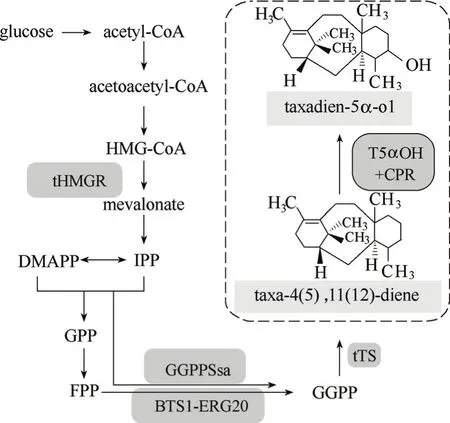
图3 工程酿酒酵母中5α羟化紫杉二烯醇生物合成路径Fig.3 Biosynthesis pathway of taxadien-5α-ol in engineered S. cerevisiaeHMG-CoA—3-hydroxy-3-methylglutaryl coenzyme A; DMAPP—dimethylallyl diphosphate; IPP—isopentenyl pyrophosphate; GPP—geranyl diphosphate; FPP—farnesyl diphosphate; GGPP—geranylgeranyl diphosphate; tHMGR—HMG-CoA reductase (truncated version); GGPPSsa—GGPP synthase of Sulfolobus acidocaldarius; BTS1-ERG20—fusion gene of BTS1 (GGPP synthase of yeast) and ERG20 (FPP synthase of yeast); tTS—taxadiene synthase of Taxus brevifolia (truncated version); T5αOH—taxadiene 5α-hydroxylase of Taxus; CPR—cytochrome P450 reductase
为了研究紫杉二烯5α羟化酶和还原酶的协同表达,选择3种不同红豆杉品种来源的羟化酶,分别是中国红豆杉源、曼地亚红豆杉源和东北红豆杉源,以及两种不同物种来源的还原酶,分别是东北红豆杉源和拟南芥源。Croteau等[22]的研究表明,红豆杉来源的不同P450单加氧酶间序列相似性很高,而与其他植物来源羟化酶序列差异较大,推断其可能具有较高底物专一性和特殊催化特性,因此本研究仅选取红豆杉源的羟化酶进行研究;此外,酿酒酵母中虽然具备细胞色素P450氧化还原系统,但其还原酶(CPR)的表达量低且与植物P450的电子传递效率不匹配[23-24],因此外源CPR的引入是必要的,它作为电子传递体与羟化酶之间发生电子传递作用,而不直接作用于底物,因此选取了2种不同物种来源的还原酶进行研究。
通过http://www.cbs.dtu.dk/services/TMHMM/网站预测得到不同来源羟化酶的穿膜区均为N端42个氨基酸,对其进行穿膜区24个氨基酸的部分截短以及全部截短,共得到9个羟化酶基因片段:Tw5αOH、t24Tw5αOH、t42Tw5αOH、Tm5αOH 、t24Tm5αOH、t42Tm5αOH、Tc5αOH、t24Tc5αOH、t42Tc5αOH;而红豆杉源和拟南芥源还原酶的穿膜区分别为N端74个和46个氨基酸,对其进行全部截短,共得到4个还原酶基因片段:TcCPR、t74TcCPR、AtCPR、t46AtCPR。此外,有研究还指出,紫杉二烯5α羟化酶的活性和催化效率较低是造成紫杉二烯向下游代谢物转化的代谢瓶颈[14],因此本研究对羟化酶基因使用酿酒酵母组成型强启动子tef1p进行调控以获得其高表达量,对还原酶基因使用强启动子tdh3p和弱启动子pgi1p分别进行调控,以研究并获得与羟化酶相匹配的还原酶表达水平。利用组合设计原理,如图4所示,将所述羟化酶与还原酶模块进行组合,共得到72种不同组合的5α羟化紫杉二烯醇生物合成模块。
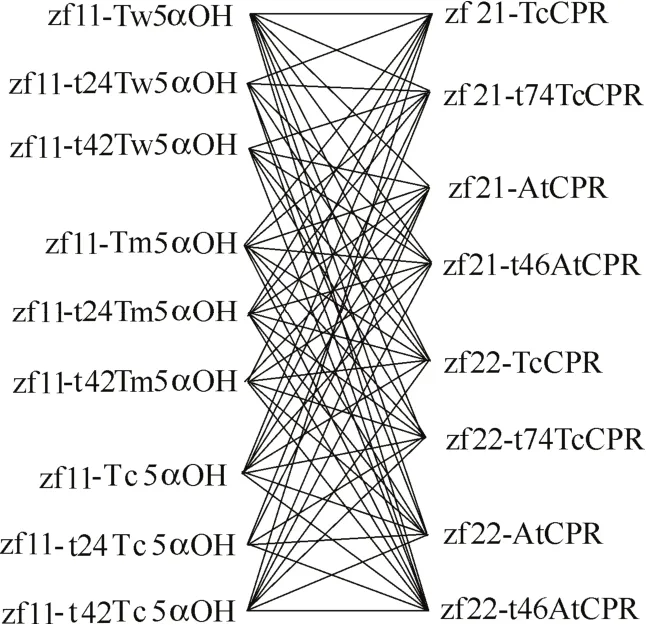
图4 紫杉二烯5α羟化酶与细胞色素P450还原酶的组合设计Fig.4 Combinatorial design of taxadiene 5α-hydroxylase and CYP450 reductase
2.2 产5α羟化紫杉二烯醇人工酵母的构建与发酵
本研究所采用的出发菌株为SyBE_001051,它是以酿酒酵母单敲菌株YNL280C(敲除麦角固醇合成途径中关键基因erg24,从而有效降低竞争支路的代谢通量)为底盘,整合入含有紫杉二烯生物合成途径关键基因tHMGR、GGPPSsa、BTS1-ERG20、tTS的着丝粒质粒,所构建的紫杉二烯生产菌株,其摇瓶发酵紫杉二烯产量达75 mg·L-1[13]。本研究将组合设计中相应的羟化酶模块和还原酶模块进行基于该出发菌株基因组Kan位点的整合共表达,分别从每个组合中选取3个阳性克隆进行发酵与GC-MS测定。
发酵样品的总离子流检测结果如图5(a)所示,可以看出,发酵产物种类较复杂,对其中具有离子特征峰m/z 288[272(紫杉二烯)+16(氧原子)]的色谱峰进行质谱分析,并依据其特征峰进行SIM模式下的选择离子扫描,结果如图5(b)所示,保留时间为17.03 min的色谱峰,其离子特征峰[图6(a)]与文献报道的5α羟化紫杉二烯醇[16]完全吻合,判断为目标产物;保留时间为16.50 min的色谱峰,其离子特征峰[图6(b)]与文献报道的5(12)-oxa-3(11)-cyclotaxane(OCT)[16]完全吻合,判断为副产物OCT;其他3个同样具有离子m/z 288的色谱峰,可能为其他紫杉烷化合物或氧化产物[图6(c)~(e)],产量很低,未能进行分离纯化,因此目前不能对其定性。
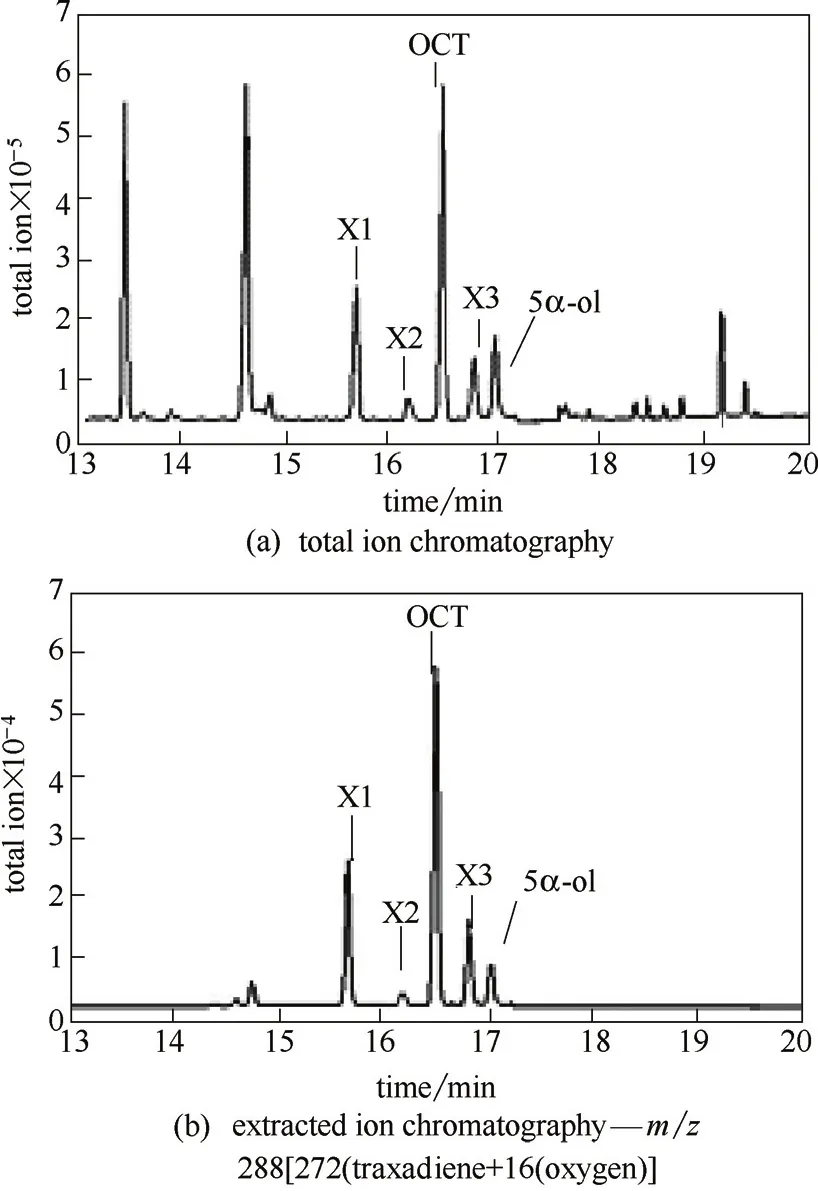
图5 菌株t24Tc5αOH-zf22t74TcCPR的发酵GC-MS检测Fig.5 GC-MS profile for strain t24Tc5αOH-zf22t74TcCPR
利用紫杉二烯标准曲线对5α羟化紫杉二烯醇进行半定量,全部菌株的产量如表2所示。
5α羟化紫杉二烯醇产量最高的菌株为62号,它是通过N端截短24个氨基酸的东北红豆杉源羟化酶与N端截短74个氨基酸的东北红豆杉源还原酶组合并构建而得,且还原酶与羟化酶基因均为强启动子调控,由此推断,虽然不同来源还原酶均可在该体系中发挥电子传递作用,但红豆杉源羟化酶与同一来源的还原酶适配性优于异源还原酶,且与羟化酶相当的还原酶转录和表达水平在此体系中更优,因而更能发挥其最佳催化效力。
2.3 羟化酶的不同来源和截短形式对5α羟化紫杉二烯醇生物合成的影响
对5α羟化紫杉二烯醇进行产量比较发现,使用不同来源的羟化酶,目标产物含量差异较为明显,东北红豆杉源羟化酶的效果优于另外两者(图7)。经序列比对发现,3种羟化酶的氨基酸序列相似性在98%以上,而曼地亚红豆杉源和东北红豆杉源羟化酶只有一个氨基酸差异,为N端31位,位于所预测的蛋白穿膜区域,曼地亚红豆杉源蛋白序列中该位点为丝氨酸,而东北红豆杉源蛋白序列中该位点为丙氨酸,推断不同极性氨基酸的差异可能会导致蛋白空间结构的不同,进而影响了酶的催化活性,有待对蛋白结构及其与底物间相互作用进行模拟以进一步揭示其催化作用机制。
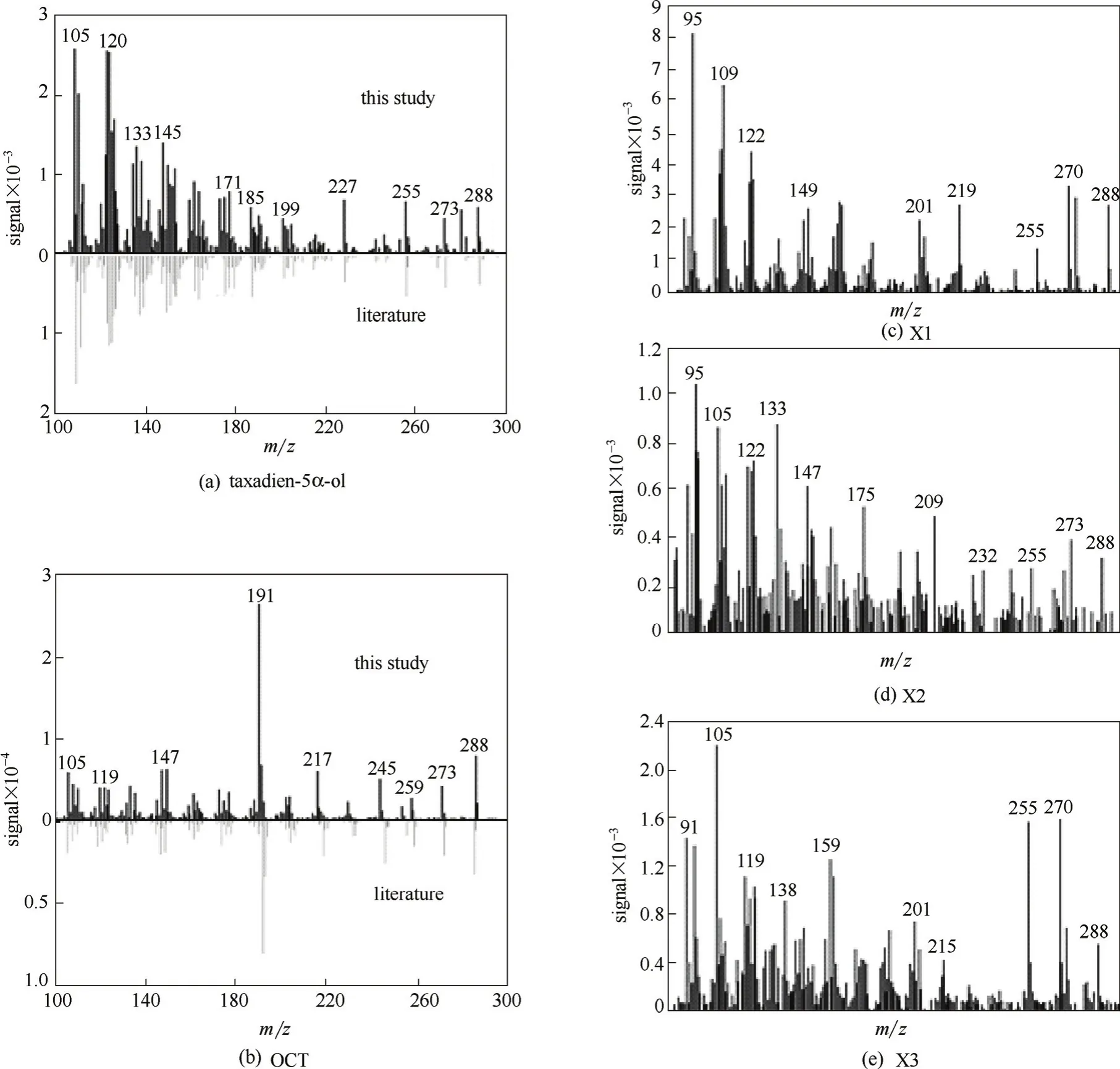
图6 紫杉烷化合物的质谱检测图Fig.6 Mass spectra of taxanes
此外,使用未截短或截短N端24个氨基酸的羟化酶,均有不同程度C5位羟化产物的产出,而羟化酶N端42个氨基酸被截短后,均不能合成羟化产物,推断植物源P450酶可由其本身的N端跨膜区定位于酵母内质网上而表达并发挥功能,这是酵母作为真核细胞用于表达异源蛋白相对于原核宿主的优势之一[25];而截短42个氨基酸可能使其不能进行膜定位,影响了蛋白的正确折叠和催化活性区域空间结构的形成,从而导致其功能遭到破坏。
3 结 论
(1)利用组合设计策略将不同来源、不同截短形式以及不同启动子调控的紫杉二烯5α羟化酶和P450还原酶进行组合和分别表达,在72种组合中筛选得到48个产5α羟化紫杉二烯醇的酿酒酵母菌株,产量最高为67.3 μg·L-1,其对应的最佳组合为东北红豆杉源羟化酶(t24)与东北红豆杉源还原酶(t74)组合,且羟化酶基因和还原酶基因均为强启动子调控。因而在后续的研究中,可以尝试在酿酒酵母中对羟化酶和还原酶采取融合表达策略,对两者进行统一调控,通过酶的空间距离的调节来研究其对催化目标产物合成的影响。
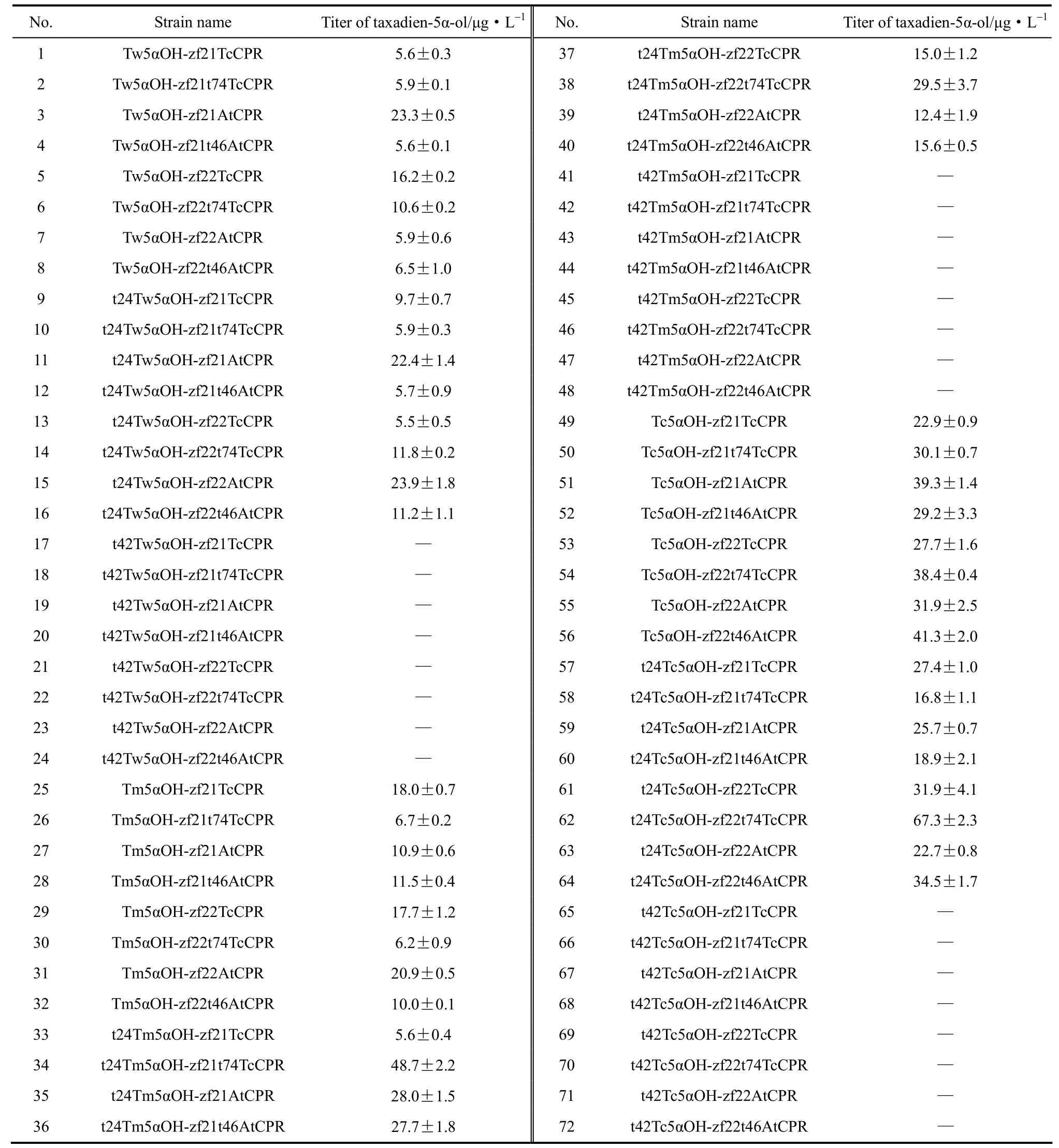
表2 本研究所构建菌株5α羟化紫杉二烯醇产量Table 2 Titer of taxadien-5α-ol of all strains constructed in this study
(2)在产紫杉二烯的酿酒酵母底盘中共表达紫杉二烯5α羟化酶和P450还原酶,得到的氧化产物并不单一,除目标产物5α羟化紫杉二烯醇外,还包含副产物OCT以及多个(本研究中为3个)未知的紫杉二烯羟化物,统称为紫杉烷类化合物。
(3)在所选用的3种不同来源的紫杉二烯5α羟化酶中,东北红豆杉源羟化酶催化活性最高,其次为曼地亚红豆杉源羟化酶,而中国红豆杉源羟化酶活性较差。
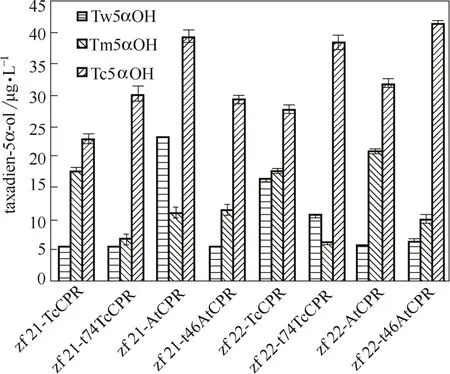
图7 不同来源羟化酶对5α羟化紫杉二烯醇产量的影响Fig.7 Effect of different taxadien 5α-hydroxylase on taxadien-5α-ol production
(4)在酿酒酵母中表达全长或N端截短24个氨基酸残基的紫杉二烯5α羟化酶,均可以得到5α羟化紫杉二烯醇及其他羟化产物,而表达N端截短42个氨基酸残基的羟化酶,则不能得到任何羟化产物。后续可借助分子模拟等手段分析羟化酶的膜结合及其与底物紫杉二烯的相互作用方式,用于指导对羟化酶的定向进化等改造,提高其催化效率和产物专一性,进而提高该催化过程的转化率,提高5α羟化紫杉二烯醇产量。
References
[1] 刘夺, 杜瑾, 赵广荣, 等. 合成生物学在医药及能源领域的应用[J].化工学报, 2011, 62 (9): 2391-2397. LIU D, DU J, ZHAO G R, et al. Applications of synthetic biology in medicine and energy [J]. CIESC Journal, 2011, 62 (9): 2391-2397.
[2] RO D K, PARADISE E M, OUELLET M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast [J]. Nature, 2006, 440 (7086): 940-943.
[3] RO D K, OUELLET M, PARADISE E M, et al. Induction of multiple pleiotropic drug resistance genes in yeast engineered to produce an increased level of anti-malarial drug precursor, artemisinic acid [J]. BMC Biotechnol., 2008, 8: 83.
[4] WESTFALL P J, PITERA D J, LEIHAN J R, et al. Production of amorphadiene in yeast, and its conversion to dihydroartemisinic acid, precursor to the antimalarial agent artemisinin [J]. PNAS, 2012, 109 (3): 111-118.
[5] PADDON C J, KEASLING J D. Semi-synthetic artemisinin: a model for the use of synthetic biology in pharmaceutical development [J]. Nature Reviews, 2014, 12 (5): 335-367.
[6] ZHOU Y J, GAO W, RONG Q X, et al. Modular pathway engineering of diterpenoid synthases and the mevalonic acid pathway for miltiradiene production [J]. J. Am. Chem. Soc., 2012, 134 (6): 3234-3241.
[7] DAI Z B, LIU Y, HUANG L Q, et al. Production of miltiradiene by metabolically engineered Saccharomyces cerevisiae [J]. Biotechnology and Bioengineering, 2012, 109 (11): 2845-2853.
[8] CARRAU F M, MEDINA K, BOIDO E, et al. De novo synthesis of monoterpenes by Saccharomyces cerevisiae wine yeasts [J]. FEMS Microbiol. Lett., 2005, 243 (1): 107-115.
[9] JENNEWEIN S, RITHNER C D, WILLIAMS R M, et al. Taxol biosynthesis: taxane 13 alpha-hydroxylase is a cytochrome P450-dependent monooxygenase [J]. PNAS, 2001, 98 (24): 13595-135600.
[10] WANG H H, ISAACS F J, CARR P A, et al. Programming cells by multiplex genome engineering and accelerated evolution [J]. Nature, 2009, 460 (7257): 894-898.
[11] AJIKUMAR P K, XIAO W H, TYO K E, et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli [J]. Science, 2010, 330 (6000): 70-74.
[12] DING M Z, YAN H F, LI L F, et al. Biosynthesis of taxadiene in Saccharomyces cerevisiae: selection of geranylgeranyl diphosphate synthase directed by a computer-aided docking strategy [J]. PLoS ONE, 2014, 9 (10): e109348.
[13] 张正伟, 丁明珠, 元英进. 紫杉二烯生物合成模块与不同底盘的适配 [J].高等学校化学学报, 2014, 35 (1): 75-79. ZHANG Z W, DING M Z, YUAN Y J. A research about the fitness of the taxadiene biosynthetic modules with different S. cerevisiae chassis [J]. Chemical Journal of Chinese Universities, 2014, 35 (1): 75-79.
[14] DEJONG J M, LIU Y, BOLLON A P, et al. Genetic engineering of taxol biosynthetic genes in Saccharomyces cerevisiae [J]. Biotechnology and Bioengineering, 2006, 93 (2): 212-224.
[15] ZHOU K, QIAO K J, EDGAR S, et al. Distributing a metabolic pathway among a microbial consortium enhances production of natural products [J]. Nature Biotechnology, 2015, 33 (4): 377-383.
[16] JENNEWEIN S, LONG R, WILLIAMS R M, et al. Cytochrome P450 taxadien 5α-hydroxylase, a mechanistically unusual monooxygenase catalyzing the first oxygenation step of Taxol biosynthesis [J]. Chem. Biol., 2004, 11 (3): 379-387.
[17] CHAU M, CROTEAU R. Molecular cloning and characterization of a cytochrome P450 taxoid 2alpha-hydroxylase involved in Taxol biosynthesis [J]. Arch. Biochem. Biophys., 2004, 427 (1): 48-57.
[18] RONTEIN D, ONILLON S, HERBETTE G, et al. CYP725A4 from yew catalyzes complex structural rearrangement of taxa-4(5),11(12)-diene into the cyclic ether 5(12)-oxa-3(11)-cyclotaxane [J]. J. Biol. Chem., 2008, 283 (10): 6067-6075.
[19] GUERRA-BUBB J, CROTEAU R, WILLIAMS R M. The early stages of Taxol biosynthesis: an interim report on the synthesis and identification of early pathway metabolites [J]. Nat. Prod. Rep., 2012, 29 (6): 683-696.
[20] 郭睿, 丁明珠, 元英进. 产青蒿二烯的人工酵母细胞的构建及发酵优化 [J].化工学报, 2015, 66 (1): 378-385. GUO R, DING M Z, YUAN Y J. Construction of artificial yeast cell for producing amorphadiene, and optimization of fermentation [J]. CIESC Journal, 2015, 66 (1): 378-385.
[21] QUAN J Y, TIAN J D. Circular polymerase extension cloning of complex gene libraries and pathways [J]. PLoS ONE, 2009, 4 (7): e6441.
[22] KASPERA R, CROTEAU R. Cytochrome P450 oxygenases of Taxol biosynthesis [J]. Phytochemistry Reviews, 2006, 5 (2/3): 433-444.
[23] JENNEWEIN S, PARK H, DEJONG J M, et al. Coexpression in yeast of Taxus cytochrome P450 reductase with cytochrome P450 oxygenases involved in Taxol biosynthesis [J]. Biotechnology and Bioengineering, 2005, 89 (5): 588-598.
[24] 李杰, 王春梅. 紫杉醇组合生物合成的研究进展 [J].生物工程学报, 2014, 30 (3): 355-367. LI J, WANG C M. Advances of taxol combinatorial biosynthesis [J]. Chinese Journal of Biotechnology, 2014, 30 (3): 355-367.
[25] HAMANN T, MØLLER B L. Improved cloning and expression of cytochrome P450s and cytochrome P450 reductase in yeast [J]. Protein Expression and Purification, 2007, 56 (1): 121-127.
Foundation item: supported by the National High Technology Research and Development Program of China (2012AA02A701) and the Foundation for the Author of National Excellent Doctoral Dissertation of China (201456).
Combinatorial design and construction of artificial yeast for production of taxadien-5α-ol
ZHAI Fang, SONG Tianqing, XIAO Wenhai, DING Mingzhu, QIAO Jianjun, YUAN Yingjin
(Key Laboratory of Systems Bioengineering, Ministry of Education; Department of Pharmaceutical Engineering, School of Chemical Engineering and Technology, Tianjin University; Collaborative Innovation Center of Chemical Science and Engineering (Tianjin), Tianjin 300072, China)
Abstract:Producing natural drugs such as Taxol by engineered microbes have attracted extensive attention in recent years. This work focused on how to design and construct artificial yeast for the production of taxadien-5α-ol, which was the first hydroxylated product catalyzed by cytochrome P450 enzymes in Taxol biosynthesis pathway. Based on combinatorial design, three hydroxylase genes derived from different yew subspecies and two reductase genes from different organisms with N-terminal truncatd with various length were tested simultaneously to investigate the fitness between the genes and the chassis. Two kinds of promoters were used for regulating the cytochrome P450 reductase genes. In total, 72 kinds of combinations were constructed and then integrated into the chromosome of the taxadiene producing strain. 48 taxadine-5α-ol producing strains were obtained out of 72 combinations by co-expression of the hydroxylase and the reductase. The highest titer was 67.3 μg·L-1. This was the first time to realize the biosynthesis of taxadine-5α-ol form glucose in Saccharomyces cerevisiae. The result provided a good reference for the research of the catalytic reaction mediated by cytochromebook=316,ebook=324P450 enzymes in microbes through the interactions between modules and chassis by combinatorial design.
Key words:synthetic biology; taxadien-5α-ol; combinatorial design; Saccharomyces cerevisiae; biocatalysis; fermentation
Corresponding author:XIAO Wenhai, wenhai.xiao@tju.edu.cn
基金项目:国家高技术研究发展计划项目(2012AA02A701);高等学校全国优秀博士学位论文作者专项基金(201456)。
中图分类号:Q 819
文献标志码:A
文章编号:0438—1157(2016)01—0315—09
DOI:10.11949/j.issn.0438-1157.20150992
