一株抗汞真菌的分离纯化及其对含汞废水治理特性的研究*
2016-03-13赵盛开张梅华潘利祥王昕竑蒋继宏王立辉姜朵朵
赵盛开 张梅华 潘利祥 孙 璐 朱 彤,3 王昕竑 蒋继宏 王立辉 姜朵朵 于 松
(1.中国石油大学(北京)化学工程学院,北京 102249;2.中节能集团六合天融环保科技有限公司,北京 100085;3.清华大学环境科学与工程系,北京 100084;4.江苏师范大学生命科学学院,江苏 徐州 221116)
汞在常温下呈液态,具有较强的毒性,是一种重要的工业原料,在有色金属冶炼、造纸、电子工业、农药生产等诸多领域都有着广泛的应用。每年有大量的汞污染物以废水、废气、废渣的形式进入水体、大气及土壤中,排入环境中的汞污染物经过物理化学及生物作用形成各种形态的汞。汞污染物难以用一般的生化方法进行降解处理,因此可在自然环境中长期存在,并通过食物链等方式进入生物体内,危及人类健康[1]。
目前,工业废水除汞的方法主要有化学沉淀法、金属还原法、活性炭吸附法、电解法、离子交换法和微生物法等[2-4]。其中,微生物法因成本低、生物污泥产量少、操作pH及温度范围宽、吸附性及选择性高等成为最具发展前景的含汞废水处理方法,特别在处理Hg2+质量浓度为1~100 mg/L的含汞废水时表现出良好的处理效果[5]。陈宏伟[6]利用从污染物中分离出的假单胞菌(Pseudomonassp.)处理Hg2+质量浓度为30 mg/L的含汞废水,24 h后Hg2+的去除率高达91.7%。WAGNER DÖBLER等[7]利用7种耐汞假单胞菌,在700 L的生物反应器中处理电解废水(Hg2+质量浓度为3~10 mg/L),10 h后Hg2+的去除率可以达到95%~99%。SHARIAT等[8]利用产气肠杆菌(Enterobacteraerogenes)处理2.5 mg/L的甲基汞溶液,24 h后甲基汞的去除率达到60%。此外,还有学者利用基因工程菌[9-10]、混合菌[11]等处理含汞废水。
本研究从被汞污染的土壤中分离筛选出抗汞真菌,通过内转录间隔区(ITS)序列比对进行菌株的系统分类鉴定,并对其处理含汞废水的特性进行研究。
1 材料与方法
1.1 菌种来源
在重庆万山地区受汞矿污染的表层土(0~10 cm)中采集土壤样品用于分离抗汞真菌。
1.2 菌种筛选及分离纯化
将采集的土壤样品用采样袋密封保存带回实验室。取10 g新鲜土壤样品装入含有90 mL无菌水的三角瓶中,用玻璃珠打散搅匀,制成土壤悬液。将悬液涂布在含Hg2+20.00 mg/L的AY固体培养基(无水醋酸钠0.246 1 g/L,酵母提取物0.15 g/L,琼脂15 g/L,氯霉素25 mg/L,pH=7)平板[12-13]上,室温条件培养,观察真菌菌株的生长情况。挑选单个真菌菌株接入新鲜的含Hg2+20.00 mg/L的AY固体培养基平板上进行纯化。
1.3 菌悬液制备
将上述分离纯化的菌株接种至扩大液体培养基(葡萄糖20 g/L,蛋白胨10 g/L,NaCl 0.2 g/L,CaCl20.1 g/L,KCl 0.1 g/L,MgSO40.25 g/L,FeSO40.005 g/L,pH=7)[14]中,在25 ℃、130 r/min下摇床培养3 d,然后在11 000 r/min下离心5 min,取离心后的菌液作为生物吸附菌悬液,4 ℃下保藏备用。
1.4 菌种鉴定
采用真菌基因组提取试剂盒提取菌株的DNA,利用真菌通用引物ITS1 (TCCGTAGGTGAACCTGCGG)和ITS4(TCCTCCGCTTATTG ATATGC)进行ITS rRNA基因的聚合酶链式反应(PCR)扩增。温度程序为:95 ℃预加热3 min,然后在95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,重复30个循环。PCR产物直接用于碱基序列测定。利用美国国家生物技术信息中心(NCBI)网站的BLAST进行碱基序列的比对,确定菌株的系统分类。
1.5 影响因素分析
由于反应时间、Hg2+初始浓度、pH、菌剂投加量对Hg2+的生物吸附有较大影响,配置HgCl2溶液50 mL,对每个影响因素均设置5组梯度实验,在25 ℃、180 r/min下振荡反应,反应结束后静置12 h,测定每组溶液中Hg2+含量,计算Hg2+的去除率。
1.6 菌株的微观表征
配制两份100 mL的AY液体培养基(其他配方与AY固体培养基相同,不含琼脂),其中一份培养基中含Hg2+20.00 mg/L,另一份不含Hg2+,将分离出的菌株接种到两份AY液体培养基中,室温条件下静置培养10 d。培养结束后将培养基中混合物于11 000 r/min下离心5 min,收集沉淀物(即湿菌体)。将湿菌体清洗、固定、脱水、干燥、黏托、表面金属镀膜等处理后,进行扫描电镜观察,研究菌体吸附Hg2+前后的形态变化。
2 结果与讨论
2.1 分离菌株的系统分类
经分离、扩大培养、驯化、筛选后,从受汞矿污染的土壤样品中分离得到一株对Hg2+具有较强耐受性的真菌菌株,命名为GX-4。通过ITS序列比对,对GX-4进行了系统分类鉴定,发现GX-4与尖孢镰刀菌(Fusariumoxysporum)同源性达到99%,属半知菌类,从梗孢目,瘤座孢科,镰刀菌属。尖孢镰刀菌对重金属废水具有较好的吸附去除效果,VELMURUGAN等[15]利用镰刀菌(Fusariumspp.)治理含Zn2+废水,Zn2+去除率达到30%~60%;SU等[16]利用FusariumoxysporumCZ-8F1治理含砷废水,也取得了良好的效果。
2.2 反应时间的影响
制备5组Hg2+初始质量浓度为20.00 mg/L的HgCl2溶液50 mL,调节溶液pH为5,向每组溶液中投加2.0 g GX-4菌悬液,反应时间分别设定为30、60、120、240、360 min,考察不同反应时间下GX-4对Hg2+的吸附去除效果,结果见图1。
由图1可见,当反应时间从30 min延长到60 min时,Hg2+的去除率显著提高,反应60 min时,Hg2+的去除率即可达到93.14%,随着反应时间的继续延长,Hg2+的去除率提高缓慢,反应进行360min后,Hg2+的去除率仅提高到94.90%。OZSOY[17]利用寡孢根霉菌(Rhizopusoligosporus)及WU等[18]利用黄孢原毛平革菌(Phanerochaetechrysosporim)处理含汞废水时也发现了相似的变化趋势。可见,微生物对Hg2+的吸附去除主要经历两个阶段:第1阶段是快速的表面吸附阶段;第2阶段是缓慢的胞内扩散阶段[19]。真菌对Hg2+表现出良好的吸附去除效果,这是因为真菌细胞壁上存在一系列的功能基团,如氨基基团、羧基基团、磷酸盐基团等,这些基团能够提供负电荷成为Hg2+的有效靶位点[20-21],被吸附在这些靶位点上的Hg2+与配合物以及电子相互交换,经过一段时间后,Hg2+通过被还原或者被固定从而有效去除。
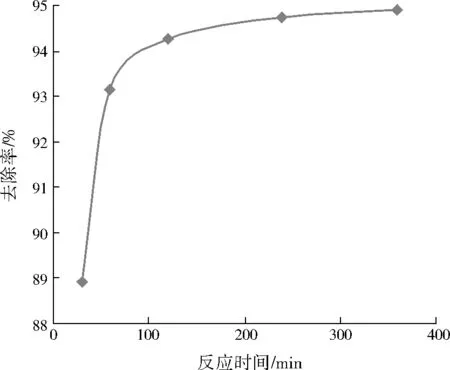
图1 反应时间对Hg2+去除率的影响
2.3 Hg2+初始浓度的影响
配置5组HgCl2溶液50 mL,调节溶液中Hg2+初始质量浓度分别为0.50、5.00、10.00、20.00、50.00 mg/L,溶液pH为5,向每组溶液中投加2.0 g GX-4菌悬液,振荡反应360 min,考察Hg2+初始质量浓度对Hg2+去除率的影响,结果见图2。

图2 Hg2+初始质量浓度对Hg2+去除率的影响
由图2可见,随着Hg2+初始浓度的增加,Hg2+去除率呈现出较大的波动变化,这是因为真菌细胞壁上的靶位点数相对固定,当Hg2+初始质量浓度小于10.00 mg/L时,这些靶位点没有被充分激活,此时Hg2+去除率随着Hg2+初始浓度的增加而降低;当Hg2+初始质量浓度为10.00~20.00 mg/L时,细胞壁上的靶位点被逐渐激活,Hg2+去除效率随着Hg2+初始浓度的增加而升高;由于菌剂投加量有限,当Hg2+初始质量浓度超过20.00 mg/L时,没有足够的靶位点吸附Hg2+[22],去除率又开始呈现下降趋势。当Hg2+初始质量浓度为0.50 mg/L时,Hg2+去除率高达94.80%,出水Hg2+降至0.03 mg/L以下,满足《污水综合排放标准》(GB 8978—1996)的限值要求(<0.05 mg/L)[23]。因此,对于Hg2+初始质量浓度超过0.50 mg/L的含汞废水可以采用多级处理方式,以满足废水达标排放的要求。
2.4 pH的影响
制备5组Hg2+初始质量浓度为20.00 mg/L的HgCl2溶液50 mL,调节溶液pH分别为3、4、5、6、7,向每组溶液中投加2.0 g GX-4菌悬液,反应360 min,考察不同pH下GX-4对Hg2+的吸附去除效果,结果见图3。

图3 pH对Hg2+去除率的影响
由图3可见,pH可以显著影响GX-4对Hg2+的吸附去除效果,这是因为pH能够影响金属离子的化学形态,调整溶液中氢离子的浓度,进而改变真菌细胞壁上靶位点的化学性质,影响Hg2+的去除率[24]。当溶液pH为5时,Hg2+的去除率最高,为95.35%,可能是低pH条件下真菌细胞壁上靶位点的质子化作用阻止了其对重金属的吸附,随着pH的增加,去质子化作用使得靶位点上的负电荷增多,从而更容易吸附Hg2+ [25]。DAS等[26]也研究了pH对Hg2+去除率的影响,认为真菌处理含汞废水中的最适pH为5~7。
2.5 GX-4菌悬液投加量的影响
制备5组Hg2+初始质量浓度为20.00 mg/L的HgCl2溶液50 mL,调节溶液pH为5,向溶液中分别投加0.5、1.0、2.0、5.0、10.0 g GX-4菌悬液,振荡反应360 min,考察不同投加量下GX-4对Hg2+的吸附去除效果,结果见图4。
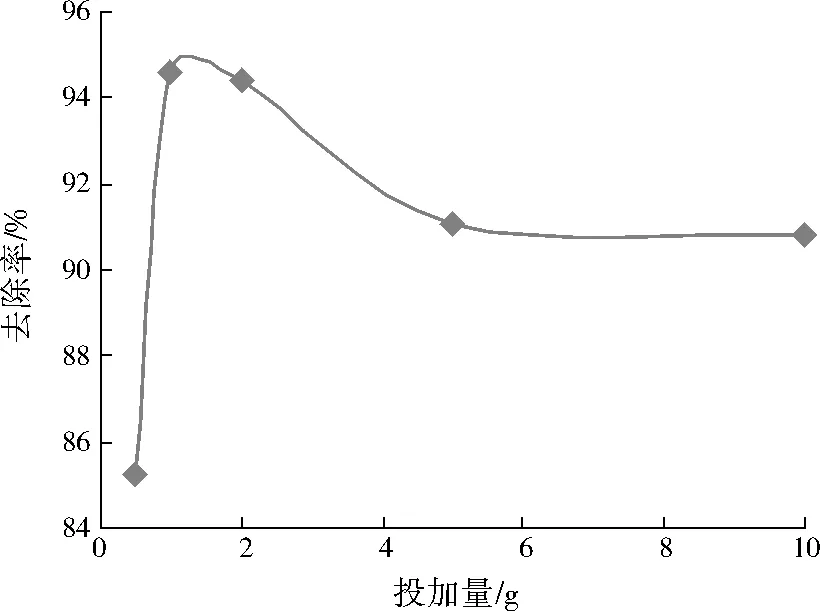
图4 GX-4菌悬液投加量对Hg2+去除率的影响
由图4可见,当GX-4菌悬液投加量为0.5~1.0 g时,Hg2+的去除率显著提高,当GX-4菌悬液投加量为1.0 g时,Hg2+去除率最大,为94.55%。这是因为随着GX-4菌悬液投加量的增加,真菌细胞壁上提供的靶位点总数增加,更多的Hg2+被吸附,使Hg2+去除率迅速增加。当GX-4菌悬液投加量为2.0~5.0 g时,Hg2+去除率明显下降,继续增加GX-4菌悬液投加量至10.0 g时,Hg2+去除率基本稳定在91%左右。可见,GX-4菌悬液的最佳投加量在1.0~2.0 g。分析原因,可能是过多的菌剂可能阻碍了靶位点的暴露,反而不利于真菌对Hg2+的吸附去除[27]。
2.6 GX-4的微观表征
吸附Hg2+前后GX-4菌体的微观形态变化见图5。由图5(a)可见,在不含Hg2+的AY液体培养基中培养10 d后,GX-4菌体表面较为光滑,而在含Hg2+的AY液体培养基中培养10 d后,菌体表面较为粗糙,有颗粒附着,这与胡晓婧等[28]利用平菇菌糠吸附废水中Cu2+的扫描电镜结果类似。经检测,图5(b)中GX-4菌体表面的颗粒状物体为Hg2+离子,进一步证明了GX-4可以有效吸附Hg2+的表面特性。此外,菌体周围有明显的沉淀物,推断GX-4在含汞条件下产生某类生物酶,催化Hg2+发生沉淀反应,从而固定Hg2+[29]。

图5 吸附Hg2+前后GX-4的微观形态
3 结论和建议
从汞污染土壤中分离纯化出一株抗汞真菌菌株GX-4,经基因测序鉴定,该菌属于尖孢镰刀菌。利用GX-4处理含汞废水,发现30~60 min为GX-4对Hg2+的快速吸附阶段,在处理Hg2+初始质量浓度低于0.50 mg/L的含汞废水时,出水Hg2+能够达到GB 8978—1996的排放限值要求;GX-4菌悬液的最佳投加量为1.0~2.0 g,最佳反应pH为5。
对吸附Hg2+后的GX-4进行扫描电镜观察,发现该菌能将吸附的Hg2+转化成稳定的沉淀物。利用真菌治理重金属污染的微生物技术具有绿色环保、无二次污染、成本低廉等优点,本研究发现的抗汞真菌菌株可用作生物反应器的活性组分,未来具有广阔的应用前景。
[1] 金春姬,李鸿江,贾永刚,等.电动力学法修复土壤环境重金属污染的研究进展[J].环境污染与防治,2004,26(5):341-344.
[2] 尚谦,张长水.含汞废水的污染特征及处理[J].有色金属加工,1997(5):52-65.
[3] 赵天从,汪健.有色金属提取冶金手册[M].北京:冶金工业出版社,1999.
[4] 田建民.生物吸附法在含重金属废水处理中的应用[J].太原理工大学学报,2000,31(1):74-78.
[5] 唐宁,柴立元,闵小波.含汞废水处理技术的研究进展[J].工业水处理,2004,24(8):5-8.
[6] 陈宏伟.抗汞菌株的分离鉴定及特性[J].黑龙江大学自然科学学报,2000,17(3):86-88.
[7] WAGNER DÖBLER I,CANSTEIN H V,LI Ying,et al.Removal of mercury from chemical wastewater by microorganisms in technical scale[J].Environmental Science and Technology,2000,34(21):4628-4634.
[8] SHARIAT M,ANDERSON A C,MASON J W.Screening of common bacteria capable of demethylation of methylmercuric chloride[J].Bulletin of Environmental Contamination and Toxicology,1979,21(1/2):255-261.
[9] CHEN Shaolin,WILSON D B.Genetic engineering of bacteria and their potential for Hg2+bioremediation[J].Biodegradation,1997,8(2):97-103.
[10] 周桢林,陈琦.假单胞菌质粒抗汞基因的克隆[J].中山大学学报(自然科学版),1990,29(3):129-135.
[11] VON CANSTEIN H,KELLY S,LI Ying,et al.Species diversity improves the efficiency of mercury-reducing biofilms under changing environmental conditions[J].Applied and Environmental Microbiology,2002,68(6):2829-2837.
[12] MIYATA N,MARUO K,TANI Y,et al.Production of biogenic manganese oxides by anamorphic ascomycete fungi isolated from streambed pebbles[J].Geomicrobiology Journal,2006,23(2):63-73.
[13] MIYATA N,TANI Y,IWAHORI K,et al.Enzymatic formation of manganese oxides by an acremonium-like hyphomycete fungus,strain KR21-2[J].FEMS Microbiology Ecology,2004,47(1):101-109.
[14] 黄惠,孙璐,蒋继宏,等.真菌LP-20对金属矿土壤镉锌的固定化作用研究[J].环境科学与技术,2014,37(12):36-39.
[15] VELMURUGAN P,SHIM J,YOU Y,et al.Removal of zinc by live,dead,and dried biomass ofFusariumspp. isolated from the abandoned-metal mine in South Korea and its perspective of producing nanocrystals[J].Journal of Hazardous Materials,2010,182(1/2/3):317-324.
[16] SU Shiming,ZENG Xibai,BAI Lingyu,et al.Arsenic biotransformation by arsenic-resistant fungiTrichodermaasperellumSM-12F1,PenicilliumjanthinellumSM-12F4,andFusariumoxysporumCZ-8F1[J].Science of the Total Environment,2011,409(23):5057-5062.
[17] OZSOY H D.Biosorptive removal of Hg(Ⅱ) ions byRhizopusoligosporusproduced from corn-processing wastewater[J].African Journal of Biotechnology,2010,9(51):8783-8790.
[18] WU Juan,YU Hanqing.Biosorption of 2,4-dichlorophenol by immobilized white-rot fungusPhanerochaetechrysosporiumfrom aqueous solutions[J].Bioresource Technology,2007,98(2):253-259.
[19] ULKU Y,AYLA D,FILIZ B D,et al. The removal of Pb(Ⅱ)byPhanerochaetechrysopsporium[J]. Water Research,2000,34(16):4090-4100.
[20] EATON A D,CLESCERI L S,RICE E W,et al.Standard methods for the examination of water & wastewater[M].21st ed.Washington,D.C.: American Public Health Association,2005.
[22] RAO M M,REDDY D H,VENKATESWARLU P,et al.Removal of mercury from aqueous solutions using activated carbon prepared from agricultural by-product/waste[J].Journal of Environmental Management,2009,90(1):634-643.
[23] GB 8978—1996,污水综合排放标准[S].
[24] FIOL N,VILLAESCUSA I,MARTNEZ M,et al.Sorption of Pb(Ⅱ),Ni(Ⅱ),Cu(Ⅱ) and Cd(Ⅱ) from aqueous solution by olive stone waste[J].Separation and Purification Technology,2006,50(1):132-140.
[25] RIDVAN S,NALAN Y,ADIL D.Biosorption of cadmium,lead,mercury,and arsenic ions by the fungusPenicilliumpurpurogenum[J].Separation Science and Technology,2003,38(9):2039-2053.
[26] DAS S K,DAS A R,GUHA A K.A study on the adsorption mechanism of mercury onAspergillusversicolorbiomass[J].Environmental Science & Technology,2007,41(24):8281-8287.
[27] BARTNICKI GARCIA S.Cell wall chemistry,morphogenesis,and taxonomy of fungi[J].Annual Review of Microbiology,1968,22(10):87-108.
[28] 胡晓婧,藏婷婷,顾海东,等.平菇菌糠对废水中铜离子的生物吸附性能[J].环境科学,2014,35(2):669-677.
[29] 孙璐,张梅华,魏源送,等.真菌菌株XS3-2-5对含锰废水中Mn(Ⅱ)的生物氧化作用[J].环境科学与技术,2015(10):88-93.
