D—对羟基苯海因的细胞催化水解工艺优化
2016-03-12贺莹高晓丽段利强乔元彪
贺莹++高晓丽++段利强++乔元彪


摘 要: 从菌中的酶含量和酶活力两方面对微生物酶催化水解的最佳条件进行了探究。结果显示,通过对试验菌种生长曲线的测定,发现该菌在22 h之内为对数期,22~36 h为稳定期,36 h后进入衰退期。在此基础上检测前期诱导培养的菌种内的酶含量为3.6%,然后对该菌破胞后的酶粗提物和不破胞的菌体(全细胞)进行了不同温度和pH值梯度下的水解情况对比,得到两者酶活力最高时的最佳温度和pH值,前者最佳温度为40 ℃,pH值为8,后者则最佳温度为40 ℃,pH值为6。最后通过对比得出,酶粗提物的水解效果比全细胞的更佳。
关键词:D-对羟基苯甘氨酸;D-海因酶;N-氨甲酰水解酶;微生物酶催化法
中图分类号:O643.32 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2016.03.021
D-对羟基苯甘氨酸(D-HPG)主要用作合成青霉素和半合成头孢霉素类药物的重要中间体。用其生产的主要药品有羟氨苄青霉素·阿莫西林、羟氨苄青霉素克拉维酸盐、羟氨苄头孢、羟氨苄唑头孢、头孢哌酮等,这些药物用途广泛,对革兰氏阴性菌、革兰氏阳性菌、弓形菌、螺旋体等均有杀灭作用。此外,还被用于感光领域和用作铁、磷、硅等的分析试剂,需求量呈逐年递增趋势。
我国作为青霉素生产大国,青霉素母核(6-APA)来源十分丰富,但是中国D-对羟基苯甘氨酸生产技术一直没有很好解决,主要原料仍然依靠进口,从而严重制约了半合成抗生素的发展,产品供求紧张、生产成本高、没有竞争力。传统的D-对羟基苯甘氨酸(D-HPG)的合成主要是化学合成和生物酶催化法。然而,化学合成D-HPG的方法污染较大,会产生氰化物,毒性高,污染严重,污水处理复杂,这种方法现在已经很少使用。与化学合成相比,生物酶催化法的污染较小,反应条件相对温和,而且选择性和转化效率都有一定的优势。所以,人们渐渐重视生物催化法的研究,主要集中在利用D,L-对羟基苯海因(D,L-HPH)为原料的经酶催化合成 D-HPG 的方法上[5]。因此,发展我国自主原料D-p-HPG有极其深远的现实意义[1-2]。
目前有报道称土壤杆菌(Agrobacterium sp),梭菌(Clostridium sp),消化球菌P(Petococus sp)、节杆菌(Arthrobacter sp)、赛氏杆菌(Serratia sp)、棒杆菌(Corynebacterium sp)具有D-p-对羟基苯海因酶活性,假单胞菌(Pseudomonas sp)和芽胞杆菌(Bacillus sp)具有D-p-对羟基苯海因酶和N-氨甲酰对羟基苯甘氨酸水解酶双酶活性。
酶法合成对羟基苯甘氨酸的反应先后经过两个过程,即D-海因酶先催化底物DL-对羟基苯海因生成N-氨甲酰基-D-对羟基苯甘氨酸,然后产物再在D-N-氨甲酰基氨基酸水解酶的作用下生成D-对羟基苯甘氨酸[3-4]。
1 材料和方法
1.1 试 剂
酵母浸膏,胰蛋白胨,NaCl,D-对羟基苯海因,标准品D-对羟基苯甘氨酸, DL-对羟基苯海因,氢氧化钠,盐酸,水合茚三酮,正丁醇为天津市天力化学试剂有限公司生产。
1.2 仪器与设备
Boxun洁净工作台(上海博讯有限公司),HZQ-X100振荡培养箱(哈尔滨市东联电子技术开发有限公司),cence湘仪TDZ4-WS台式低速离心机(湖南湘仪实验室仪器开发有限公司),cenceTGL-16台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司),WiseMix VM-10漩涡混合器(Daihan scientific),弘祥隆DCTZ/W系列多用途恒温超声提取机,UV-2100双光束紫外可见分光光度计(上海棱光有限公司),1 mL和200 μL移液器,SY-8100高效液相色谱仪(北京北分瑞利分析仪器有限责任公司),LGJ-10冷冻干燥机(北京松源华兴科技发展有限公司)。
1.3 方 法
1.3.1 生长曲线的制作 根据所测得的不同培养时间段的OD值,计算出不同培养时间的5号菌的生长状况的实际值,并制作成该菌的生长曲线[5]。
1.3.2 标准品D-对羟基苯甘氨酸(D-HPG)的标准曲线的制作 参照文献[6]。
1.3.3 全细胞与酶粗提物的制备 发酵后离心,然后倒掉上清液,用超滤水重复上述步骤离心洗涤3次,洗涤完后,用该缓冲液将菌体配制成 1∶3 的菌悬液,置于合适的大塑料试管内备用(全细胞)。
将大塑料试管置于冰浴中,采用恒温超声提取机超声波破碎,破碎液于12 000 r·min-1下高速冷冻离心30 min,收集上清夜备用(粗酶液)。
1.3.4 酶活力的测定 酶活力单位:每1 mL发酵液收集的菌体每分钟转化1 μmol底物定义为1活力单位,参照文献[7-8]。
1.3.5 温度对酶活力的影响 取28个干净的10 mL试剂瓶按表1分成14组,每组两个重复,按表2称取底物和细胞或酶粗提物,然后向每个试剂瓶中添加10 mL超滤水,pH值=7,封口,用保鲜膜包裹,放入不同温度的摇床中水解4 h。
4 h后,将试剂瓶从摇床取出,用1 mL移液器按编号从试剂瓶中各取1 mL试剂移入1.5 mL离心管中,10 000 r·min-1,10 min离心。然后用高效液相色谱仪检测产物的峰电平并记录。
根据标准品的标准曲线计算出不同温度下全细胞和酶粗提物的酶活力,制作曲线,进行对比。
1.3.6 pH值对酶活力的影响 试验方法与1.3.5相同,将 45 ℃培养并经过分步诱导的5号菌液产生的全细胞和酶粗提物在40 ℃和pH值分别为4,5,6,7,8,9,10条件下进行酶活力测定,并制作对比曲线。
2 结果与分析
2.1 5号菌的生长曲线
通过对37 ℃培养的菌液每2 h测1次OD值,做出5号菌的生长曲线,结果见图1。
由图1可知,5号菌的基本生长情况,因为接的菌是对数期的菌,所以从培养开始到22 h这一段是菌的对数生长期,22~36 h是稳定期,36 h后菌开始衰落。
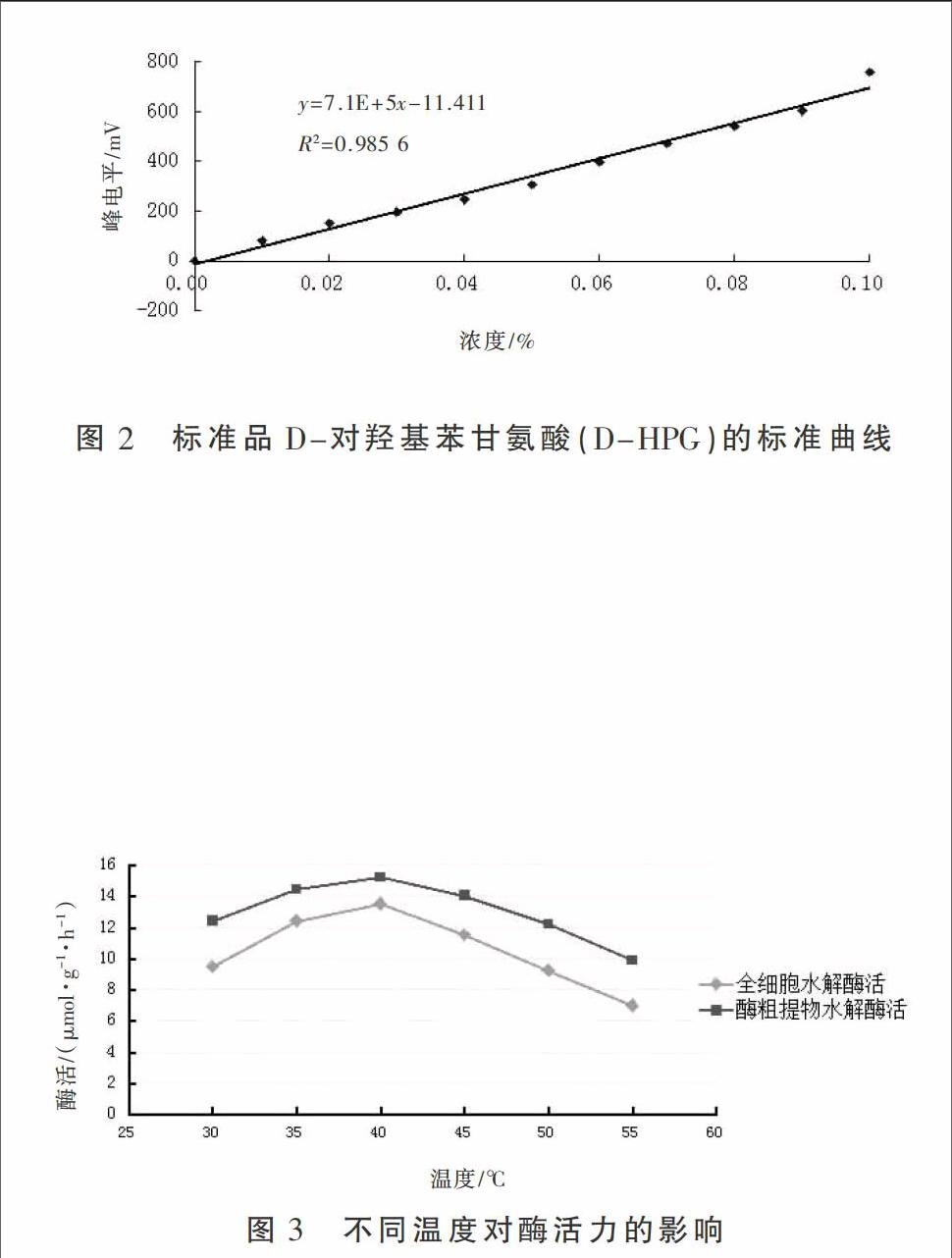
2.2 标准品D-对羟基苯甘氨酸(D-HPG)的标准曲线
标准品D-对羟基苯甘氨酸(D-HPG)的标准曲线如图2所示。
2.3 温度对酶活力的影响
将 45 ℃分步诱导培养24 h的菌液产生的全细胞和酶粗提物在pH值为7.0和温度分别为30,35,40,45,50,55 ℃条件下水解进行酶活力测定,结果见图3。
由图3可知,等量的5号菌的全细胞和酶粗提物在水解温度为40 ℃时酶活力最高,酶粗提物的酶活力为15.23 μmol·g-1·h-1。然而从整个趋势看来,在pH值=7的条件下,随着温度的变化,酶粗提物的水解酶活力要比全细胞水解的酶活力高。由此表明,在pH值=7,温度为40 ℃的条件下,适合做酶粗提物水解。
2.4 pH值对酶活力的影响
将 45 ℃分步诱导培养24 h的菌液产生的全细胞和酶粗提物在温度为40 ℃和pH值分别为4,5,6,7,8,9,10条件下水解进行酶活力测定,结果见图4。
由图4可知,等量的5号菌的全细胞和酶粗提物在40 ℃水解时,随着pH值的升高,全细胞和酶粗提物的水解酶活力先升高后降低,在pH值=6时全细胞活力达到最高,酶粗提物酶活力达到最高时的pH值为8。由此表明,在温度为40 ℃,pH值=8的条件下,适合做酶粗提物水解。
通过以上的试验数据可以得出,5号菌中的蛋白含量占到细胞的3.6%,在此前提下,取等量的细胞一部分破胞,一部分保留全细胞做水解,检测出两者酶活力最高的最佳温度和pH值,前者为40 ℃,pH值=8,后者为40 ℃,pH值=6。然后在两者各自酶活力最高的最佳条件下做水解,仍然是取等量的细胞一部分破胞,一部分保留全细胞,检测得出在水解相同时间后,只占细胞3.6%的酶粗提物的水解效果更好,反应速度更快。
3 结 论
笔者通过试验,利用自选菌种,从菌的酶含量和酶活力两方面对微生物酶催化水解的最佳条件进行了研究。通过对试验菌种生长曲线的测定,发现该菌在22 h之内为对数期,22~36 h为稳定期,36 h后进入衰退期。在此基础上检测前期诱导培养的菌种内的酶含量为3.6%,然后对该菌破胞后的酶粗提物和不破胞的菌体(全细胞)进行了不同温度和pH值梯度下的水解情况对比,得到两者酶活力最高时的最佳温度和pH值,前者最佳温度为40 ℃,pH值为8,后者则最佳温度为40 ℃,pH值为6。研究认为,酶粗提物的水解效果比全细胞的更佳。
参考文献:
[1] 董妍玲,谭新国,潘学武.海因酶法制备D-对羟基苯甘氨酸的研究进展[J].氨基酸和生物资源,2009,31(3):47-52.
[2] CHAO Y P, JUANG T Y, CHEM J T, et al. Production of d-p-hydroxyphenylglycine by n-carbamoyl-d-amino acid amidohydrolase-overproducing escherichia coli strains[J]. Biotechnology Progress, 1999, 15(4):603-607.
[3] 科技部西南信息中心.D-对羟基苯甘氨酸的生产技术与市场要求[J]. 化工文摘, 2001(11):44-45.
[4] 李业英,阚振荣,朱宝成,等.D-对羟基苯甘氨酸生产菌株的选育方法探讨[J].河北大学学报(自然科学版),2004,24(5):523-525.
[5] 王燕妮.D-对羟基苯甘氨酸生物合成研究进展[J].鸡西大学学报,2011,11(11):61-64.
[6] 张彦岭,李公春.D-对羟基苯甘氨酸的合成研究[J].许昌学院学报,20102,29(2):96-98.
[7] 付建忠,刘守信,周志辉,等.采用非均相酶催化法生产d-对羟基苯甘氨酸的方法:CN 1928103 B[P].2010-09-01.
[8] 宋慧敏,屠春燕,欧阳平凯.高效液相色谱法测定D-对羟基苯甘氨酸[J].南京工业大学学报,2002,24(4):97-99.
