牛场肥水灌溉对土壤反硝化细菌nosZ基因组成结构和多样性研究
2016-03-12王婷刘丽丽高文萱
王婷++刘丽丽++高文萱

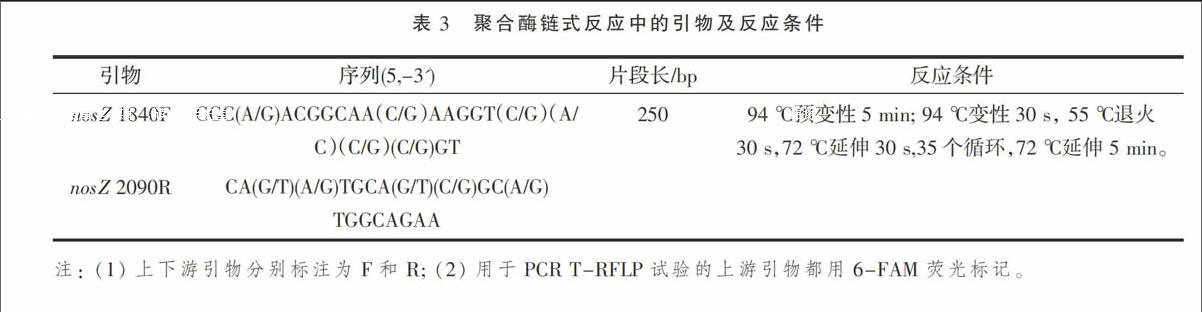
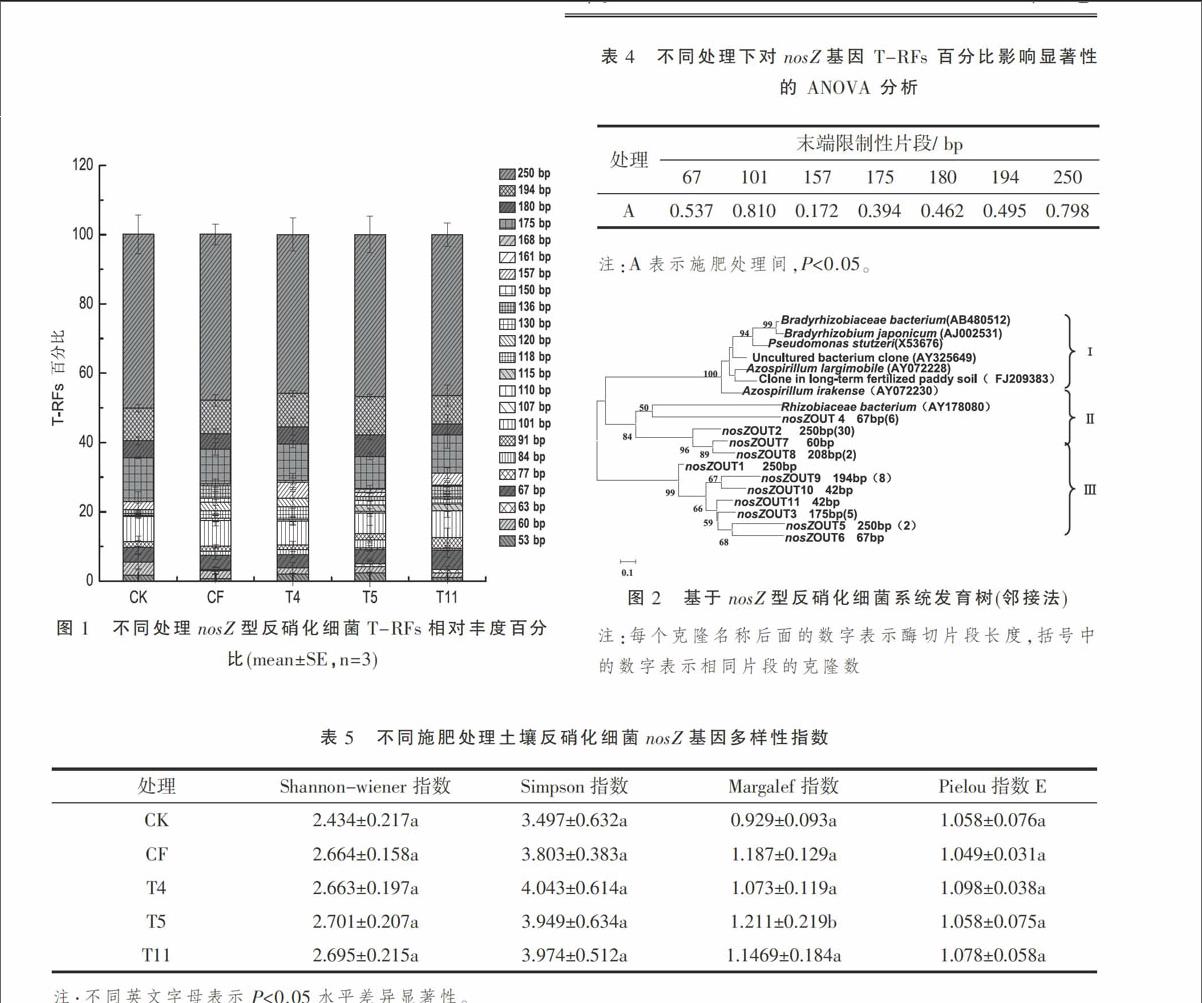
摘 要:以河北省徐水县长期定位施肥试验田为研究对象,利用末端限制性片段长度多态性(T-RFLP)分析和克隆文库构建,研究了5种施肥处理(清水灌溉CK、无机肥灌溉CF、不同牛场肥水灌溉T4、T5和T11)下土壤中nosZ型反硝化细菌群落多样性及其群落结构演变。结果表明,不同施肥处理下nosZ型反硝化细菌群落多样性无显著性差异,施肥条件对nosZ型反硝化细菌的群落结构无明显影响,说明本试验土壤中nosZ型反硝化细菌对施肥不敏感,群落稳定。系统发育分析结果表明,nosZ型反硝化细菌主要与假单胞菌属(Pseudomonas)具有较近的亲缘关系。
关键词: nosZ;反硝化细菌;牛场肥水灌溉;T-RFLP;群落多样性
中图分类号:S155.4+4 文献标识码:A DOI编码:10.3969/j.issn.1006-6500.2016.03.004
反硝化作用是微生物在嫌气条件下进行的硝酸盐还原过程,在多种微生物参与下,将硝酸盐亚硝酸盐逐步还原,最终将氮以一氧化氮(NO)、氧化亚氮(N2O)或分子态氮(N2)的形式释放出来的过程[1-3]。反硝化作用微生物主要分布于水体、沉积物和土壤中,由于土壤的环境更适合微生物的生存[4],所以反硝化作用主要发生于土壤中。研究表明土壤因反硝化作用而丧失了20%~30%的氮肥[5],全球70%的N2O排放来自土壤[6],Stehfest和 Bouwman[7]指出,施肥农田土壤每年释放N2O-N 和 NO-N 的量分别达到 3.3 和 1.4 Tg。农田土壤是重要的温室气体[二氧化碳(CO2)、甲烷(CH4)、氧化亚氮(N2O)]的源汇[8]。因此,深入研究农田土壤反硝化的作用及其影响因素,可以为我们减少 N2O 的排放找到新途径,对于保护地球生态非常重要。
随着集约化饲养程度的不断提高,养殖废物发酵产生的沼液作为一种优质的有机液体肥料进行水肥还田在很多国家和地区得到应用和推广[9-10]。研究发现,相比不施肥和常规施肥,沼液能够提高作物质量,影响土壤微生物[11-13],而液态牛场肥水灌溉对反硝化微生物的影响几乎没有相关报道。
由于nosZ基因编码的氧化亚氮还原酶催化N2O向N2转化,将温室气体N2O 转化为无害的 N2,是反硝化细菌的重要酶[2]。目前已有不少研究者通过研究 nosZ 基因的多样性来探究反硝化细菌的群落结构和多样性,比如Ruiz-Rueda 等[14]通过对nosZ的 PCR-DGGE 研究,发现植被存在可以促进微生物的硝化和反硝化作用。Enwall 等[15]发现长期施用有机肥改变了 nosZ型反硝化细菌的群落结构,提高土壤的反硝化潜势。
笔者以河北省徐水县长期定位试验田为研究对象,利用T-RFLP和构建克隆文库方法,探明了按当地农民习惯施肥以及不同灌溉次数、不同浓度的牛场肥水灌溉的施肥方式下,冬小麦/夏玉米大田0~5 cm土层中nosZ型反硝化细菌群落的多样性和组成变化,为深入探讨牛场肥水灌溉施肥对大田反硝化作用影响提供相应依据,并为大田合理施肥、提高牛场肥水灌溉效果以及减少 N2O 的排放提供科学参考。
1 材料和方法
1.1 试验设计与土壤样品采集
本试验以徐水县梁家营长期定位施肥试验田为研究对象。徐水县地处太行山东麓,河北省中部,北纬38°09′~39°09′,东经115°19′~115°46′,属大陆性季风气侯,年平均气温11.9 ℃,年均降水量546.9 mm,年日照时数平均2 744.9 h。
试验田每个小区长9 m,宽6 m,面积54 m2,四周1 m土体内用塑料布隔开,种植方式为冬小麦/夏玉米轮作。共设5个处理,施肥方式及灌溉肥水沼液原液成分见表1和表2。
土壤样品在小麦收割后(6月中旬)进行采集,采用5点法采集土样,每个小区随机选取5点采集0~5 cm的表层土,去除根系、杂草、土壤动物和石块等杂质后混匀,于20 ℃冰箱保存。
1.2 土壤微生物总DNA提取
土壤微生物总DNA的提取方法和步骤按照土壤基因组DNA提取试剂盒FastDNAR SPIN Kit For Soil (MP Biomedicals,LLC)的说明进行。将提取的DNA用Nano Drop核酸蛋白仪(ND-1000)测定浓度及质量,于-20 ℃冰箱中保存。
1.3 末端限制性酶切片段多态性(T-RFLP)
按照表3进行PCR扩增,扩增产物用Mini BEST DNA Fragment Purification Kit VER 4.0(TaKaRa)试剂盒进行纯化回收,并用Nano Drop核酸蛋白仪(ND-1000)检测纯化产物浓度及质量。产物回收后,扩增产物用内切酶HhaⅠ(TaKaRa)进行酶切,反应体系和条件按各内切酶说明书进行。将酶切产物送去生工生物工程(上海)股份有限公司进行测序分析。
通过计算Shannon-Wienner、Simpson和Pielou多样性指数模型获得nosZ型反硝化细菌群落多样性指数。
1.4 克隆及测序分析
将1.3目的条带分别进行切胶回收,用Mini BEST DNA Fragment Purification Kit VER 4.0(TaKaRa)试剂盒进行纯化,纯化后的产物分别与pMD19R-T Vector载体进行连接反应。
将10 μL连接产物分别转化到100 μL大肠杆菌JM109感受态细胞中,涂在含有X-Gal、IPTG、Amp的LB琼脂平板培养基上37 ℃过夜培养后进行蓝白斑筛选,挑取白斑克隆子,用通用引物M13F(5′-TGT AAA ACG ACG GCC AGT-3′,TaKaRa),M13R(5′-CAG GAA ACA GCT ATG ACC-3′,TaKaRa)进行菌落PCR扩增,选取大约100个克隆子扩大培养后送去生工生物工程(上海)股份有限公司进行测序分析。
