碱性羟胺、弱碱和乙酸水解奇异变形杆菌LPS抗原及其活性的影响
2016-03-08杨文腰修雪亮戴泽文周荔葆
杨文腰, 王 瀛, 王 琦, 修雪亮, 戴泽文, 张 建, 周荔葆
(辽宁成大生物股份有限公司,辽宁 沈阳 110179)
碱性羟胺、弱碱和乙酸水解奇异变形杆菌LPS抗原及其活性的影响
杨文腰, 王 瀛, 王 琦, 修雪亮, 戴泽文, 张 建, 周荔葆
(辽宁成大生物股份有限公司,辽宁 沈阳 110179)
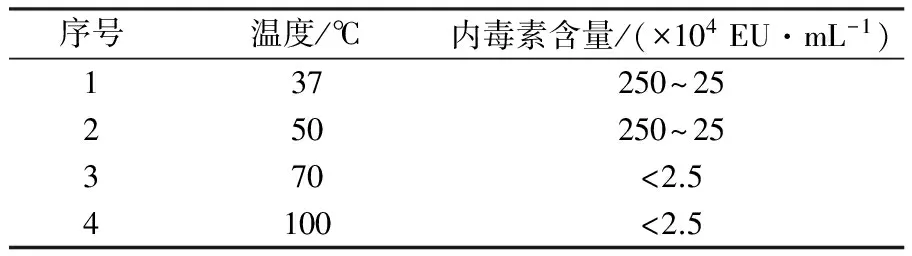
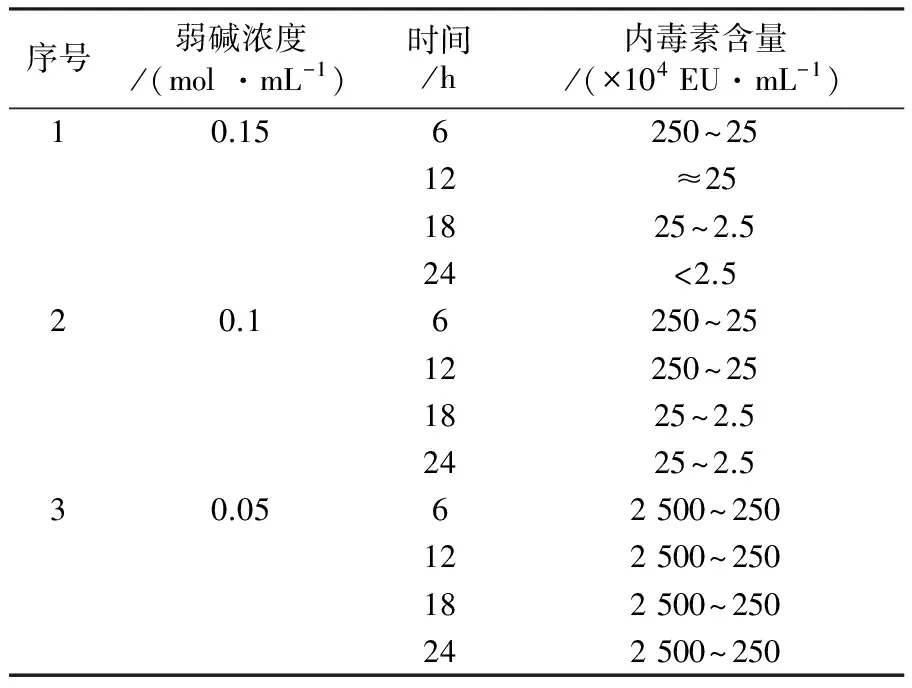
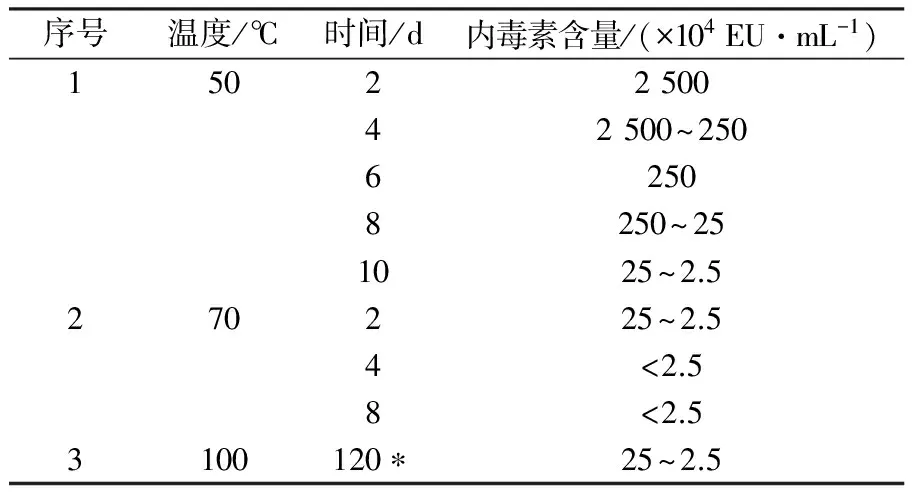
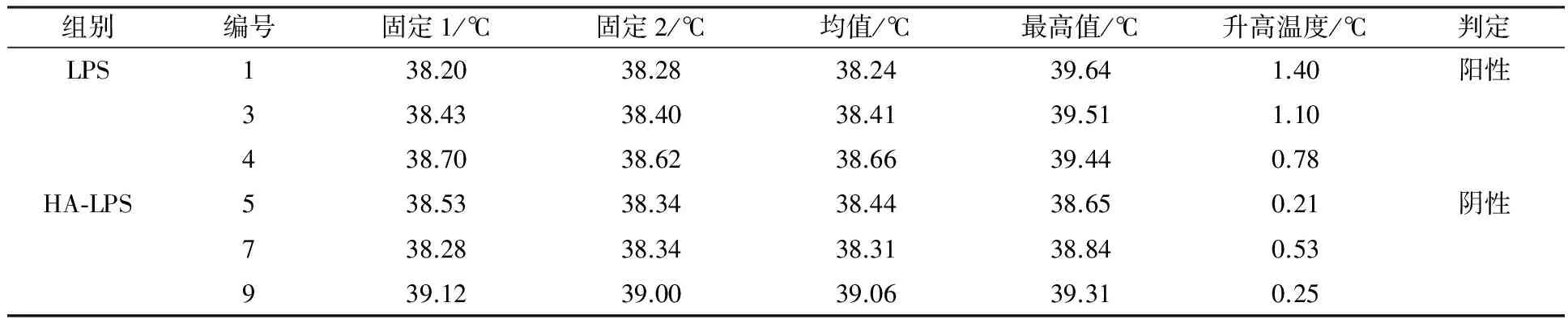
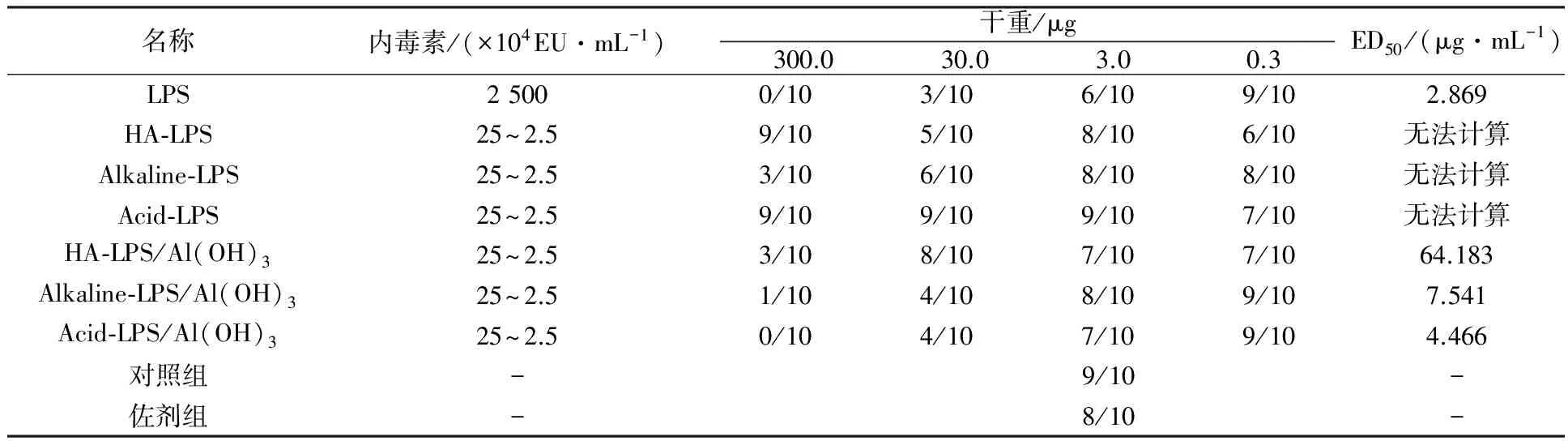
采用碱性羟胺、弱碱、乙酸水解奇异变形杆菌LPS抗原,研究不同方式对小鼠活性的影响。检测结果表明,与水解前对比三种方式均能降低LPS抗原内毒素含量,即从2 500×104EU/mL降低至(250~2.5)×104EU/mL;热源性检测表明对家兔体温几乎无影响;但免疫原性结果表明ED50 LPS 奇异变形杆菌;LPS抗原;内毒素;热源性;免疫原性;毒性 奇异变形杆菌属于革兰阴性杆菌,是引起尿路感染的主要病原菌之一,其感染率仅次于大肠埃希菌。2004年林茂虎等[1]对1999年12月至2001年3月采集的165例UTIs患者样本进行分离、鉴定,结果变形杆菌属高达39%。邓晶荣[2]对某院2011至2014年278株标本来源进行分离,鉴定出138株奇异变形杆菌(49.61%)、70株普通变形杆菌(25.14%)和其他变形杆菌属62株(25%),它们能够产生多种β-内酰胺酶,给临床治疗带来了极大的困难,已受到临床普遍关注。奇异变形杆菌潜在的致病因子和感染过程及相关疾病所涉及的细菌行为包括:迁徙性[3]、生长速度、鞭毛、溶血素、外膜蛋白[4]、脂多糖(LPS)等。胞膜蛋白及多糖成分可能介导了病原体的致病过程以及抵御宿主的免疫攻击,其中LPS是奇异变形杆菌一个潜在的毒力因子,在抵抗抗菌肽过程中扮演了一个显著的角色[5-6]。由于细菌LPS对哺乳类动物有显著的致热性,注射人体和动物后可使机体发热,甚至导致休克。近些年化学法修饰脂多糖抗原的方法越来越受到研究者的关注,文献报道碱性羟胺法[7]、碱法[8]、乙酸水解法[9]等能够有效处理脂多糖的毒性和热源性,但是对其抗原性研究的报道差异较大,因此本文通过上述三种方法对奇异变形杆菌LPS抗原进行水解,降低LPS抗原内毒素含量和致热性,检测其对免疫原性的影响,以期建立有效的奇异变形杆菌LPS候选疫苗方法。 1.1 材料 1.1.1 菌种来源Proteusmirabilis13(PM13)菌株由中国医科大学盛京医院分离。 1.1.2 实验动物 小鼠来自湖南斯莱克景达、SPF级,家兔来自中检院动物所、SPF级。 1.1.3 试剂及仪器 酪蛋白、酵母浸粉等购自北京奥博星生物技术公司,葡萄糖、盐酸羟胺类无机盐等购自国药控股有限公司,鲎制剂购自湛江安度斯生物有限公司,铝佐剂购自丹麦Brenntag Biosector公司;15 L BIOSTAT C PLUS发酵罐购自贝朗公司,XX42P0080超滤膜包、77410-10蠕动泵购自MILLIPORE公司,离心机J26-XPI 购自BECKMAN COULTER公司,PL1502-S电子天平购自梅特利-托利多。 1.2 方法 1.2.1 细菌培养 以半合成培养基为原料高密度培养奇异变形杆菌, 条件为pH 7.2,250 r/min,8 L/min通气量,培养至对数生长后期或静止期。 1.2.2 奇异变形杆菌LPS抗原纯化 发酵液经盐酸羟胺消化后进行下述纯化:8 L消化液12 000 r/min离心10 min,收集可溶性上清液进行超滤,透析1 000倍后浓缩样品至600 mL。① 碱性羟胺水解法(HA-LPS): 碱性羟胺化法[7]处理LPS组分。具体如下:向LPS组分中加入终浓度为2%(体积分数)盐酸羟胺溶液,然后用0.1 mol/L NaOH调节pH为8~9和10~11,摇匀后分别放置于37 ℃和55 ℃孵箱中孵育,选择2、4、6、8和10 d取样,4 ℃、10 000 r/min离心10 min后取上清液,测定内毒素含量。确定上述条件,制备一系列不同内毒素含量HA-LPS组分。② 弱碱水解法(Alkaline-LPS): 参照Rupesh等[8]报道的方法,使用0.05、0.1和0.15 mol/L NaOH溶液水解法处理LPS组分终浓度为2%(体积分数),分别置于37、50、70、100 ℃,在6、12、18、24 h取样,4 ℃、10 000 r/min离心10 min后取上清液,测定样品内毒素含量。根据上述测定结果确定碱浓度、温度及时间,制备Alkaline-LPS组分。③ 乙酸水解法(Acid-LPS): 采用乙酸水解法[9]处理LPS组分,通过加入体积分数为2%乙酸后,置于50、70和100 ℃进行孵育,在2、4、6、8、10 d分别取样4 ℃、10 000 r/min离心10 min后取上清液(100 ℃孵育120 min),测定不同时间样品内毒素含量。确定上述条件制备Acid-LPS组分。根据上述碱性羟胺法、弱碱法及乙酸法确定的试验条件制备样品,按照1∶2.5比例加入体积分数为95%的冷乙醇,使用0.1 mol/L HCl溶液调节其pH至5.0~6.0,4 ℃下沉淀2 h。4 000 r/min离心10 min,收获沉淀,加入冷乙醇充分洗涤3次,离心收集的抗原用注射用水完全溶解后,调节pH至7.2,低温冷冻法冻干上述LPS、HA-LPS、Alkaline-LPS、Acid-LPS组分,残留水分不高于5%(质量分数),进一步开展热源性、毒性及免疫原性等动物试验检测。 1.2.3 内毒素检测 取上述步骤LPS、HA-LPS、Alkaline-LPS、Acid-LPS冻干品,用无热源水逐级稀释至101~108, 主要测定105、106、107、108四个数量级样品,按《中国药典》2010版三部附录Ⅻ E细菌内毒素检查法中凝胶限度法进行检查。 1.2.4 家兔热原试验 用无热源水将LPS(2 500×104EU/mL)和HA-LPS((25~2.5)×104EU/mL)抗原冻干品稀释至50~60 μg/mL。选择2~3 kg家兔3~6只/组,按《中国药典》2010版三部附录Ⅻ D注射剂量按家兔体重每1 kg注射1.25~1.5 μg抗原,在规定时间内,观察家兔体温升高的情况。 1.2.5 免疫原性测定 选取体重12~14 g 健康清洁级小鼠若干只, 随机分组, 每组10只,抗原冻干品用生理盐水稀释,稀释度为300、30、3、0.3 μg/mL,每只小鼠腹腔注射0.5 mL,对照组分别注射生理盐水和0.5 mg/mL氢氧化铝佐剂。7 d后注射3~5 LD50奇异变形杆菌悬液,观察5~7 d记录及统计结果,计算ED50。 1.2.6 毒性测定 选取体重12~14 g健康清洁级小鼠若干只, 随机分组, 每组10只,抗原冻干品用生理盐水稀释,稀释度为4、2、1、0.5 mg/mL,每只腹腔注射体积为0.5 mL,对照组注射生理盐水,观察5~7 d记录及统计结果,计算LD50。 2.1 内毒素测定 2.1.1 碱性羟胺水解法 2%(体积分数)碱性羟胺处理奇异变形杆菌LPS抗原内毒素结果见表1所示, LPS抗原内毒素含量经LAL法测定高于2.5×107EU/mL。 表1 温度和pH对奇异变形杆菌LPS抗原碱性羟胺法水解的影响 结果表明,在37 ℃时, pH 8~9及10~11对奇异变形杆菌LPS抗原内毒素含量几乎没有影响,但在56 ℃时,不同pH对奇异变形杆菌LPS抗原内毒素含量在数量级上出现递减趋势,在pH 10~11范围内,孵育6 d即可达到限度值,随着孵育时间的延长,内毒素含量不再发生变化,然而pH在8~9时,内毒素在(2.5~25)×104EU/mL区间时约需要10 d。 2.1.2 弱碱水解法 奇异变形杆菌LPS抗原在0.15 mol/L弱碱溶液,终浓度为2%(体积分数)条件下,考察37、50、70、100 ℃下孵育2 h,内毒素是否发生变化,测定结果见表2。奇异变形杆菌LPS抗原在37和50 ℃时,经过2 h孵育后,内毒素含量结果相当,均在(250~25)×104EU/mL范围内,与原液对照组(>2.5×107EU/mL)相比,变化不是很明显;但是经过70 ℃或沸水浴后,内毒素含量降低显著,两者均小于2.5×104EU/mL。因此进一步考察37 ℃下,不同碱溶液浓度及对奇异变形杆菌LPS抗原内毒素影响,取样检查6、12、18、24 h内毒素含量,结果见表3。结果所示,碱液浓度在0.05 mol/L,经过24 h孵育后,组分内毒素含量没有发生变化;碱液浓度为0.1 mol/L和0.15 mol/L时,经过孵育6~12 h,与原液相比内毒素含量降低10倍,再经18~24 h后内毒素含量减至(2.5~25)×104EU/mL,基本保持不变。 表2 温度对奇异变形杆菌LPS抗原弱碱水解的影响 2.1.3 乙酸水解法 奇异变形杆菌LPS抗原采用2%(体积分数)乙酸处理,不同温度及时间下测定内毒素结果见表4。50 ℃孵育8~10 d基本达到25×104EU/mL,可以有效去除LPS抗原中内毒素部分,然后采用沸水浴孵育120 min可快速有效去除内毒素,但可能会使有效成分失去活性。 表3 弱碱浓度对奇异变形杆菌LPS抗原水解的影响 2.2 热源测定结果 采用药典法测定奇异变形杆菌LPS和 HA-LPS抗原致热性反应,从12只家兔中初步筛选6只合格家兔进行样品热源性测定,结果见表5。LPS组3只家兔温度分别上升1.40、1.10和0.78 ℃,而HA-LPS组3只家兔温度仅上升0.21、0.53和0.25 ℃。按药典结果判定,HA-LPS组为阴性, LPS组为阳性,具有一定的致热性。 2.3 免疫原性(ED50)测定结果 奇异变形杆菌LPS抗原经过碱性羟胺法、弱碱法及乙酸法水解后分别获得HA-LPS、Alkaline-LPS、Acid-LPS 抗原,选择内毒素含量范围在(25~2.5)×104EU/mL的抗原进行免疫原性测定,分为4组:阳性对照组(LPS)、不含佐剂组(HA-LPS、Alkaline-LPS、Acid-LPS)、含有佐剂组(HA-LPS、Alkaline-LPS、Acid-LPS+Al(OH)3)及阴性对照组(生理盐水、Al(OH)3),见表6。数据经过软件分析:阳性对照组 ED50为2.869 μg/mL,不含佐剂组无法统计,佐剂组ED50依次为64.183、7.541和4.466 μg /mL,总体上得出结论:①ED50LPS 表4 温度对奇异变形杆菌LPS抗原乙酸水解的影响 注:* 单位为min 表5 奇异变形杆菌LPS和HA-LPS抗原致热反应结果 2.4 毒性(LD50)测定 对奇异变形杆菌LPS、Acid-LPS、Alkaline-LPS及HA-LPS进行毒性测定,结果见表7。经软件分析LD50分别为1.599 mg/mL 、Max、1.148 mg/mL和0.744 mg/mL。 结果表明与阳性对照相比,经过碱性羟胺水解法、弱碱水解法及乙酸水解法处理后,奇异变形杆菌LPS抗原毒性均降低,其中乙酸水解法降低幅度较大。 表6 奇异变形杆菌 LPS、HA-LPS、Alkaline-LPS和Acid-LPS 抗原ED50测定结果 本研究使用PM13菌株来自医院分离株,以半合成培养基为生产培养基,建立了具有稳定性、可重复性的LPS提取工艺。细菌脂多糖一般由类脂A、核心寡聚糖和O-抗原侧链构成,其中类脂A是LSP的毒性和生物活性中心,由葡萄胺、磷酸盐和脂肪酸构成,是LPS中心最稳定的部分,无种属特异性。 奇异变形杆菌LPS抗原经过碱性羟胺法、弱碱法和乙酸法水解后能够降低LPS的致热反应,上述方法主要基于碱性羟胺法[7]发生氨解反应从类脂A上脱去整个脂肪酸;弱碱法[8]是在碱性条件下,从类脂A上断裂链接脂肪酸的O-酯键,使脂肪酸脱离除去;而乙酸法[9]主要通过乙酸水解,断裂LPS链上KDO和类脂A之间的键,形成O-SP部分。目前,乙酸水解法已广泛应用于结合疫苗脂多糖成分的研究,赵志强等[10]采用乙酸水解法获取甲型副伤寒沙门菌O-SP组分,通过CDAP对O-SP活化、ADH衍生、EDAC缩合等步骤结合至破伤风类毒素TT上形成甲型副伤寒结合疫苗;谢茂超等[11]采用乙酸水解法制备铜绿假单胞菌O-SP抗原,通过化学结合破伤风类毒素形成O-SP-TT疫苗,结果表明与O-SP相比,其能够刺激小鼠产生高效的IgG抗体。 小鼠免疫原性检测表明奇异变形杆菌LPS抗原ED50为2.869 μg/mL,经过碱性羟胺法、弱碱法和乙酸法水解LPS抗原ED50均无法计算,进一步研究向抗原中加入氢氧化铝佐剂,有利于增强机体产生免疫应答能力,提高LPS抗原水解后的免疫活性,试验结果表明与无Al(OH)3组相比较, HA-LPS/Al(OH)3、Alkaline-LPS/Al(OH)3和Acid-LPS/Al(OH)3组免疫原性较好,为进一步研究奇异变形杆菌LPS疫苗以及由其引起感染的预防提供理论依据和技术支持。 [1] 林茂虎,鲁鸿,贾宁.变形菌属引发导尿管相关尿路感染的研究[J]. Chin J Nosocomiol,2004,14 (4):468-470. [2] 邓晶荣.某院2011-2014年变形杆菌病原菌分布及耐药性变迁分析[J].淮海医药,2016,34 (1):90-91. [3] Harry L.T.,Mobley,Belas R. Swarming and pathogenicity ofProteusmirabilisin the urinary tract[J]. Trends Microbiol,1995,3(7):280-284. [4] Nicole M.,Collins C.M.,O’Hanley P. Efficacy of aProteusmirabilisOuter Membrane Protein Vaccine in Preventing ExperimentalProteusPyelonephritis in a BALB/c Mouse Model[J]. Infection and Immunity,1991,59(10):3778-3786. [5] Rozalski A.,Sidorczyk Z.,Kotelko K. Potential virulence factors ofProteusbacilli[J]. Microbiology and Molecular Biology Reviews,1997,61(1):65-89. [6] Mccoy A. J.,Liu H. J.,Falla T. J.,et al. Identifications ofProteusmirabilismutants with increased sensitivity to antimicrobial peptides[J]. Antimicrobial Agents and Chemotherapy,2001,45(7):2030-2037. [7] McIntire F.C.,Sievert H.W.,Barlow G.H.,et al. Chemical,Physical,and Biological Properties of a Lipopolysaccharide fromEscherichiacoliK-235[J].Biochemistry,1967,6 (8):2363-2372. [8] Rupesh K. M.,Fabien R. P.,Sylvain R.,et al. β-Hydroxymyristic acid as a chemical marker to detect endotoxins in dialysis water[J]. Analytical Biochemistry,2015,(470):71-77. [9] Michael D.J.,Evgeny V.,John F.N.,et al. The core and Opolysaccharide structure of the Caulobacter crescentus lipopolysaccharide[J].Carbohydrate Research,2015,(402):111-117. [10]赵志强,杨朝晖,计永莉,等.甲型副伤寒结合疫苗的制备及其免疫原性研究[J].中华微生物和免疫学杂志,2006,26(11):1048-1052. [11]谢茂超 ,陈明拓,姜晓,等. 铜绿假单胞菌3型O-特异性多糖-破伤风类毒素结合疫苗的制备及其免疫特性分析[J].中国生物制品学杂志,2012,25 (12):1565-1568. Effect of Alkaline Hydroxylamine, Mild Alkaline and Acetic Acid Hydrolysis LPS Antigen and Activity ofProteusmirabilis YANG Wen-yao, WANG Ying, WANG Qi, XIU Xue-liang, DAI Ze-wen, ZHANG Jian, ZHOU Li-bao (LiaoningChengdaBio-Tech.Co.Ltd.,Shenyang110179) ProteusmirabilisLPS antigen was hydrolyzed adopting alkaline hydroxylamine, mild alkaline and acetic acid to study the effect of its activity on mice. The determination results showed that as compared with the pre-treatment, three methods could reduce endotoxin levels of LPS antigen from 2 500×104EU/mL to (250~2.5)×104EU/mL. Pyrogenic properties showed almost no significant effects on the rabbit body temperature. However, immunogenicity results showed that ED50 LPS Proteusmirabilis; LPS antigen; endotoxin; pyrogenic properties; immunogenicity; toxicity 辽宁省沈阳市浑南新区科学技术计划项目(20111014) 杨文腰 男,硕士研究生。主要从事疫苗方面研究工作。E-mail:yangwenyao1982@sina.com 2015-12-15; 2016-04-26 Q936 A 1005-7021(2016)06-0088-05 10.3969/j.issn.1005-7021.2016.06.0151 材料与方法
2 结果与分析

3 讨 论
