2014年深圳市流行的1型登革病毒分子溯源分析*
2016-03-07马珍元黄呈辉张新枝钟世良田建华南方医科大学附属深圳宝安医院广东深圳518101
马珍元,黄呈辉,张新枝,钟世良,田建华(南方医科大学附属深圳宝安医院,广东深圳518101)
2014年深圳市流行的1型登革病毒分子溯源分析*
马珍元,黄呈辉,张新枝,钟世良,田建华
(南方医科大学附属深圳宝安医院,广东深圳518101)
摘要:目的对2014年深圳市登革热(DF)流行时分离的登革热1型病毒株(DENV-1)进行E基因序列测定,了解其分子病毒学特征,探讨其可能来源。方法收集35份2014年深圳市DF患者急性期血清标本,用乳仓鼠肾细胞(BHK-21)分离DF病毒,并用逆转录-半套式聚合酶链反应(RT-PCR)反应对其进行型别鉴定。RT-PCR扩增全长E基因,测序并进行同源性与进化树分析。结果35份血清样本中分离到DENV-1 21株。选取6株深圳DENV-1分离株测序,E基因全长1 485 bp,编码495个氨基酸。6株深圳市DENV-1分离株同源性为100.0%,其同源性与深圳市2010流行株接近,核苷酸和氨基酸同源性分别为99.5%和99.8%,与新加坡2009和日本2004流行株的核苷酸和氨基酸同源性最高达99.7%和100.0%。进化分析发现,深圳6株DENV-1属于基因型1型,与Shenzhen2010、Singpore2009、Japan2004的亲缘关系较近,在同一进化支上。结论2014年深圳市DENV-1属GⅠ亚型,最可能来源于东南亚一带,于2010年本地化而引起2014年DF流行。
关键词:登革热;登革热病毒;E基因;序列测定;系统进化树
登革热(dengue fever,DF)是由登革病毒(dengue virus,DENV)引起的一种严重的急性虫媒传染病。近十年来,登革热在全世界的发病率提高近30倍,波及全球100多个国家和地区,成为世界性的公共卫生问题[1]。在我国,登革热主要流行于广东、海南、广西、福建、台湾等南方及东南沿海省份。深圳自成立经济特区以来,2001年报告首例输入性登革热病例,之后不断有散在输入性病例报告,主要来源于周边城市及东南亚国家。2010年10月深圳市福田某工地上发生首起本地登革热暴发流行,流行规模以局部低强度流行为主[2]。2014年9月-2014年12月深圳再次发生本地登革热暴发流行,全市共报道确诊病例454例,流行规模较2010年明显扩大。为分析2014年DENV流行株的可能来源,本研究对2014年深圳市登革热暴发流行期间分离的部分登革热1型病毒株进行E基因序列测定和分子进化分析,现报道如下。
1 材料与方法
1.1标本来源
选取2014年登革热暴发流行期间在本院感染科住院的35例患者。参照卫计委2014年制定的登革热诊疗指南(第二版)[3],所有入选患者为登革热确诊病例,其中男性20例,女性15例,年龄15~83岁,平均年龄41.3岁。收集患者急性期血清,4℃、3 000 r/min(离心半径5 cm),低速离心5 min分离血清,置于-70℃冰箱冷冻保存。
1.2病毒培养分离及RNA提取
采用乳仓鼠肾细胞-21(baby hamster syrian kidey,BHK-21)分离患者血清样本中登革病毒。BHK-21细胞由南方医科大学公共卫生与热带医学院微生物实验室惠赠。35份血清样本用维持液1∶10稀释后,接种至培养良好的单层BHK-21细胞,37℃吸附1 h后弃上清液,加入适量维持液,置37℃、5%二氧化碳CO2细胞培养箱中培养,每天在显微镜下观察细胞病变情况并拍照,6 d后传代。以出现细胞病变为阳性,盲传3代无细胞病变则为阴性。待>75%细胞出现病变时收取病毒。采用大连宝生生物工程有限公司的病毒RNA提取试剂盒提取分离株RNA。取阳性培养液上清200μl,加入200μl裂解缓冲液、20μl蛋白酶K和1.00μl Carrier RNA,56℃水浴10 min。加入200μl无水乙醇,充分混匀后移至核酸纯化柱中,离心后弃滤液,洗脱缓冲液洗脱病毒RNA,溶于50μl去离子水,于-20℃保存备用。
1.3病毒核酸检测和型别鉴定
参照Lanciotti等[4]所报道的方法,采用逆转录-半套式聚合酶链(reverse transcziption-polymerase chain reaction,RT-PCR)反应进行登革病毒核酸检测及亚型鉴定,引物序列由上海生工生物工程有限公司合成。
1.4RT-PCR扩增E基因
参考已报道的DENV-1(GenBank登录号:AF309641)基因组序列,用Primer 3.0分别设计合成2对DENV-1的E基因扩增测序引物,引物序列为:DENV-1-E-正向引物1:5´-GCGTTCCATTTGA CTACACGATGG-3´,DENV-1-E-反向引物1:5´-AT GGTGTTGTTGACAATGAAAGC-3´,目标产物长度为1 108 bp;DENV-1-E-正向引物2:5´-CAGTAAT AGTCACCGTCCACA-3´,DENV-1-E-反向引物2:5´-GTTGTAGGAGATGTTGCTGGGAT-3´,目标产物大小为1 234 bp,片段可完全覆盖E基因区域。采用大连宝生生物工程有限公司二步法RT-PCR试剂盒进行检测。第一步将病毒RNA逆转录为cDNA:取3μl病毒RNA作为模板,加入随机的6核苷酸引物、4种脱氧核苷三磷酸混合液,无RNA酶水补足到10μl,65℃保温5 min后4℃冷却进行变性、退火反应,在上述反应液中依次加入RNA酶抑制剂、逆转录酶、5×缓冲液,无RNA酶水补足到20μl,于30℃、10 min,42℃、30 min逆转录反应,95℃、5 min 后4℃冷却,灭活逆转录酶。第二步进行PCR反应,反应液组成:10×PCR缓冲液5μl、4种脱氧核苷三磷酸混合物(各10 mmol)2μl、Taq DNA聚合酶(5 u/μl)0.5μl、正向引物和反向引物(10μmol)各0.5μl、逆转录液5μl,无RNA酶水补足到50μl。反应条件为:94℃预变性2 min,94℃变性30 s,55℃退火30 s,72℃延伸90 s,共35个循环,72℃继续延伸10 min。用Tris-硼酸缓冲液配制含0.5μg/ml溴化乙锭的1.5%的琼脂糖凝胶,取5μl PCR产物,与1μl上样缓冲液混和,在Tris-硼酸缓冲液中以80 V恒压电泳1 h,在透射式紫外分析仪上观察,并拍照记录实验结果。如果条带的分子质量与预期片段大小相同,则判断为阳性结果。
1.5序列测定和拼接
PCR产物由上海生工生物工程有限公司纯化后进行正、反向测序。测序完成后,将测序结果分别用美国生物技术信息中心(National Center for Biotechnology Information,NCBI)网站提供的在线软件进行序列分析,确认无误后,各片段序列采用DNA Star软件中的SeqMan拼接成完整的E基因序列。
1.6基因序列的同源性和进化分析
利用NCBI BLASTn对GenBank基因数据库进行同源性检索,并利用Clustalx(1.83)软件进行同源性比较。用MEGA 4.1的邻接法(Neighbor-Joining)完成系统发生树的构建。模型采用Kimura 2-Parameter model,Bootstrap值设定为1 000。
2 结果
2.1DENV分离培养结果
用BHK-21细胞对35份血清样本进行病毒分离培养,其中21份标本出现细胞肿胀变圆、空泡结构(见图1)。病毒分离阳性率为60.0%。
2.2RT-PCR反应鉴定DENV型别
对21份阳性培养液上清提取病毒RNA后,用RT-PCR反应检测登革病毒核酸并鉴定型别,通用引物进行第一轮扩增后,21株分离株可扩增出511 bp片段,与实验设计的大小吻合。将第一轮扩增产物作为模板进行第二轮扩增,获得482 bp DENV-1型特异性条带,阴性对照未见任何条带。见图2。
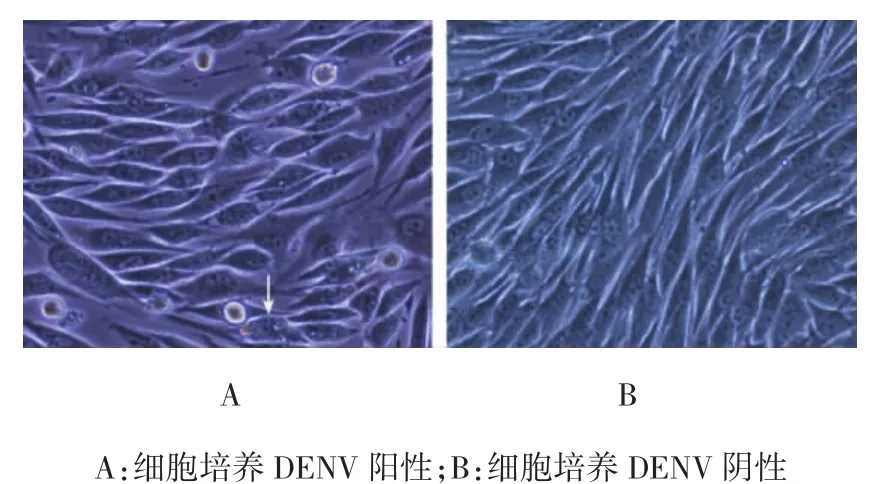
图1 BHK-21细胞分离培养DENV结果(×200)
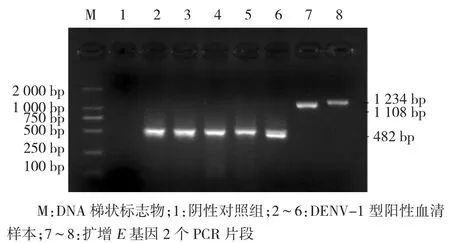
图2 DENV-1 RT-PCR反应分型检测及E基因扩增电泳结果

图3 2014年深圳市6株DENV-1型E基因推导的氨基酸同源性分析
2.3DENV-1型E基因的RT-PCR扩增及序列测定
选取症状典型、发病时间早、发病地点不同的6株分离株进行E基因扩增,所有标本在1000~2000bp出现明显目的条带(见图2)。经测序及拼接后显示,所有分离株E基因全长1 485 bp,推导编码495个氨基酸,未发现序列插入或缺失,核苷酸差异广泛分布于整个序列。
2.4DENV-1型E基因同源性分析
6株深圳DENV-1分离株E基因核苷酸同源性为100.0%,推导的495个氨基酸序列亦完全一致(见图3)。将2014年深圳市DENV-1分离株与国内30年来部分年份DENV-1流行株进行E基因同源性比较(见附表),结果显示,深圳市DENV-1分离株与国内2010、2007和2004年份分离到的Shenzhen2010(JN029813)、Zhuhai2007(EU359008)、Fujian2004(DQ193572)流行株同源性较高,核苷酸同源性在98.9%~99.5%,氨基酸同源性为99.4%~100.0%,尤其与Shenzhen2010(JN029813)的同源性最高,核苷酸及氨基酸同源性分别为99.5%和99.8%;与其他国家分离到的DENV-1毒株,如Singpore2014(KJ806961)、Singpore2009(JF960216)、Singpore2004(EU069606)、Japan2004(AB178040)有很高的相似性,与这些毒株在该区域的核苷酸同源性最高达99.7%,氨基酸同源性最高达100.0%。6株深圳市DENV-1分离株与上述DENV-1型毒株E蛋白区氨基酸序列相似,均各有2个糖基化位点,分别位于E蛋白区的第67~70和153~156位,E蛋白相关毒力位点E(44)、E(156)、E(366)处均无变异。
2.5E基因进化分析
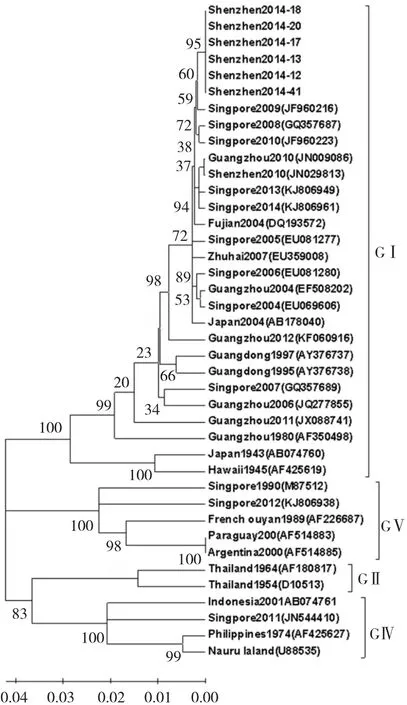
图4 2014年深圳市DENV-1分离株E基因系统进化树分析
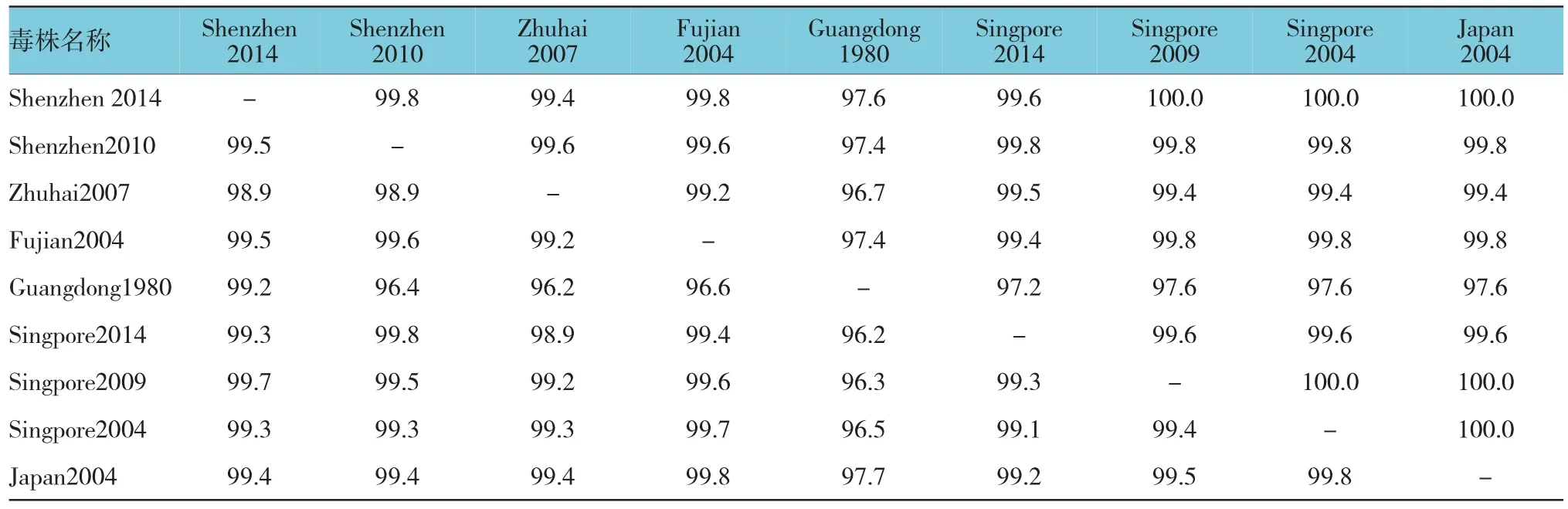
附表 2014年深圳市DENV-1分离株核苷酸及推导氨基酸序列同源性比较 %
为进一步分析深圳D1分离株的进化关系,笔者将6株深圳DENV-1分离株的E基因序列与基因库中下载的世界其他流行区分离株的序列相比对,并绘制基因系统进化树(见图4)。40株登革1型毒株被分成4个基因亚型,分别对应Goncalvez等[10]的Ⅰ、Ⅱ、Ⅳ、Ⅴ基因型。6株深圳市DNEV-1分离株位于基因型Ⅰ型进化支上,与Shenzhen2010 (JN029813)、Fujian2004(DQ193572)、Singpore2009 (JF960216)、Japan2004(AB178040)亲缘关系较近,位于同一分支内。
3 讨论
登革病毒根据抗原性不同分为4个血清型,分别为DENV-1、DENV-2、DENV-3及DENV-4,依据病毒E基因不同又可以分成不同基因亚型(genotype)GⅠ~GⅤ,不同的地理区域流行着不同的血清型和基因亚型[5,12]。广东省以DENV-1为主要流行的血清型,其中优势基因亚型为GⅠ亚群,少数为GⅣ亚群[6-7]。通过测定病毒核酸或蛋白序列,比较分析序列间的同源性和进化关系,从分子水平追踪传染源,对病原进行溯源,是目前病毒分子流行病学调查的主要手段之一。由于登革病毒包膜蛋白由E基因所编码,位于病毒颗粒表面,构成颗粒的突起,是主要的结构蛋白。其决定病毒的组织亲嗜性,并介导病毒与细胞受体的结合[8],同时还是影响毒力,诱导特异性的保护性中和抗体及免疫病理损伤的重要成分[9]。因此,E基因是分析登革病毒基因亚型、病毒变异与进化的最适片段。
本研究中6株DENV-1分离株E基因全长为1 485bp,编码495个氨基酸,未见序列插入或缺失。6株病毒分离株E基因同源性达100.0%,表明虽然深圳DENV-1分离株的样本来源不同,即患者不同、发病时间不同、发病地点不同,但是分离株为同一性状的登革1型病毒,即6例患者为同一毒株感染引起的子代患者。结合患者流行病学资料分析,6例患者为深圳市居民。所有患者在发病前1个月在深圳市居住,无输血史、无外出史,缺乏输入性感染的依据。因此可以判断6株深圳市DENV-1分离株为2014年深圳市本地流行株。
E基因同源性分析显示,2014年深圳市DENV-1分离株与国内2010、2007和2004年份分离到的流行株同源性较高;与其他国家流行的DENV-1分离株在该区域的同源性比较,相似性较高的主要是新加坡和日本等地流行株。2002年,Goncalvez等[10]利用DENV-1全长E蛋白编码基因进行系统发育分析,将世界各地分离的44株DENV-1分离株分为5个基因型:Ⅰ型,以HAWAII/1945分离株为代表;Ⅱ型,以泰国20世纪50、60年代分离株为代表;Ⅲ型,只有Sylvatic株;Ⅳ型,包括West Pacific株、Austria分离株;V型,主要包括美洲一些分离株。将本次疫情中分离到的6株深圳DENV-1分离株与其他DENV-1型病毒分离株进行比较,根据E蛋白编码基因构建系统进化树,6株深圳DNEV-1分离株位于GⅠ亚群进化支上,与Shenzhen2010(JN029813)、Fujian2004(DQ193572)、Singpore2009(JF960216)、Japan2004(AB178040)亲缘关系较近。
为进一步揭示深圳市登革热流行病学概况,本实验将2014年6株深圳DENV-1分离株与2010年深圳DENV-1分离株比较发现,两者高度同源且进化距离相当接近,传播链时隔4年,提示本次流行的DENV-1与2010年流行株关系密切,因此笔者推测2010年流行株本地化并引起2014年登革热流行的可能性。无论从E基因的核苷酸序列还是氨基酸序列来看,2010和2014年深圳市分离株都是与新加坡2008、2009、2010、2013和2014年份分离到的Singpore2008(GQ357687)、Singpore2009(JF960216)、Singpore2010(JF960223)、Singpore2013(KJ806949)、Singpore2014(KJ806961)流行株最为接近,而该5株新加坡分离株之间核苷酸同源性为99.1%~99.8%,氨基酸同源性为99.6%~100.0%,可以认为是同一来源的分离株。进一步分析发现,Singpore2008 (GQ357687)、Singpore2009(JF960216)、Singpore2010 (JF960223)、Singpore2013(KJ806949)、Singpore2014 (KJ806961)与Singpore2004(EU069606)有极高的相似性,核苷酸及氨基酸序列的同源性>99.5%;而Singpore2004(EU069606)与Japan2004(AB178040)高度相关,两者同源性达99.9%。因此笔者推断,2010和2014年深圳DENV-1流行株是输入性的,极有可能是Japan2004(AB178040)(由密克罗尼西亚传人日本),于2004年由日本传入中国的福建、广东及新加坡,之后该毒株一直在新加坡和中国循环,并传入深圳市,在深圳市发生独立进化,于2010和2014年引起深圳市本地暴发流行。
理论上,一个地区连续发生输入性病例与本地暴发流行,加上人口增长及流动性增加等因素,可能使其从无DF流行地区(无病毒存在)变为低地方性流行区(一种血清型别流行)和高地方性流行区(多种病毒血清型别流行)[11-12]。深圳市作为中国的窗口城市,处于登革热流行地区的包围中,国内外交往和人口流动频繁,输入性病例不断增加;地处亚热带,气候温暖潮湿,雨量充沛,利于蚊媒孳生,并且探明存在传播媒介白纹伊蚊[13]。此外,对深圳市16~60岁健康人群登革热抗体水平调查中,检测到登革病毒IgG抗体阳性率为4.3%,从而证实登革热隐形感染的存在[14]。特别是2010年深圳市福田报道首起本地登革热暴发流行,客观上说明深圳市地区已存在登革热流行条件。而2014年深圳市登革热再次出现本地流行,更应该引起疾病预防控制机构的警惕,尽早做好各项防控措施,阻止深圳市转变为登革热的中等地方性流行区,甚至高等地方性流行区。
参考文献:
[1]姜舒,柯昌文.全球登革热流行现状分析[J].国际流行病学传染病学杂志, 2011, 38(3): 194-197.
[2]阳帆,张仁利,陈思敏,等.深圳市登革热暴发疫情的分子病毒学分析[J].中华传染病杂志, 2012, 30(7): 429-434.
[3]国家卫生与计划委员会.登革热诊疗指南(2014年第2版)[J].中国医药科学, 2014, 4(21): 221-224.
[4] Lanciotti RS, Calisher CH, Gubler DJ, et al. Rapid detection and typing of dengue viruses from clinical samples by using reverse transcriptase-polymerase chain reaction[J]. J Clin Microbiol, 1992, 30(3): 545-551.
[5] Araújo JM, Nogueira RM, Schatzmayr HC, et al. Phylogeography and evolutionary history of dengue virus type 3[J]. Infection, Genetics and Evolution, 2009, 9(4): 716-725.
[6] Zheng K, Zhou HQ, Yan J, et al. Molecular characterization of the E gene of dengue virus type l isolated in Guangdong province ,China, in 2006 [J]. Epidemiol Infect, 2009, 137 (1): 73-78.
[7]朱军民,陈炜,尚伟龙,等.登革1型病毒GZ2002株全基因组测序与分析[J].中国现代医学杂志, 2012, 22(14): 25-33.
[8] Moreno-Altamirano MM, Sánchez-García FJ, Munozn~ ML, et al. Non Fc receptor-mediated infection of human macrophages by dengue virus serotype 2[J]. J Gen Virol, 2002, 83(5): 1123-1130.
[9] Leitmeyer KC, Vaughn DW, Watts DM, et al. Dengue virus structural differences that correlate with pathogenesis[J]. J Virol, 1999, 73(6): 4738-4747.
[10] Goncalvez AP, Escalante AA, Pujol FH, et al. Diversity and evolution of the envelope gene of dengue virus type 1[J]. Virology, 2002, 303(1): 110-119.
[11]张复春,卢成业,陈燕清,等. 2002至2003年广州及周边地区1032例登革热的临床特征[J].中华传染病杂志, 2005, 23(2): 121-124.
[12] Sang SW, Chen B, Wu HX, et al. Dengue is still an imported disease in China: A case study in Guangzhou[J]. Infection, Genetics and Evolution, 2015, 32: 178-190.
[13]林良强,张韶华,梁焯南,等.深圳市2012年病媒生物调查与分析[J].中国媒介生物学及控制杂志, 2014, 25(2): 180-182.
[14]周健明,林琳,刘渠,等. 2011年深圳市健康人群登革热抗体水平及影响因素分析[J].中国人兽共患病学报, 2012, 28(8): 850-853.
(童颖丹编辑)
临床论著
Molecular phylogenetic analysis of type 1 strains of dengue virus isolated in Shenzhen City during the 2014 dengue outbreak*
Zhen-yuan Ma, Cheng-hui Huang, Xin-zhi Zhang, Shi-liang Zhong, Jian-hua Tian
(The Affiliated Shenzhen Baoan Hospital, Southern Medical University, Shenzhen, Guangdong 518101, China)
Abstract:Objective To determine the envelope (E) gene sequence of type 1 dengue virus (DENV-1) isolated in Shenzhen in 2014, and to understand the molecular virology characteristics of these strains as well as to explore their possible origin. Methods Thirty-five serum samples were collected from patients with dengue fever. Dengue virus was isolated by BHK-21 cells and the serotypes were detected by semi-nested polymerase chain reaction (PCR). The E gene of the isolated strains was amplified by RT-PCR and sequenced. Homological and phylogenetic trees were also constructed based on the E gene of isolated dengue virus strains. Results Totally 21 strains were isolated from 35 samples and identified as type 1 dengue virus. The complete coding region of E genes from 6 strains of DENV-1 was all composed of 1,485 nucleotides which encoded 495 amino acids. Nucleotide sequence homology of 6 strains of DENV-1 was 100.0%identical, and their homology was very similar to the epidemic strains of DENV-1 virus in Shenzhen in 2010. The homology of the nucleotide sequence and the deduced amino acid sequence was 99.5% and 99.8%respectively. Compared with epidemic DENV -1 strains isolated from other countries, DENV-1 from Shenzhen in 2014 was close to the strains isolated in Singpore and Japan, and the highest homology of their E genes and the deduced amino acids was 99.7% and 100.0%. The phylogenetic tree of E genes indicated that the 6 strains of DENV-1 had the greater similarity with Shenzhen2010, Singpore2009 and Japan2004; and they all belonged to the genotype GⅠ. Conclusions DENV-1 strains from Shenzhen in 2014 belonged to thebook=40,ebook=46genotype GⅠ. They most likely originated from Southeast Asian countries. These epidemic dengue virus strains had been settled down in Shenzhen in 2010 and caused 2014 dengue fever outbreak.
Keywords:dengue fever; dengue virus; Egene; sequencing; phylogenetic tree
[通信作者]黄呈辉,E-mail:hchuisz@126.com
*基金项目:深圳市宝安区科技计划项目(No:2015253)
收稿日期:2015-08-14
文章编号:1005-8982(2016)03-0039-06
DOI:10.3969/j.issn.1005-8982.2016.03.008
中图分类号:R512.8
文献标识码:A
