PA-MSHA引起注射局部急性炎症及白细胞介素17、肿瘤坏死因子α和Toll样受体4的表达改变
2016-03-05刘玉凤刘丹阳高青刘国元曾文姣
刘玉凤,刘丹阳,高青,刘国元,曾文姣
复旦大学基础医学院病理系,上海 200032
PA-MSHA引起注射局部急性炎症及白细胞介素17、肿瘤坏死因子α和Toll样受体4的表达改变
刘玉凤,刘丹阳,高青,刘国元,曾文姣
复旦大学基础医学院病理系,上海 200032
摘要:为研究皮下注射铜绿假单胞菌甘露糖敏感血凝菌毛株(Pseudomonasaeruginosamannose sensitive hemagglutinin,PA-MSHA)注射液后局部组织的病理学改变及白细胞介素17(interleukin 17,IL-17)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和Toll样受体4(Toll-like receptor 4,TLR4)表达情况,将30只小鼠随机分为两组,分别皮下注射PA-MSHA和生理盐水,在注射后6、12、24、48及72 h取注射局部组织,苏木精-伊红(hematoxylin-eosin,HE)染色后观察病理形态改变,并用免疫组化染色和图像分析检测IL-17、TNF-α和TLR4表达水平。结果显示,小鼠皮下注射PA-MSHA后,在给药部位引起以中性粒细胞浸润为主的急性炎症;局部炎症灶中IL-17、TNF-α和TLR4表达在注射后6 h升高,24 h达到高峰,然后逐渐减低,至72 h实验组与对照组无差异;3种炎症因子的表达与炎症反应程度相平行。结果表明,皮下注射PA-MSHA能引起局部组织急性炎症反应,且能改变局部免疫状态。
关键词:铜绿假单胞菌甘露糖敏感血凝菌毛株;白细胞介素17;肿瘤坏死因子α;Toll样受体4
铜绿假单胞菌甘露糖敏感血凝菌毛株(Pseudomonasaeruginosamannose sensitive hemagglutinin, PA-MSHA)是一种生物工程技术制备的新型铜绿假单胞菌灭活制剂,该菌株周身密布MSHA型菌毛[1-2]。铜绿假单胞菌又称绿脓杆菌,在自然界中分布广泛,存在于水、土壤、空气、人和动物机体皮肤及肠道中[3]。菌毛是微生物表面所带的纤细而短小的发样微丝,具有多种成分和功能,参与致病性微生物黏附感染过程,有很强的免疫原性。MSHA型菌毛能引起人或动物红细胞发生血凝,且该血凝现象能被D-甘露糖抑制。MSHA型菌毛具有较其他型菌毛恒定的遗传编码、蛋白组成、氨基酸序列,以及分子大小不等的菌毛素亚单位,广泛存在于多个不同种属的细菌[4]。我国微生物学者牟希亚借鉴铜绿假单胞菌菌体毒性低、有诱导生成干扰素和分裂原及抗癌活性、能刺激多克隆B细胞和Th细胞的特征,首次于1984年从临床标本中筛选出一株MSHA阳性铜绿假单胞菌,经过一年多的传代,增强并保持其MSHA性质,建成一株新型“PA-MSHA菌毛株”。由此菌株制成的疫苗,对多种能形成MSHA菌毛株的细菌感染有显著的交叉保护作用及交叉血清学反应[5-6]。 PA-MSHA还能作为免疫调节剂,调节机体细胞免疫和体液免疫,增强机体抗感染和抗肿瘤能力[7-10]。
目前PA-MSHA作为临床药物,用于包括乳腺癌、膀胱癌、肺癌等多种恶性肿瘤的辅助治疗。体内外实验证实PA-MSHA能抑制肿瘤生长、抗肿瘤转移和延长生存期[11-14],对其作用机制的研究方兴未艾。目前对该药物引起的注射部位局部组织病理学改变及免疫因子表达水平报道甚少。本研究旨在探讨皮下注射PA-MSHA后引起局部组织的病理学改变及白细胞介素17(interleukin 17,IL-17)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和Toll样受体4(Toll-like receptor 4,TLR4)的表达情况,阐明其对局部组织的影响,为评估局部用药安全提供实验依据。
1材料与方法
1.1动物实验
6~8周龄雄性BALB/c小鼠30只(上海斯莱克实验动物有限公司),体重30~35 g,随机分为两组,分别在颈背部皮肤注射1 mL生理盐水或PA-MSHA(北京万特尔生物制药有限公司)。注射后6、12、24、48及72 h每组各处死3只小鼠。
1.2取材、制片及染色
取注射点半径0.5 cm左右的皮肤及皮下组织,固定于10%甲醛溶液。常规制作石蜡组织块,4 μm连续切片,苏木精-伊红(hematoxylin-eosin,HE)染色。
1.3免疫组化染色
切片脱蜡后,去内源性过氧化物酶(0.9% H2O2-甲醇溶液),抗原修复(0.01 mol/L柠檬酸缓冲液,pH 6.0,微波8 min),正常羊血清(1∶20)封闭。加1∶50稀释第一抗体(兔抗小鼠IL-17、兔抗TLR4和兔抗鼠TNF-α,均购自Abcam公司,货号分别为ab24674、ab47093和ab34674),37 ℃孵育1 h,4 ℃过夜。次日,加即用型第二抗体(羊抗兔IgG-HRP,Santa Cruze公司,sc-2004;或羊抗鼠/抗兔IgG-HRP,Invitrogen公司,Lot1573394),37 ℃孵育0.5 h。二甲氨基偶氮苯(dimethylaminoazobenzene,DAB)显色(Dako公司),苏木精衬染。Tris-HCl缓冲液(Tris-HCl buffered saline, TBS)做空白对照。
1.4图像分析及统计分析
每张切片选取5个阳性染色最强的400倍视野,用i-Solution软件(IMT i-Solution Inc.)进行图像分析,计算阳性平均光密度×阳性面积%。统计各组阳性平均光密度×阳性面积%,计算平均值及标准差。运用SPSS10.0软件进行统计分析,组间差异采用t检验。
2结果
2.1局部病理变化
生理盐水注射后,在各时间点皮下组织中均未见炎症细胞浸润。PA-MSHA皮下注射后6 h,即可见局部以中性粒细胞为主的炎症细胞浸润。注射后12、24 h炎症反应达高峰,大量中性粒细胞浸润,形成较宽的炎症细胞聚集带。48 h炎症反应有所减轻,炎症细胞聚集带变窄。72 h炎症细胞聚集带消失,但皮下组织中有较多散在分布的炎症细胞(图1)。
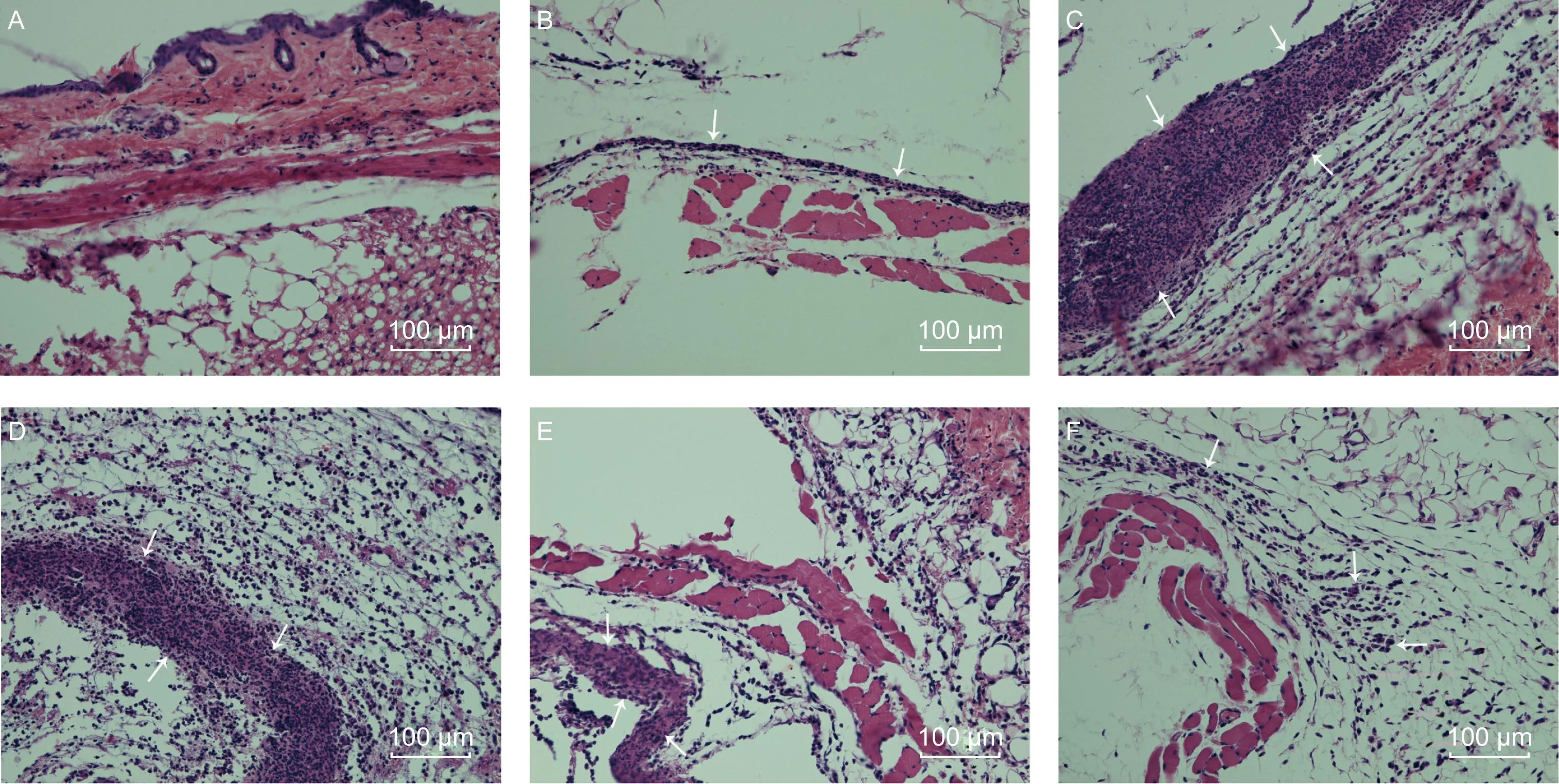
A: No inflammation in subcutaneous tissue 24 h after normal saline injection; B-F: Representative photographs of subcutaneous tissue 6 h, 12 h, 24 h, 48 h and 72 h after PA-MSHA injection, respectively. A neutrophil-dominated inflammation appeared 6 h after PA-MSHA injection (arrows) (B); 12 h and 24 h after PA-MSHA injection, a large amount of neutrophil infiltration formed wide inflammatory cell accumulation zones (arrows) (C, D). 48 h after PA-MSHA injection, the inflammatory cell accumulation zones narrowed (arrows), and the peripheral inflammatory cells reduced (arrows) (E). 72 h after PA-MSHA injection, the inflammatory cell accumulation zones disappeared, and a small number of inflammatory cells scattered in subcutaneous tissue (arrows) (F).
图1皮下注射后局部病理学改变
Fig.1Pathological changes of local tissues after administration of PA-MSHA
2.2IL-17、TNF-α和TLR4表达情况
对照组注射点皮下组织在各时间点均未有IL-17、TNF-α和TLR4阳性细胞。实验组IL-17阳性细胞出现在PA-MSHA注射后6 h的炎症病灶内,注射后12、24 h的炎症聚集带内有较多阳性细胞,48 h后阳性细胞减少,72 h后仅可见散在分布的阳性细胞表达。实验组TNF-α阳性细胞分布范围和变化趋势类似于IL-17,但染色更强,阳性细胞数量更多。TLR4阳性细胞在注射PA-MSHA后6 h的皮下组织内即可见;注射后12、24、48 h阳性细胞数增多,分布于炎症聚集带及周围区域;72 h后有散在阳性细胞分布于皮下组织内(图2)。
图像定量分析结果显示,与对照组比较,PA-MSHA注射后6 h局部组织中IL-17、TNF-α和TLR4表达升高(P<0.01);12、24 h后继续升高,3种炎症因子表达水平高峰均在注射后24 h;48 h后表达水平有所下降,但依然高于对照组(P<0.01);注射后72 h,3种炎症因子的表达在实验组与对照组之间的差异均无统计学意义(P>0.01)(图3~5)。3种炎症因子表达水平的变化与炎症反应程度相一致。
3讨论
PA-MSHA的有效物质基础是MSHA菌毛上的甘露糖结合蛋白,能特异性地结合高甘露糖表达型的肿瘤细胞,具有直接杀伤肿瘤、抑制肿瘤侵袭和转移的作用[1-2]。PA-MSHA还具有广谱高效价跨越菌属的免疫原性,能诱导机体免疫,提高机体免疫应答水平,起到免疫监视、抑制和杀伤癌细胞的作用[7-10]。
PA-MSHA用于肿瘤辅助治疗时,传统给药方式为皮下注射,此外还有术中局部喷洒、胸/腹腔注射及针对膀胱肿瘤的膀胱灌注等给药方式[11-13]。相较于其他化疗药物,患者对PA-MSHA的耐受性较好。但也有文献报道PA-MSHA皮下注射可导致注射局部皮肤的红肿热痛及硬结(发生率100%),其次是高热、寒战(发生率43.3%)[14]。因此,对药物接触区域局部病理变化和免疫相关细胞因子的研究,有助于评估药物的安全性。

First row, representative photographs of subcutaneous tissue 24 h after normal saline (NS) injection. Second to sixth row, representative photographs of subcutaneous tissue 6 h, 12 h, 24 h, 48 h and 72 h after PA-MSHA injection, respectively. Arrows show positive cells (brown in color).
图2IL-17、TNF-α和TLR4免疫组化染色
Fig.2Immunohistochemical staining of IL-17, TNF-α and TLR4
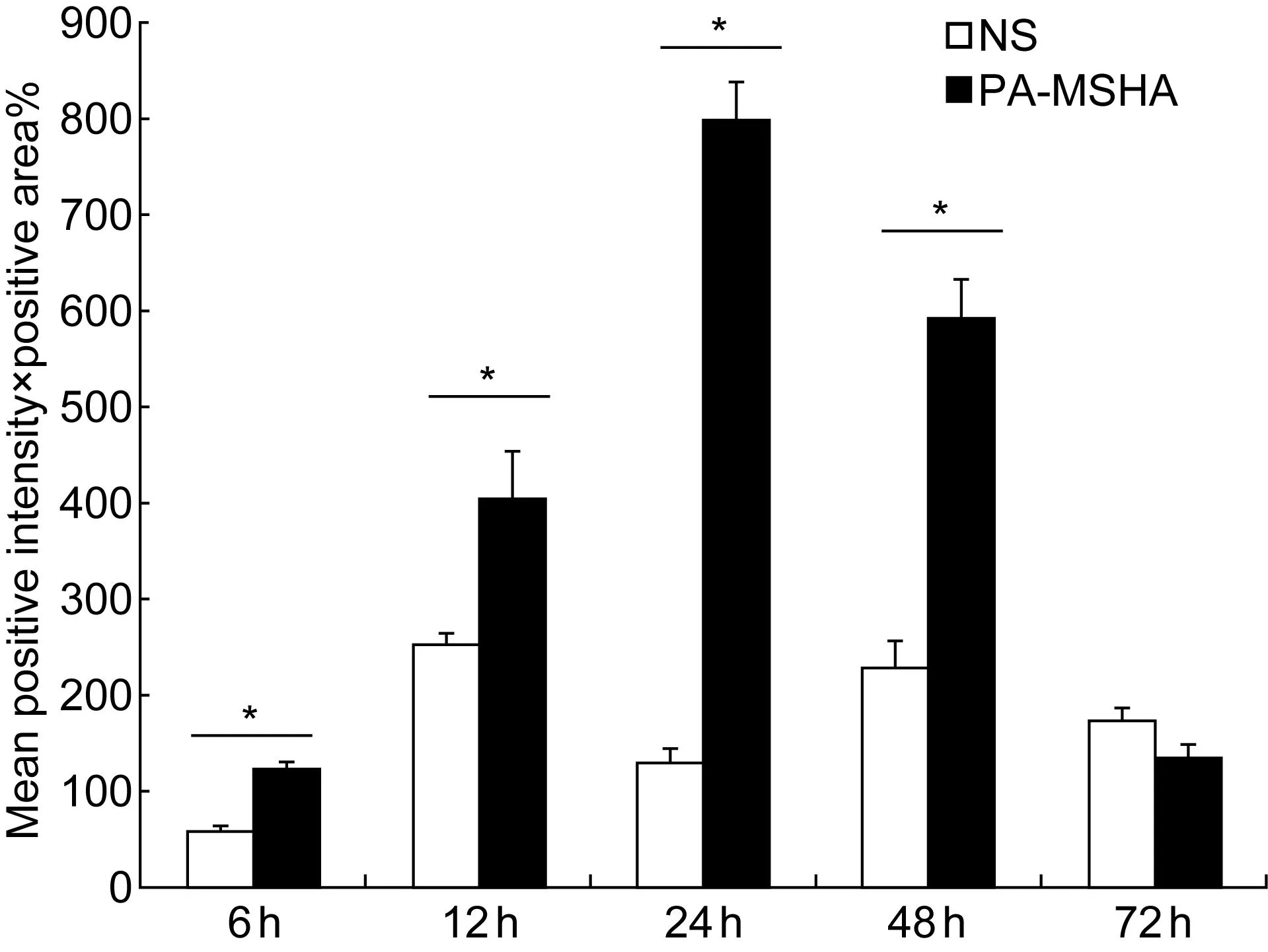
Expression levels of IL-17 in local tissues at 6 h, 12 h, 24 h, 48 h and 72 h after injection of normal saline(□) and PA-MSHA(■), determined by image analysis of IL-17 stained sections.*P<0.01 compared with the control group.
图3皮下注射后IL-17表达水平
Fig.3Expression levels of IL-17 after subcutaneous injection
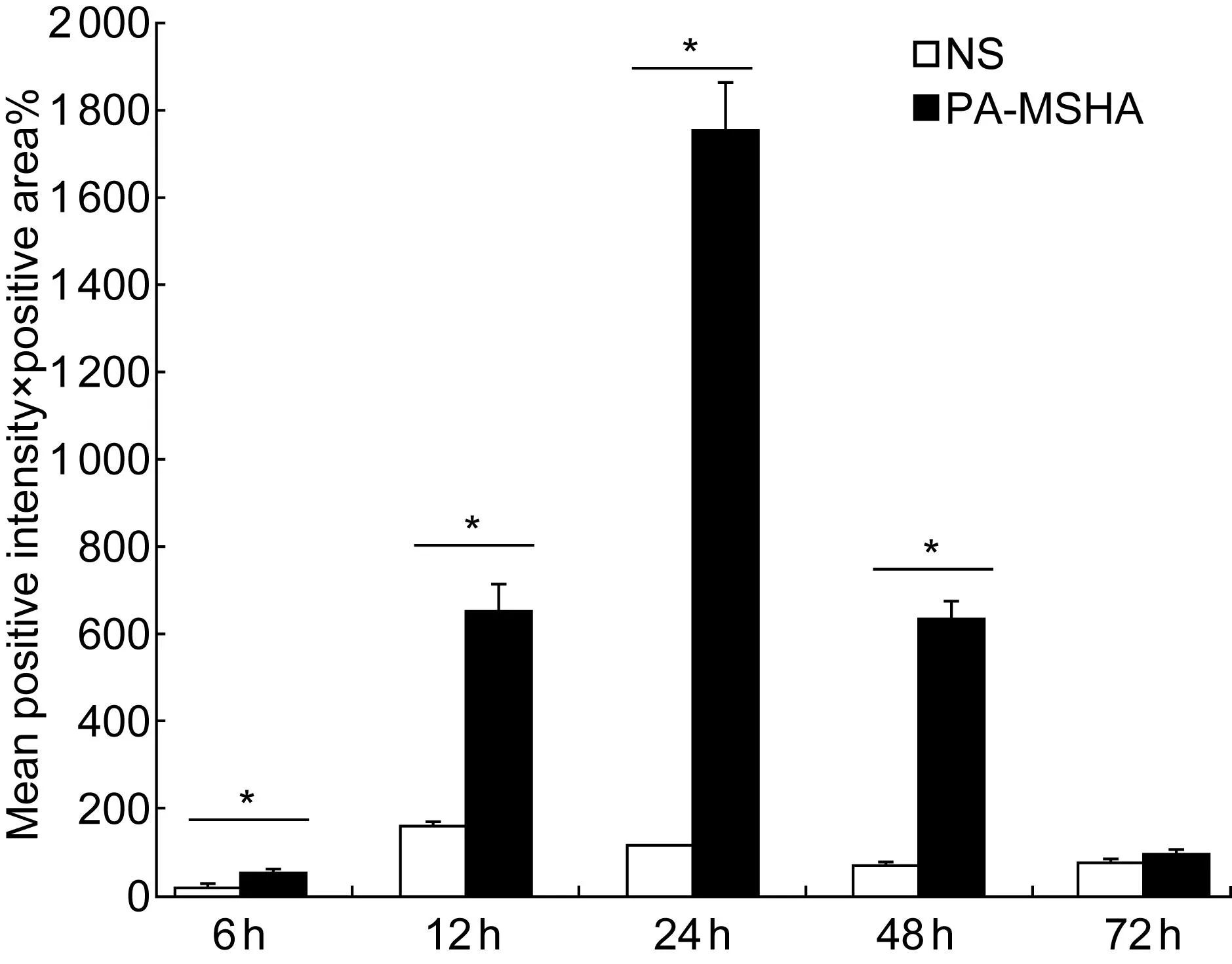
Expression levels of TNF-α in local tissues at 6 h, 12 h, 24 h, 48 h and 72 h after injection of normal saline(□) and PA-MSHA(■), determined by image analysis of TNF-α stained sections.*P<0.01 compared with the control group.
图4皮下注射后TNF-α表达水平
Fig.4Expression levels of TNF-α after subcutaneous injection
本实验显示,皮下注射PA-MSHA后,注射部位局部组织出现以中性粒细胞浸润为主的急性炎症,急性炎症因子IL-17、TNF-α表达明显提高。IL-17可由多种细胞分泌〔包括CD4+T细胞、中性粒细胞、自然杀伤细胞(natural killer,NK细胞)〕,具有强大的招募中性粒细胞和促进多种细胞进一步释放炎症因子的作用[15]。TNF-α是由激活的巨噬细胞产生的细胞因子,是机体受病毒、内毒素脂多糖、细菌胞壁酰二肽及非特异性佐剂 (如卡介苗) 等
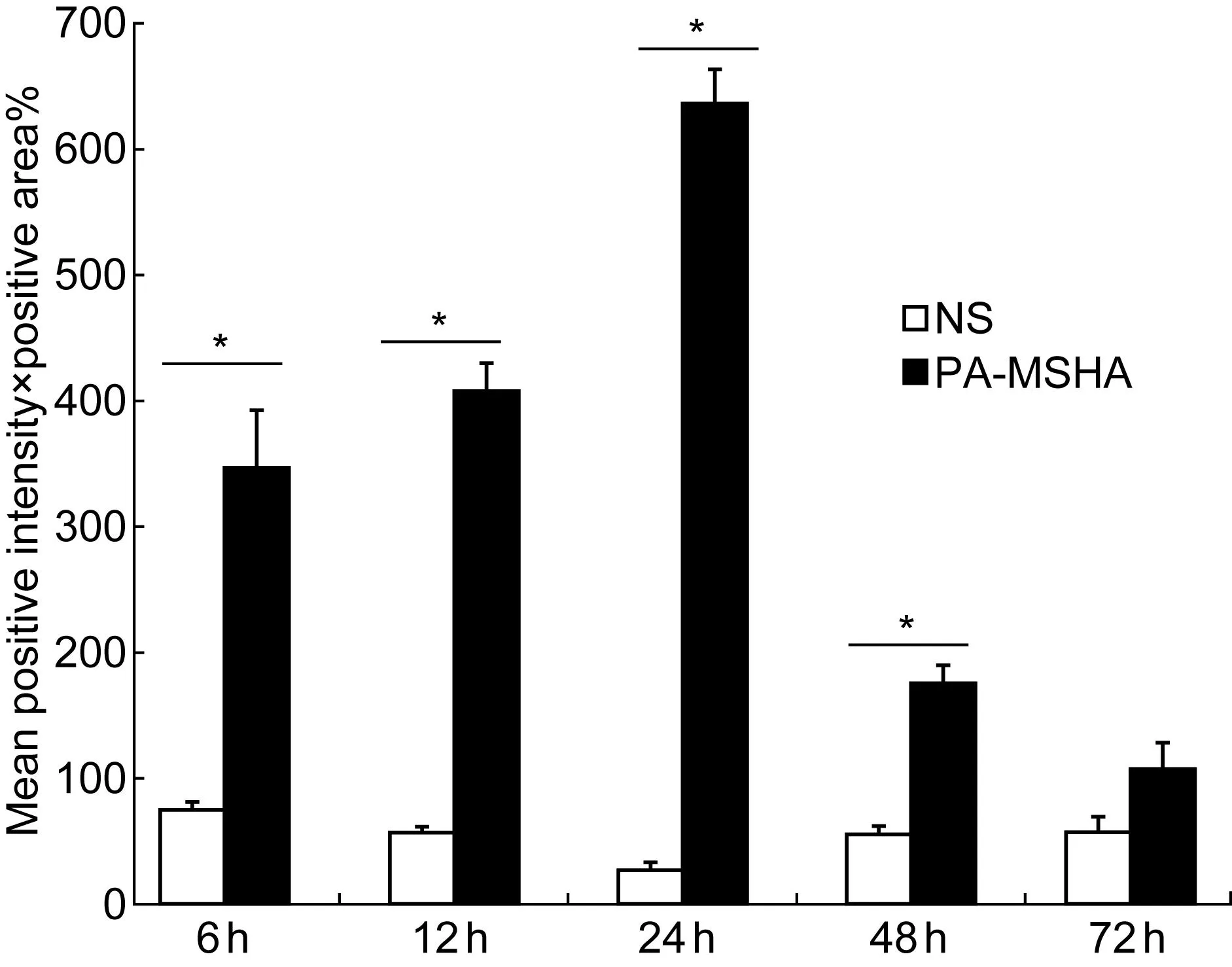
Expression levels of TLR4 in local tissues at 6 h, 12 h, 24 h, 48 h and 72 h after injection of normal saline(□) and PA-MSHA(■), determined by image analysis of TLR4 stained sections.*P<0.01 compared with the control group.
图5皮下注射后TLR4表达水平
Fig.5Expression levels of TLR4 after subcutaneous injection
作用后产生最快且达峰最早的炎症介质[16]。这可以解释临床上药物注射后造成局部皮肤红肿热痛及硬结的原因。但这种反应在药物注射后72 h消失,对机体的影响有限。
TLR家族是感受病原体入侵的一类模式识别受体,在已发现的11种TLR中,TLR4与革兰阴性细菌及其内毒素的识别和激活作用有关,在机体天然免疫过程中发挥重要作用[17]。本研究发现,PA-MSHA作为铜绿假单胞菌(革兰阴性菌)减毒制剂,引起注射局部组织炎症区TLR4表达升高,进一步佐证了PA-MSHA可通过TLR4发挥作用。
TLR4主要表达于骨髓来源的细胞,如巨噬细胞、树突细胞、淋巴细胞及NK细胞等免疫细胞表面。TLR4与配体如内毒素(外源性)、高迁移率族蛋白1(high mobility group box-1 protein,HMGB1)(内源性)等的结合可活化下游多条信号通路(如MyD88、丝裂原相关蛋白),诱导免疫反应发生[18]。在抗肿瘤研究中,PA-MSHA能有效促进小鼠骨髓来源的树突细胞成熟,由此树突细胞诱导的活化T细胞对肿瘤细胞的杀伤效应显著增强[19]。进一步研究显示,PA-MSHA通过TLR4介导树突细胞促进T细胞反应,减缓荷瘤(Lewis肺癌)小鼠肿瘤进展;PA-MSHA治疗后,肿瘤部位T细胞数量增多、成熟树突细胞增多[20]。作为机体屏障的皮肤组织内亦含有树突细胞[21],但由于本研究未做特异性免疫组化染色标记树突细胞,故目前还不能判断局部TLR4阳性细胞是否包括皮肤内的树突细胞。
综上所述,本研究显示PA-MSHA引起皮下注射位点局部组织急性炎症及IL-17、TNF-α表达升高,解释了该药物在临床应用中常见不良反应的原因;而注射后72 h炎症消失及这两种炎症因子表达下降,表明其对机体注射局部影响有限,用药是安全的。同时,PA-MSHA引起局部给药区域TLR4表达升高,显示其作为免疫佐剂能改变局部免疫状态。
参考文献
[1]Li T, Dong ZR, Guo ZY, Wang CH, Zhi XT, Zhou JW, Li DK, Chen ZT, Chen ZQ, Hu SY. Mannose-mediated inhibitory effects of PA-MSHA on invasion and metastasis of hepatocellular carcinoma via EGFR/Akt/IκBβ/NF-κB pathway [J]. Liver Int, 2015, 35(4): 1416-1429.
[2]Liu ZB, Hou YF, Min-Dong, Di GH, Wu J, Shen ZZ, Shao ZM. PA-MSHA inhibits proliferation and induces apoptosis through the up-regulation and activation of caspases in the human breast cancer cell lines [J]. J Cell Biochem, 2009, 108(1): 195-206.
[3]童善庆.假单胞菌属 [M].见:闻玉梅.现代微生物学.上海:上海医科大学出版社,1999:383-393.
[4]牟希亚.微生物菌毛抗原组成及功能研究 [J].中国微生态学杂志,1990,2(3):72-77.
[5]牟希亚.绿脓杆菌甘露糖敏感血凝素菌毛株的建立 [J].微生物学报,1986,26(2):176-179.
[6]牟希亚,郭雁群,付宏文.PA菌毛株菌苗的应用研究 [J].大连医学院学报,1990,12(2):63-69.
[7]Li T, Yang L, Fu SJ, Xiao EL, Yuan X, Lu JZ, Ma BL, Shi TK, Wang ZP. Subcutaneous injections of the mannose-sensitive hemagglutination pilus strain of pseudomonas aeruginosa stimulate host immunity, reduce bladder cancer size and improve tumor survival in mice [J]. Cell Biochem Biophys, 2015, 73(1): 245-252.
[8]Zhang Y, Wang H, Li Y, Chen K, Ye J, Liao X, Chen Y, Ran W. The pseudomonas aeruginosa mannose sensitive haemagglutination strain (PA-MSHA) induces a Th1-polarizing phenotype by promoting human dendritic cells maturation [J]. Indian J Microbiol, 2014, 54(2): 163-169.
[9]Zhang Z, Wang LP, Zhao XL, Wang F, Huang L, Wang M, Chen XF, Li H, Zhang Y. Pseudomonas aeruginosa injection enhanced antitumor cytotoxicity of cytokine-induced killer cells derived from cord blood [J]. Biomed Pharmacother, 2014, 68(8): 1057-1063.
[10]郑朝旭,冯强,徐泉,谢玉权,梁建明,袁兴华.胃癌患者铜绿假单胞菌制剂术中腹腔置药对免疫功能的影响 [J].中国肿瘤,2012, 21(5):379-382.
[11]蔡峥嵘.铜绿假单胞菌注射液胸腔注射治疗肺腺癌恶性胸水疗效观察 [J].临床肺科杂志,2015,20(7):1168-1170.
[12]林涛,宋纯,王辉.晚期结直肠癌术中使用铜绿假单胞杆菌制剂的生存期观察 [J].中国肺癌杂志,2009,19(6):639-641.
[13]宋希双,姜涛,吴东军,李丽,谭纬,高春章,殷积斌,车翔宇,毕玉彪.PA菌毛株菌苗膀胱灌注预防膀胱癌术后复发的研究 [J].中华泌尿外科杂志,2001, 22(10):597.
[14]陈卫东,唐中华,徐峰.TAC 方案联合使用绿脓杆菌制剂在乳腺癌新辅助化疗中的应用研究 [J].南方医科大学学报,2009,29(6):1204-1207,1211.
[15]秦志海,徐霞,倪琛.炎症性细胞因子与疾病 [M].第2版.北京:人民卫生出版社,2011:415-433.
[16]谢尹晶,段晋燕,兰晓梅,王成彬.临床常用感染性炎症指标的研究进展 [J].临床检验杂志(电子版),2013,2:327-333.
[17]Ramachandran G. Gram-positive and Gram-negative bacterial toxins in sepsis: a brief review [J]. Virulence, 2014, 5(1): 213-218.
[19]张敏,骆菲菲,黄恩宇,张丹,钱静,吴晓凤,储以微.PA-MSHA抗肿瘤效应的免疫机制研究 [J].复旦学报(医学版),2015,42(1):13-17.
[20]Zhang M, Luo F, Zhang Y, Wang L, Lin W, Yang M, Hu D, Wu X, Chu Y. Pseudomonas aeruginosa mannose-sensitive hemagglutinin promotes T-cell response via Toll-like receptor 4-mediated dendritic cells to slow tumor progression in mice [J]. J Pharmacol Exp Ther, 2014, 349(2): 279-287.
[21]Klechevskv E. Functional diversity of human dendritic cells [J]. Adv Exp Med Biol, 2015. doi: 10.1007/978-3-319-15774-0_4.
Corresponding author. ZENG Wenjiao, E-mail: wjzeng@fudan.edu.cn
·论著·
Pseudomonasaeruginosamannose sensitive hemagglutinin induced local acute inflammation in injected tissues
LIU Yufeng, LIU Danyang, GAO Qing, LIU Guoyuan, ZENG Wenjiao
Department of Pathology, School of Basic Medical Sciences, Fudan University, Shanghai 200032, China
Abstract:To study the pathological changes and expressions of interleukin 17 (IL-17), tumor necrosis factor α (TNF-α) and Toll-like receptor 4 (TLR4) in local tissues with administration ofPseudomonasaeruginosamannose sensitive hemagglutinin (PA-MSHA), 30 mice were randomly divided into two groups, and received subcutaneous injection of PA-MSHA and normal saline respectively. The local injection tissues were sectioned at 6, 12, 24, 48 and 72 h after injection, and the pathological changes and expressions of IL-17, TNF-α and TLR4 were detected by hematoxylin-eosin (HE) and immunohistochemical staining, and measured by image analysis. The results revealed that PA-MSHA caused acute inflammation with predominant neutrophil infiltration in the local injection tissues. In the inflammation lesions, the expression levels of IL-17, TNF-α and TLR4 were elevated at 6 h after injection, peaked at 24 h, then decreased gradually, and were comparable to the control group at 72 h. The expression levels of these three cytokines were consistent with the degree of inflammation. The data suggest that subcutaneous injection of PA-MSHA induces acute inflammation and changes the immunity state of local injection tissues.
Key words:Pseudomonasaeruginosamannose sensitive hemagglutinin; Interleukin 17; Tumor necrosis factor α; Toll-like receptor 4
收稿日期:(2015-12-17)
通信作者:曾文姣
