多重耐药肺炎克雷伯菌噬菌体KP002的生物学特性及基因组学研究
2016-03-05高晶徐彬郭晓奎秦金红
高晶,徐彬,郭晓奎,秦金红
1. 上海交通大学医学院,上海 200025; 2. 复旦大学附属妇产科医院,上海 200011; 3. 上海交通大学医学院附属新华医院崇明分院,上海 202150
多重耐药肺炎克雷伯菌噬菌体KP002的生物学特性及基因组学研究
高晶1,2,徐彬3,郭晓奎1,秦金红1
1. 上海交通大学医学院,上海 200025; 2. 复旦大学附属妇产科医院,上海 200011; 3. 上海交通大学医学院附属新华医院崇明分院,上海 202150
摘要:以上海某些医院临床分离到的多重耐药肺炎克雷伯菌为宿主菌,从不同环境的污水中分离获得1株肺炎克雷伯菌噬菌体KP002。电子显微镜显示其为有尾噬菌体,头部直径约70 nm,尾长约80 nm,尾宽约20 nm。对其生物学特性进行研究,结果显示此株噬菌体在pH 3~9及4~50 ℃的环境中具有较高活性;6 min吸附率达95%以上;潜伏期为10 min,爆发期为50 min;裂解量为172 pfu/cell。结果表明,该噬菌体对pH值和温度适应范围较宽。对其全基因组进行测序分析,结果显示其基因组为环状双链DNA,全长47 173 bp, GC含量为48%。本研究筛选获得1株对pH值和温度适应范围较宽的耐药肺炎克雷伯菌烈性噬菌体KP002,为建立耐药肺炎克雷伯菌的噬菌体库以用于治疗临床多重耐药菌感染提供了新的思路。
关键词:多重耐药肺炎克雷伯菌;噬菌体;基因组学
肺炎克雷伯菌是临床上最常见的重要条件致病菌和医源性感染细菌之一[1],易引起呼吸道、泌尿生殖道及血流感染。肺炎克雷伯菌的耐药问题已对公共卫生构成重大威胁[2]。国外临床研究显示,对于耐药细菌的治疗,噬菌体疗法具有良好的临床疗效[3]。本研究通过对耐药肺炎克雷伯菌噬菌体KP0002的生物学特性和基因组学进行分析,为噬菌体用于肺炎克雷伯菌感染的治疗提供基础。
1材料与方法
1.1噬菌体的分离和筛选
将临床分离获得的80株产超广谱β内酰胺酶(extended-spectrum β-lactamase,ESBL)和碳青霉烯酶的肺炎克雷伯菌作为宿主菌。从环境污水中取样本,在样本液中加入CaCl2至终浓度1 mmol/L,离心10 min;上清液经0.22 μm孔径的滤膜过滤后,与上述80株培养至对数期的混合菌液混合,37 ℃培养过夜;加入少量氯仿,4 ℃离心10 min,取上清液,与培养至对数生长期的菌株37 ℃孵育10 min,双层琼脂法铺平板,37 ℃培养过夜;将获得的噬菌斑纯化3次,进一步研究。
1.2CsCl不连续密度梯度离心法纯化噬菌体
将噬菌体和宿主菌在含有5 mmol/L CaCl2和MgCl2的LB液体培养基中培养过夜;加入终浓度为0.5 mol/L的NaCl及2%氯仿,混匀后静置4 ℃过夜。去除氯仿,4 ℃离心15 min,收集上清液,并加入固体PEG8000至终浓度为10%(W/V),充分溶解后静置4 ℃过夜。4 ℃离心15 min,去除上清液,收集沉淀并将沉淀重悬于适量的SM缓冲液(NaCl 5.8 g/L、MgSO4·7H2O 2 g/L、明胶0.1 g/L、Tris-HCl 50 mL),加入等量氯仿混匀,静置分层后离心15 min;去除氯仿层和PEG 8000层,取上清液,4 ℃ CsCl密度梯度离心4 h,吸取目的条带,4 ℃ SM缓冲液中透析3次,透析好的噬菌体液用于透射电子显微镜观察及DNA 抽提。
1.3噬菌体效价的测定
用双层琼脂平板法测定噬菌体效价——噬菌斑形成单位(plaque forming unit,pfu)。将扩增所得的噬菌体液进行连续10倍稀释至103~105密度范围。取400 μL培养至对数生长期的宿主菌和10 μL噬菌体稀释液混合于试管中,室温吸附10 min后,双层琼脂平板法计算pfu,重复3次。噬菌体效价(pfu/mL)=平均噬菌斑数×稀释倍数×100。
1.4噬菌体宿主谱分析
用双层琼脂平板法确定噬菌体的宿主谱。通过噬菌斑的产生判断噬菌体对细菌的裂解情况。根据抑菌圈的透明度确定噬菌体对宿主菌的作用强弱。
1.5噬菌体生物学特性
1.5.1酸碱稳定性实验将噬菌体液用SM缓冲液稀释后,按感染复数(multiplicity of infection,MOI)为0.01的比例混合噬菌体和宿主菌,分别在pH为1、2、3、4、5、6、7、7.45、8、9、10、11、12的TM缓冲液中37 ℃水浴1 h,用双层琼脂平板法确定噬菌体效价,重复3次。
1.5.2热稳定性实验将噬菌体液用SM缓冲液稀释后,按MOI=0.01的比例混合噬菌体和宿主菌,分别于4、37、50、60和 70 ℃水浴中作用1 h,用双层琼脂平板法确定噬菌体效价,重复3次。
1.5.3吸附实验培养宿主菌至对数期,室温按MOI=0.000 1的比例混合噬菌体液和菌液。于混合后0、1、2、3、4、5、6、10、20、30、40、50、60 min各取100 μL加至0.9 mL液体LB培养基中,立即16 000g离心30 s,取50 μL上清液与400 μL宿主菌混合,用双层琼脂平板法确定效价,计算吸附至宿主菌的噬菌体,重复3次。
1.5.4感染曲线实验培养宿主菌至对数期,按MOI=0、0.1、1 加入噬菌体液,每隔30 min取样测定600 nm处的光密度(optical density,OD),计算宿主菌生长情况,重复3次。
1.5.5一步生长曲线测定培养宿主菌至对数期,按MOI=0.000 1的比例加入噬菌体液,37 ℃孵育10 min,13 000g离心15 min,弃上清液,沉淀重悬于液体LB培养基。重悬后每10 min取样,用双层琼脂平板法确定效价,重复3次。
1.6噬菌体电子显微镜观察
将上述经CsCl不连续密度梯度离心纯化透析后的噬菌体经2%戊二醛固定,磷钨酸负染,透射电子显微镜下观察其形态结构。
1.7噬菌体DNA的提取和测序
将上述经CsCl不连续密度梯度离心纯化透析后的噬菌体用λ噬菌体基因组DNA快速提取试剂盒(北京艾德莱生物科技有限公司)抽提DNA,由上海人类基因组研究中心测序。应用 RAST、 GLIMMER和GeneMarks来预测噬菌体基因组开放阅读框架(open reading frame,ORF),并进一步与美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库进行相似性序列比较。
2结果
2.1噬菌体分离及其形态
从污水样本中分离得到1株肺炎克雷伯菌烈性噬菌体,命名为KP002。用双层琼脂平板法纯化3次后,噬菌斑形态和大小保持均匀一致,斑呈圆形、透明,边缘清晰,直径为3~4 mm。经纯化后,测定效价为4.05×1010pfu/mL。在电子显微镜下观察,噬菌体KP002由一个多面体对称的头部和尾部组成,属于有尾噬菌体。头部直径约为70 nm,尾长约80 nm,尾宽约20 nm(图1)。
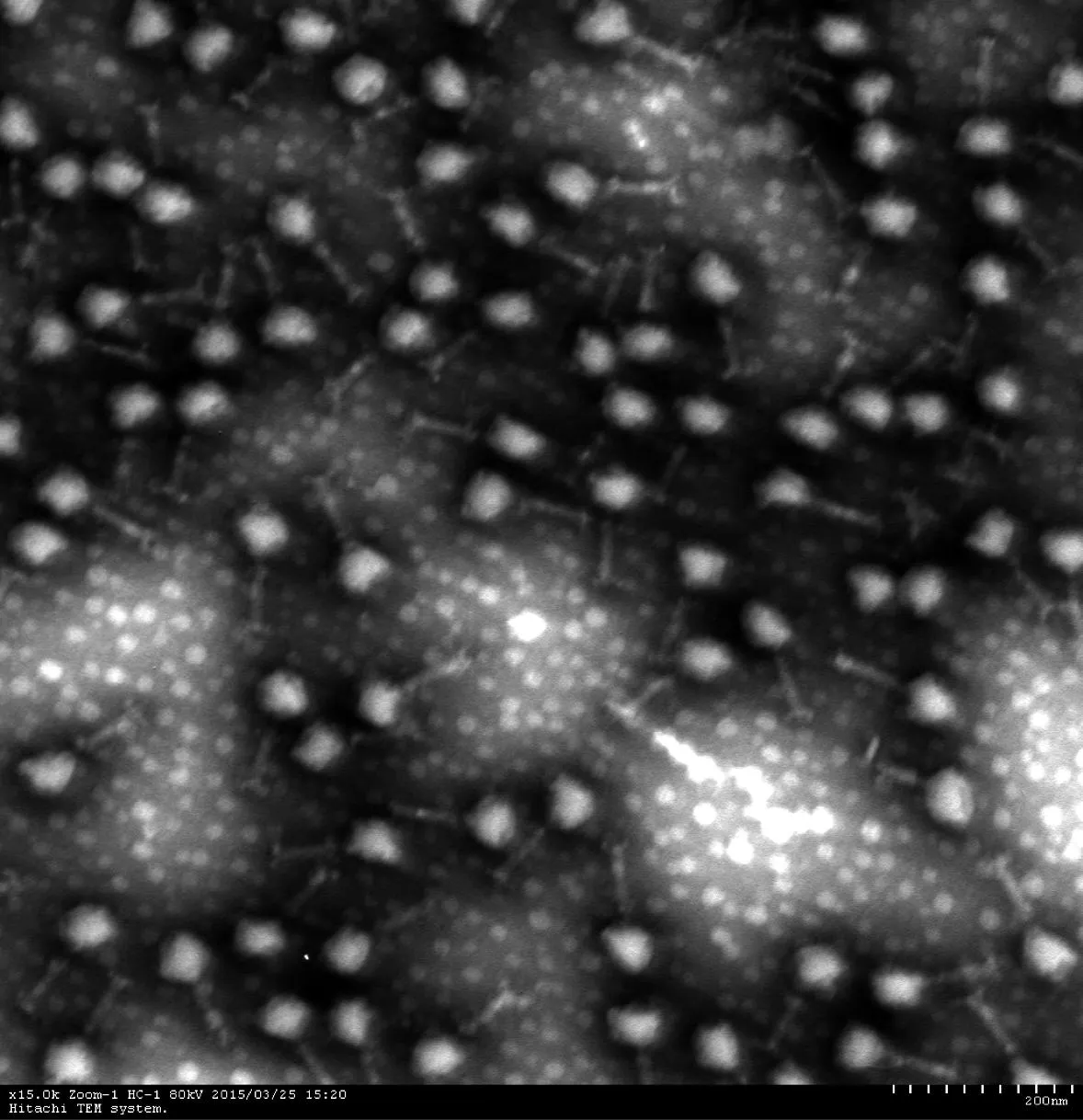
图1KP002的透射电子显微镜图像
Fig.1Transmission electron micrograph of KP002
2.2宿主谱分析
采用双层平板法和点滴法,发现在测试的80株耐药肺炎克雷伯菌中,KP002对其中10株裂解,裂解率为12.5%,但裂解效果较强。
2.3噬菌体KP002的酸碱稳定性及热稳定性
2.3.1酸碱稳定性KP002酸碱稳定性研究显示,KP002在pH 3~9缓冲液中作用1 h后,仍能保持较高的活性。在pH<2时,噬菌体效价接近于0。在pH>10时,随着pH值增大,噬菌体活性亦显著降低。结果表明KP002对酸碱比较稳定(图2)。
2.3.2热稳定性噬菌体KP002在4、37、40、50 ℃水浴中作用1 h后,均能保持较高效价。当温度高于60 ℃时,效价开始下降;升高至70 ℃时,效价接近于0(图3)。
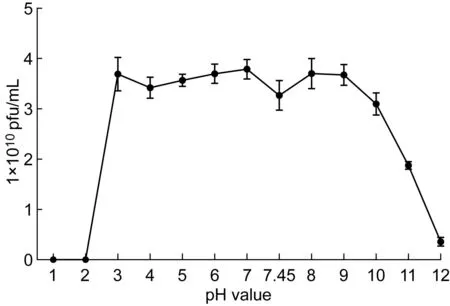
图2KP002的酸碱稳定性曲线
Fig.2pH stability curve of KP002
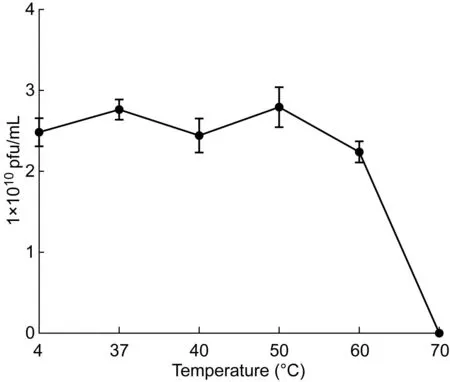
图3KP002的热稳定性曲线
Fig.3Thermal stability curve of KP002
2.4噬菌体感染宿主菌的能力
2.4.1吸附曲线KP002在室温下与宿主菌孵育6 min后,有95.22%噬菌体吸附至宿主菌,10 min时吸附率达97.66%(图4)。
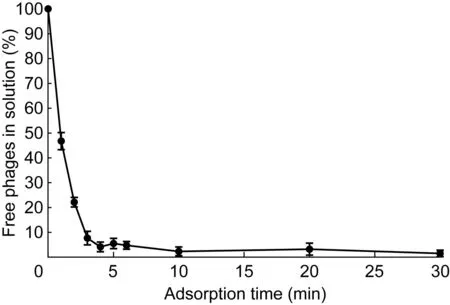
图4KP002的吸附曲线
Fig.4Adsorption curve of KP002
2.4.2一步生长曲线由一步生长曲线可知(图5),KP002的潜伏期约为10 min,裂解期为50 min,之后进入稳定期。KP002的溶菌周期为10~60 min。根据裂解量的计算公式:裂解量=裂解末期噬菌体效价/感染初期噬菌体效价,噬菌体感染宿主菌的裂解量约为172 pfu/cell,即平均每个宿主菌被KP002裂解能产生约172个子代噬菌体。

图5KP002的一步生长曲线
Fig.5One-step growth curve of KP002
2.4.3感染曲线由感染曲线可知(图6),当MOI=0.1和1时,KP002对宿主菌的生长有抑制作用。作用150 min后,可完全抑制宿主菌生长。
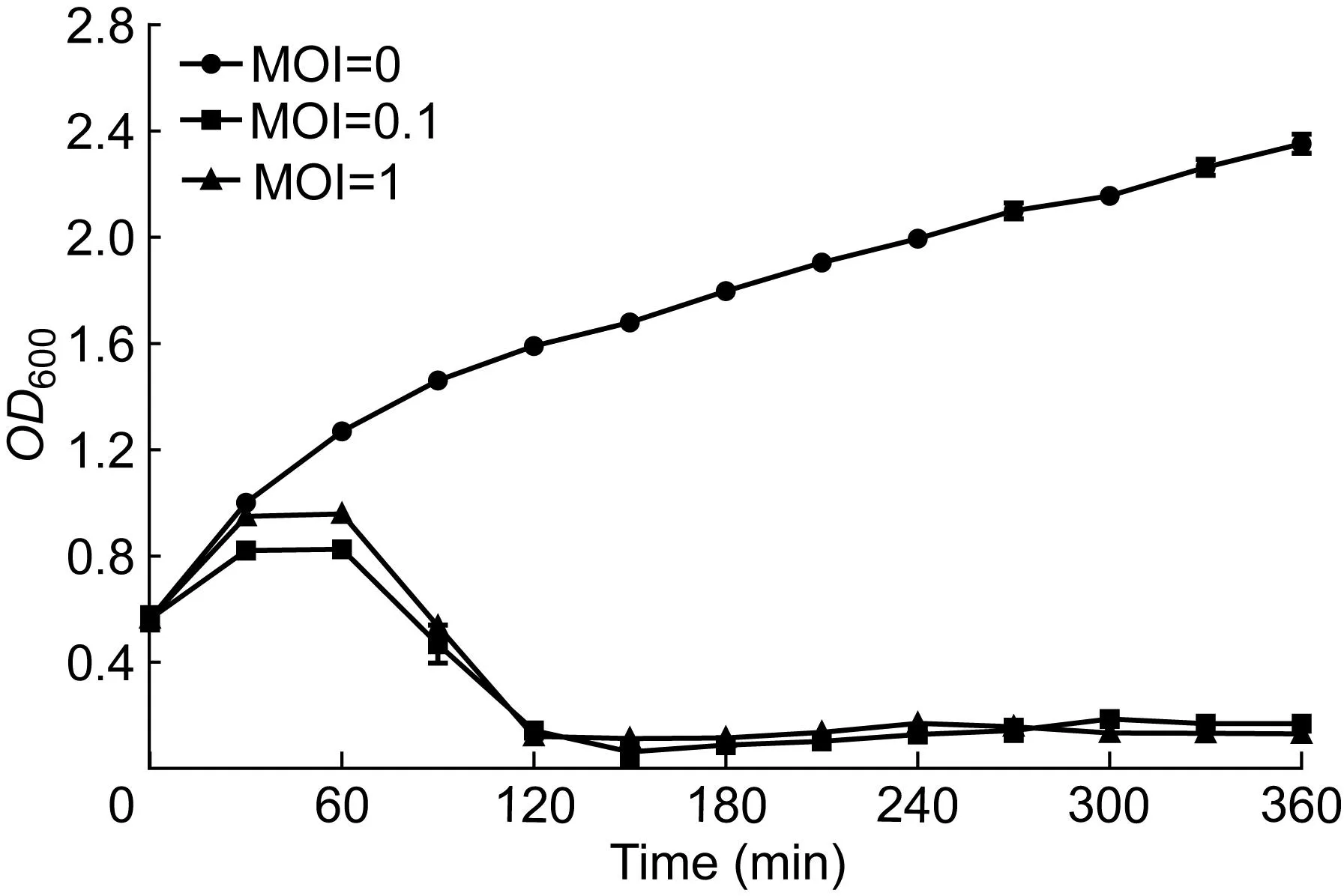
图6KP002的感染曲线
Fig.6Infection curve of KP002
2.5噬菌体基因组的结构特点及基因功能预测
噬菌体KP002的基因组为环状双链DNA,全长47 173 bp, GC含量为48%。其基因组分析表明,预测编码75个ORF,其中39个ORF编码的蛋白为假定蛋白,未发现tRNA序列。以KP002的全基因组序列通过BlastN与GenBank进行比对,结果表明KP002基因组与JD001有67%的序列相似(一致性≥93%)。其中>500 bp的相似片段见图7,但与已报道的肺炎克雷伯菌噬菌体KP15、KP32、KP34和phiKO2的基因组序列差异较大[4]。
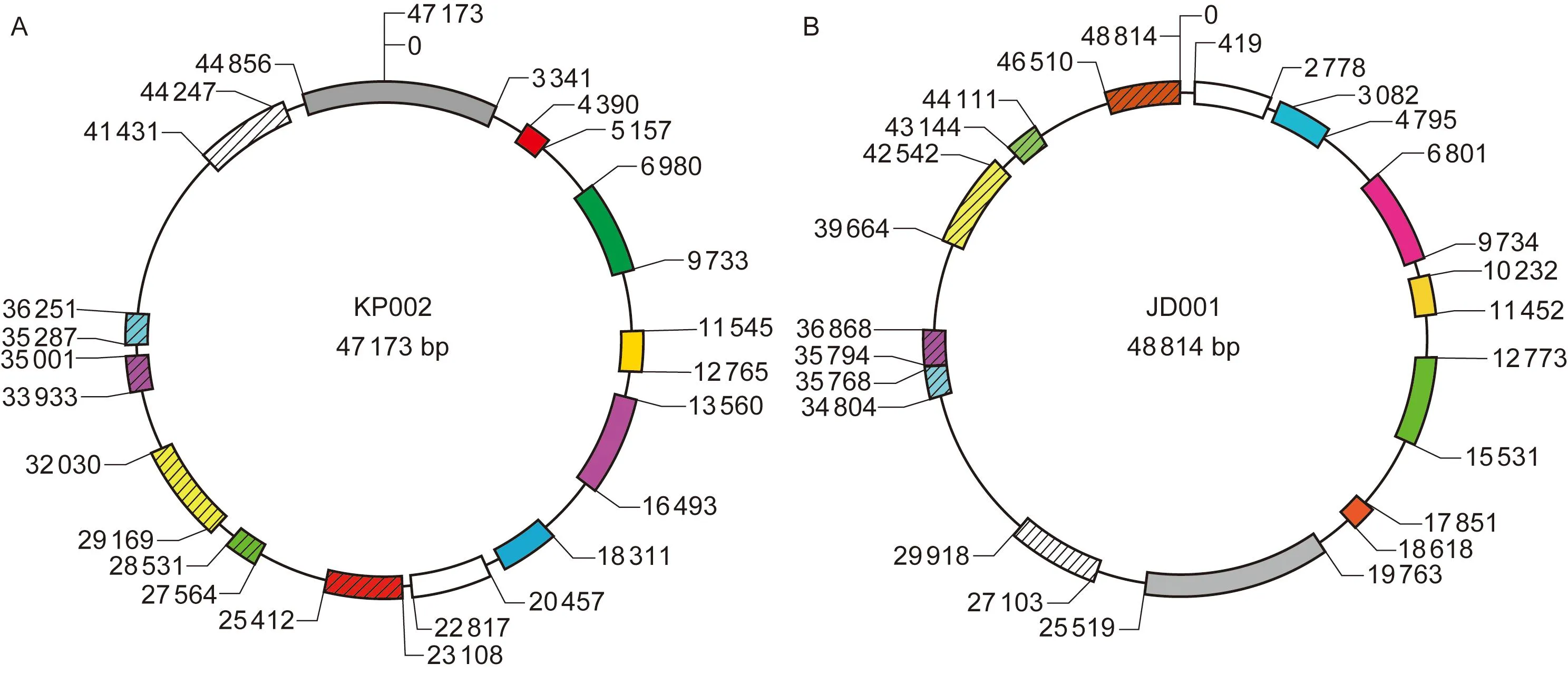
A:The diagram of circular genome of KP002. B: The diagram of circular genome of JD001. Numbers inside the rings show the size of phage genome and the numbers on the rings indicate the sequence position. Similar sequences (≥93%) of two genomes are shadowed with the same colour.
图7KP002与JD001环状基因组比较示意图
Fig.7Comparison of circular genomes of KP002 and JD001
比对分析KP002与JD001的基因组编码信息发现,KP002编码的75个ORF中,46个ORF与JD001 ORF相似,其中29个为KP002特有编码基因。KP002基因组共编码2个溶菌酶基因,均与JD001的2个编码基因相似。在29个特异编码基因中,24个为未知功能基因,4个已知功能的基因分别编码噬菌体相关的核酸内切酶(HNH endonuclease family protein)、DNA结合蛋白、DNA聚合酶、DNA解螺旋酶。
3讨论
肺炎克雷伯菌是重要的条件致病菌和医源性感染菌。其主要耐药机制是产ESBL,近年来产碳青霉烯酶的菌株也不断增多[5]。对肺炎克雷伯菌引起的威胁生命的感染,碳青霉烯类抗生素是最后的治疗手段。但根据世界卫生组织发布的首份全球抗生素耐药监测报告,肺炎克雷伯菌对第3代头孢菌素和碳青霉烯类抗生素的耐药性已传播到全世界[6]。在某些国家,碳青霉烯类抗生素对50%以上肺炎克雷伯菌感染患者无效。近年来,抗生素滥用导致细菌耐药性剧增,肺炎克雷伯菌日益严重的耐药问题给临床治疗带来了困难[7]。
针对耐碳青霉烯类抗生素肺炎克雷伯菌感染的治疗,有学者提出抗生素联合疗法。联合治疗在提高疗效方面效果显著,但由于药物协同作用,其缺点如不良反应增加也非常明显。目前,大多数针对耐药肺炎克雷伯菌的联合疗法没有循证医学支持[8]。因此,在抗生素治疗失败的情况下寻找替代疗法迫在眉睫,而噬菌体疗法的可操作性也得到了广泛认可。与抗生素相比,噬菌体能对感染细菌产生特异性杀伤作用而不影响正常菌群组成[9]。噬菌体及其混合物能阻止耐药细菌生物膜的形成,有助于生物膜清除而达到抗菌目的,同时噬菌体鸡尾酒疗法可防止噬菌体耐药性的发展[10]。虽然我国尚未开展噬菌体治疗方面的临床试验,但早在20世纪西方国家陆续开展了一些临床试验研究[11]。孟加拉国和瑞士的合作研究发现,口服大肠埃希菌噬菌体的志愿者未发现有肝脏、肾脏和血液毒性,也未对肠道正常菌群有影响[12]。英国已开展用铜绿假单胞菌噬菌体制剂来治疗耐药铜绿假单胞菌感染所致慢性中耳炎的临床Ⅰ期和Ⅱ期研究。在比利时布鲁塞尔,研究人员将铜绿假单胞菌和金黄色葡萄球菌的鸡尾酒制剂用于烧伤患者的临床试验,并成功治愈了烧伤感染[13]。澳大利亚研究者与格鲁吉亚研究者合作,成功应用噬菌体制剂控制了抗生素治疗失败的尿路细菌感染[14]。这些研究结果均表明,噬菌体具有潜在的应用价值。
本研究以80株肺炎克雷伯菌临床耐药株为宿主菌,从污水样本中分离获得1株针对耐药肺炎克雷伯菌的烈性噬菌体,命名为KP002,其属于有尾噬菌体。对其生物学特性进行研究及分析后发现,KP002具有较高的酸碱稳定性,pH适应范围较宽,在中性环境下稳定性高,对碱性环境的耐受性强于对酸性环境的耐受性;其对温度的耐受性也较高。噬菌体如果用于临床治疗,要求其不仅能在体内温度和pH条件下保持高活性,还要在制成医疗制品时不易失活[15]。KP002对温度及酸碱性均具有较好的稳定性,具有成为噬菌体储备库的潜能。
KP002针对宿主菌的吸附速度快,6 min 95%以上噬菌体吸附至细菌表面,这一特性使其能更快、更多地裂解细菌。KP002裂解期短,可见其感染宿主菌的周期短,因此裂解速度快。KP002的裂解量约为172 pfu/cell,平均每个宿主菌被裂解能产生约172个子代噬菌体,体现了其裂解能力较强的特点。这些生物学特性使KP002应用于医疗制品成为可能。
KP002 基因组与已报道的噬菌体KP15、KP32、KP34和phiKO2基因组基本不具有相似性,与JD001的相似性为67%,且编码相同的2个噬菌体裂解酶或溶菌酶,表明可能具有相同的起源;但该溶菌酶与已报道的其他噬菌体裂解酶相似性低,亲缘性小,具有较大的研究价值[16]。与JD001不同的是,KP002编码一些特异的噬菌体相关核酸内切酶、DNA结合蛋白、DNA聚合酶及DNA解螺旋酶,可能与KP002和JD001对宿主的不同适应特征有关。对这些特定结构域的基因功能进行研究,可为噬菌体用于临床治疗多重耐药菌感染提供新的研究思路[17],也为今后的流行病学、噬菌体基因组学、噬菌体工程改造和噬菌体治疗等研究提供基本数据和一定帮助[18]。
参考文献
[1]Tzouvelekis LS, Markogiannakis A, Piperaki E, Souli M, Daikos GL. Treating infections caused by carbapenemase-producing Enterobacteriaceae [J]. Clin Microbiol Infect, 2014, 20(9): 862-872.
[2]Tängdén T, Giske CG. Global dissemination of extensively drug-resistant carbapenemase-producing Enterobacteriaceae: clinical perspectives on detection, treatment and infection control [J]. J Intern Med, 2015, 277(5): 501-512.
[3]Hung CH, Kuo CF, Wang CH, Wu CM, Tsao N. Experimental phage therapy in treating Klebsiella pneumoniae-mediated liver abscesses and bacteremia in mice [J]. Antimicrob Agents Chemother, 2011, 55(4): 1358-1365.
[4]Drulis-Kawa Z, Mackiewicz P, Kesik-Szeloch A, Maciaszczyk-Dziubinska E, Weber-Dabrowska B, Dorotkiewicz-Jach A, Augustyniak D, Majkowska-Skrobek G, Bocer T, Empel J, Kropinski AM. Isolation and characterisation of KP34——a novel φKMV-like bacteriophage for Klebsiella pneumoniae [J]. Appl Microbiol Biotechnol, 2011, 90(4): 1333-1345.
[5]Hirsch EB, Tam VH. Detection and treatment options for Klebsiella pneumoniae carbapenemases (KPCs): an emerging cause of multidrug-resistant infection [J]. J Antimicrob Chemother, 2010, 65(6): 1119-1125.
[6]Kumarasamy KK, Toleman MA, Walsh TR, Bagaria J, Butt F, Balakrishnan R, Chaudhary U, Doumith M, Giske CG, Irfan S, Krishnan P, Kumar AV, Maharjan S, Mushtaq S, Noorie T, Paterson DL, Pearson A, Perry C, Pike R, Rao B, Ray U, Sarma JB, Sharma M, Sheridan E, Thirunarayan MA, Turton J, Upadhyay S, Warner M, Welfare W, Livermore DM, Woodford N. Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study [J]. Lancet Infect Dis, 2010, 10(9): 597-602.
[7]管婧,卓超,苏丹虹,倪语星,孙景勇,汪复,朱德妹,胡付品,徐英春,张小江,俞云松,杨青,陈中举,孙自镛,张朝霞,季萍,单斌,杜艳,张泓,孔菁,徐元宏,沈继录,王传清,王爱敏,胡志东,李全,魏莲花,吴玲,胡云建,艾效曼.2012年中国CHINET克雷伯菌属细菌耐药性监测 [J].中国感染与化疗杂志,2014,14(5):398-404.
[8]Paul M, Carmeli Y, Durante-Mangoni E, Mouton JW, Tacconelli E, Theuretzbacher U, Mussini C, Leibovici L. Combination therapy for carbapenem-resistant Gram-negative bacteria [J]. J Antimicrob Chemother, 2014, 69(9): 2305-2309.
[9]Verma V, Harjai K, Chhibber S. Structural changes induced by a lytic bacteriophage make ciprofloxacin effective against older biofilm of Klebsiella pneumoniae [J]. Biofouling, 2010, 26(6): 729-737.
[10]Parasion S, Kwiatek M, Gryko R, Mizak L, Malm A. Bacteriophages as an alternative strategy for fighting biofilm development [J]. Pol J Microbiol, 2014, 63(2): 137-145.
[11]Abedon ST, Kuhl SJ, Blasdel BG, Kutter EM. Phage treatment of human infections [J]. Bacteriophage, 2011, 1(2): 66-85.
[12]Majewska J, Beta W, Lecion D, Hodyra-Stefaniak K, Kopot A, Kazmierczak Z, Miernikiewicz P, Piotrowicz A, Ciekot J, Owczarek B, Kopciuch A, Wojtyna K, Harhala M, Makosa M, Dabrowska K. Oral application of T4 phage induces weak antibody production in the gut and in the blood [J]. Viruses, 2015, 7(8): 4783-4799.
[13]Hawkins C, Harper D, Burch D, Anggård E, Soothill J. Topical treatment of Pseudomonas aeruginosa otitis of dogs with a bacteriophage mixture: a before/after clinical trial [J]. Vet Microbiol, 2010, 146(3/4): 309-313.
[14]Khawaldeh A, Morales S, Dillon B, Alavidze Z, Ginn AN, Thomas L, Chapman SJ, Dublanchet A, Smithyman A, Iredell JR. Bacteriophage therapy for refractory Pseudomonas aeruginosa urinary tract infection [J]. J Med Microbiol, 2011, 60(Pt 11): 1697-1700.
[15]Kumari S, Harjai K, Chhibber S. Efficacy of bacteriophage treatment in murine burn wound infection induced by Klebsiella pneumoniae [J]. J Microbiol Biotechnol, 2009, 19(6): 622-628.
[16]Kesik-Szeloch A, Drulis-Kawa Z, Weber-Dabrowska B, Kassner J, Majkowska-Skrobek G, Augustyniak D, Lusiak-Szelachowska M, Zaczek M, Górski A, Kropinski AM. Characterising the biology of novel lytic bacteriophages infecting multidrug resistant Klebsiella pneumoniae [J]. Virol J, 2013, 10: 100.
[17]Verma V, Harjai K, Chhibber S. Characterization of a T7-like lytic bacteriophage of Klebsiella pneumoniae B5055: a potential therapeutic agent [J]. Curr Microbiol, 2009, 59(3): 274-281.
[18]Cui Z, Shen W, Wang Z, Zhang H, Me R, Wang Y, Zeng L, Zhu Y, Qin J, He P, Guo X. Complete genome sequence of Klebsiella pneumoniae phage JD001 [J]. J Virol, 2012, 86(24): 13843.
Corresponding author. QIN Jinhong, E-mail: jinhongqin@sjtu.edu.cn
·论著·
Biological characterization and genome sequence of KP002, a novel bacteriophage isolated from multiple-drug resistantKlebsiellapneumonia
GAO Jing1,2, XU Bin3, GUO Xiaokui1, QIN Jinhong1
1. Shanghai Jiao Tong University School of Medicine, Shanghai 200025, China; 2. Obstetrics and Gynecology Hospital of Fudan University, Shanghai 200011, China; 3. Xinhua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine Chongming Branch, Shanghai 202150, China
Abstract:Multiple drug-resistantKlebsiellapneumoniastrains collected from several hospitals in Shanghai were used as the host bacteria to isolate phages in the wastewater. A novel phage KP002 was isolated and analyzed in details. The morphology and size of the bacteriophage was observed by electron microscope with negative staining. The results indicated that it was a tailed phage with head diameter about 70 nm, tail length about 80 nm and tail width about 20 nm. This phage had high activity at pH from 3 to 9 and temperature from 4 to 50 ℃. The adsorption rate was above 95% within 6 min. Its incubation period was 10 min and burst period was 50 min. The burst size reached 172 pfu/cell. The whole genome sequence showed that it contained a circular double-stranded DNA with a full-length of 47 173 bp and GC content of 48%. KP002 is a new phage against drug-resistant bacteria and could be served as a potential resource for clinical treatment of multiple-drug resistant bacterial infection.
Key words:Multiple drug-resistantKlebsiellapneumonia; Bacteriophage; Genomics
收稿日期:(2015-08-18)
通信作者:秦金红
基金项目:国家科技支撑计划(2012EP001004)
