B族链球菌不同菌株对血小板的活化作用*
2016-03-05刘晓燕刘红云高延民谢双锋罗先明常建星马丽萍
刘晓燕, 刘红云, 高延民, 谢双锋, 罗先明, 常建星, 徐 康, 马丽萍△
(中山大学孙逸仙纪念医院1血液内科,2普外科,广东 广州 510120)
B族链球菌不同菌株对血小板的活化作用*
刘晓燕1,刘红云1,高延民1,谢双锋1,罗先明1,常建星2,徐康2,马丽萍1△
(中山大学孙逸仙纪念医院1血液内科,2普外科,广东 广州 510120)
[摘要]目的: 探索B族链球菌(GBS)不同菌株对血小板活化的作用及可能的机制。方法: 来自脓毒症伴血小板减少患者分离鉴定的6株GBS作为诱导剂,分别采用血小板聚集仪、流式细胞术、扫描电镜和Western blotting方法检测它们对血小板聚集率以及血小板膜蛋白CD62P、TLR2和TLR4表达的影响;进一步用TLR2和TLR4单克隆抗体封闭血小板表面TLR2和TLR4以检测它们与GBS诱导的血小板活化的关系。结果: 6株GBS中有3株可诱导血小板聚集,且能明显上调血小板TLR2和CD62P的表达(P<0.05),但对血小板TLR4的表达没有影响;封闭血小板TLR2后,GBS诱导的血小板聚集率明显下降。结论: 部分GBS菌株可诱导血小板活化,血小板TLR2可能在这个过程中起重要作用。
[关键词]B族链球菌; 血小板活化; 脓毒症; Toll样受体
临床上,严重感染患者常合并血小板减少,重者发生弥散性血管内凝血(disseminated intravascular coagulation,DIC)[1-3],血小板在其中发挥重要作用。血小板-细菌、血小板-粒细胞及血小板-内皮细胞间的相互作用,直接或间接地参与炎症反应和上述过程[4],目前有学者提出血小板也是一种免疫细胞[5-6]。Toll样受体(Toll-like receptors,TLRs)是介导机体抗感染免疫的主要蛋白,也表达在血小板上,成为血小板参与炎症反应和监测感染的证据之一[7-9]。已有研究显示细菌可以诱导血小板活化,但由于细菌菌株的不同,活化血小板的机制也不尽相同,血小板TLRs是否参与少见报道。本研究选择从脓毒症伴血小板减少患者中分离出的6株B族链球菌(Group B streptococcus,GBS)进行实验,探索GBS和血小板作用的可能机制。
材料和方法
1主要仪器与试剂
血平板培养基及BHI培养基分别购自广州环凯及广州齐云公司;血小板诱导剂二磷酸腺苷(adenosine diphosphate,ADP)购自Chrono-log;封闭性单克隆抗体TLR2(clone TL2.1)和TLR4(HTA125)分别购自Invitrogen和Novus;多克隆抗体兔抗人TLR2、兔抗鼠TLR4和兔抗人β-actin购自Abcam;用于流式细胞术实验的相关抗体如CD62P-PE、CD61-PerCP以及同型对照抗体购自Becton Deckinson;牛血清蛋白购自申能博彩公司;所有的RT-PCR相关试剂购自TaKaRa。
2主要方法
2.1GBS标本来源及其培养6株GBS菌株来源于中山大学孙逸仙纪念医院检验科的临床标本(患者均为脓毒症且伴有血小板减少),经分离和鉴定后的编号为255、639、945、81875、90604和93555。用划线培养法将GBS冻干粉接种至固体血平板培养基,37 ℃温箱中培养18~24 h后,取菌革兰氏染色,镜检观察菌体形态确定无杂菌生长后接种到BHI液体培养基,置于摇床中培养18~24 h后收获细菌。收获的细菌液在4 ℃、1 500 r/min离心15 min,弃上清,菌体用PBS洗涤2次。
2.2富血小板血浆和血小板悬液的制备健康献血员(25~52岁),性别不限,无长期使用避孕药及吸烟史。抽血30 d内未服用抗血小板药物。3.8%枸橼酸钠抗凝管抽取全血后1 000 r/min离心10 min,获取上层富血小板血浆(platelet-rich plasma,PRP),剩余血3 000 r/min离心10 min后获取乏血小板血浆(platelet-poor plasma,PPP)。
2.3血小板聚集率的测定用北京普利生LBY-NJ4 聚集仪行比浊法分别检测不同诱导剂(6种菌液、ADP和生理盐水)诱导的血小板聚集率,ADP和生理盐水分别为阳性和阴性对照,观察时间为20 min。在抗体阻断实验中,将PRP 300 μL预先与抗TLR2(10 mg/L)或抗TLR4(10 mg/L)抗体在37 ℃下孵育30 min,后加入上述菌液各10 μL,检测血小板聚集率。
2.4血小板膜表面蛋白的测定流式细胞术检测血小板膜表面蛋白CD62P的表达。分别取6种菌液和生理盐水各50 μL,与PRP 200 μL混合,37 ℃静置30 min。取10 μL处理后的PRP,分别加入单克隆抗体PE-CD62P、PerCP-CD61以及同型对照10 μL,避光孵育20 min后,FACS Calibur型流式细胞仪检测血小板CD62P的阳性百分比,每组实验重复3次。
2.5扫描电镜实验用GBS 639包被培养皿,加入血小板悬液后分别孵育10 min、20 min和30 min。PBS洗涤1次去除未黏附的血小板,乙醇浓度梯度(30%、50%、70%、90%、100%)脱水,丙酮置换后电镀膜,扫描电镜下观察血小板与GBS的相互作用。
2.6Western blotting法检测血小板总TLR2/TLR4蛋白的水平将获得的血小板沉淀按照100∶10∶1的比例加入RIPA、磷酸酶抑制剂和PMSF后,冰上裂解30 min,4 ℃下12 000 r/min离心30 min获得上层清亮蛋白质溶液。按照碧云天BCA蛋白浓度测定试剂盒说明书测各组蛋白浓度。然后进行蛋白质SDS-PAGE,最后ECL发光鉴定。
3统计学处理
实验数据采用SPSS 13.0软件进行统计学处理。所有数据行正态检验和方差齐性检验。符合正态分布及方差齐性的数据以均数±标准差(mean±SD)表示;组间比较采用单因素方差分析,重复测量数据的多重比较采用Bonferroni法校正检验水准。以P<0.05为差异有统计学意义。
结果
1GBS体外诱导血小板聚集
ADP诱导的血小板聚集率为(61.43±2.94)%;与阴性对照组(生理盐水)比较,6株GBS中,只有639、81875及90604菌株能诱导血小板聚集(P<0.05),分别是(57.08±3.89)%、(42.13±3.78)%及(45.88±3.08)%。639菌株诱导血小板聚集的能力与ADP相当,较81875及90604菌株强(P<0.01),后两者之间对血小板聚集能力相当,见图1A。
与阳性对照组ADP诱导的血小板聚集触发时间为0 s相比,不同GBS菌株诱导血小板聚集的触发时间则比较滞后,其中639菌株为(147.00±13.66) s,81875菌株为(199.10±10.30) s,90604菌株为(88.70±9.60) s。255、945和93555菌株在本实验观察时间内(20 min,图1B中只标注到10 min)未检测到血小板聚集。每株GBS诱导不同献血者血小板聚集的触发时间及聚集率之间的差异没有统计学意义(P>0.05),见图1B。
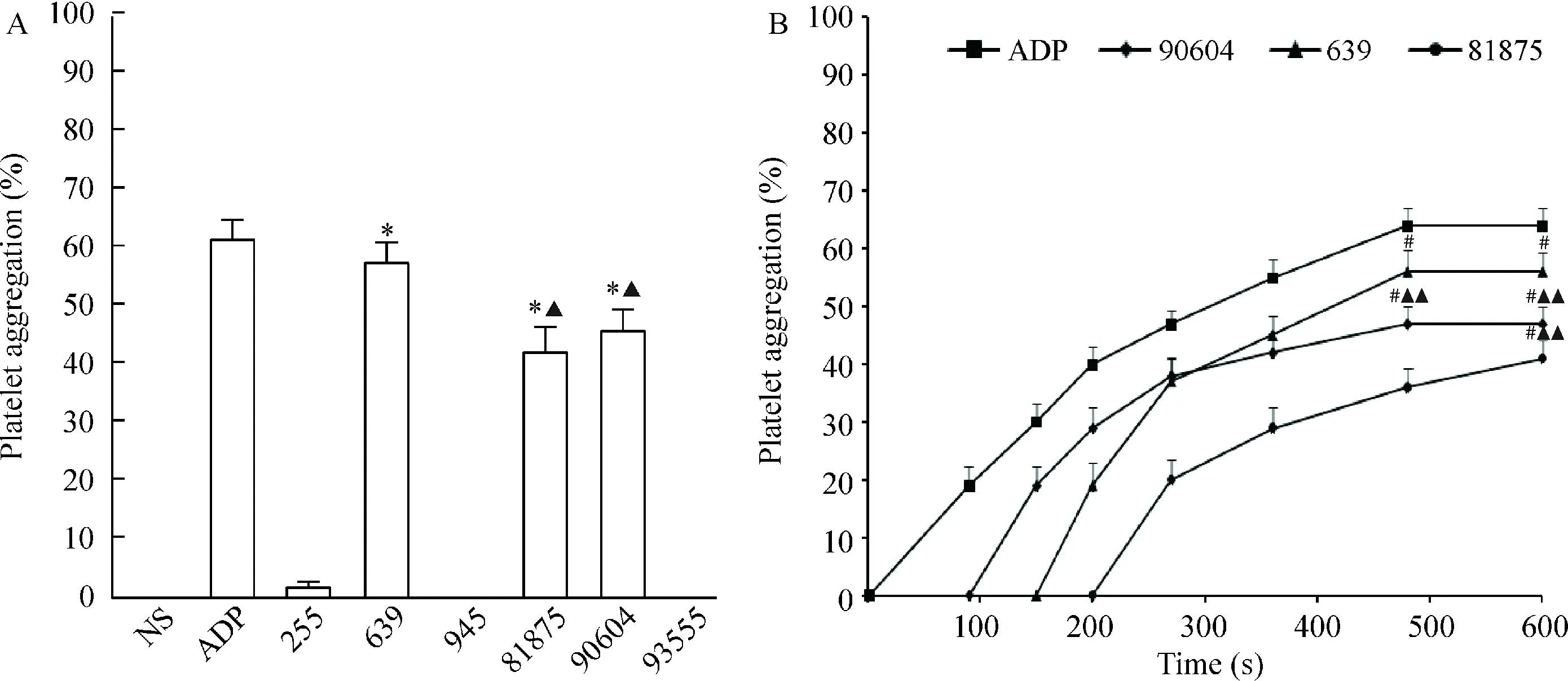
Figure 1.Platelet aggregation in response to GBS. A: the effect of 6 GBS strains on platelet aggregation; B: the lag time of different strains. Mean±SD.n=6.*P<0.05vsNS;▲▲P<0.01vs639;#P<0.05vsADP.
图1GBS诱导的血小板聚集
2GBS上调血小板CD62P的表达
阴性对照生理盐水(NS)组血小板CD62P阳性百分比为(4.62±0.28)%。6株GBS中,只有639、81875及90604菌株能明显上调血小板CD62P表达(P<0.05),CD62P阳性百分比为分别是(46.98±7.63)%、(15.78±5.76)%和(11.68±2.53)%。639菌株上调血小板CD62P的能力高于81875及90604菌株(P<0.01),后两者之间无显著差异,见图 2。

Figure 2.Three GBS strains up-regulated the expression of platelet CD62P. Mean±SD.n=12.*P<0.05vsNS;▲▲P<0.01vsGBS 639.
图26株菌和NS诱导的血小板CD62P的表达
3扫描电镜观察血小板与GBS相互作用
通过扫描电镜观察到GBS和血小板相互作用后血小板形态的变化(变形、伸出伪足)、聚集以及与GBS的黏附,最终形成血小板凝块,见图3。

Figure 3.The interaction of platelets with GBS 639. A: the stationary platelets; B: the platelets were activated by the bacteria and stretched out the parapodium (10 min); C, D: the platelet aggregation.
图3血小板与GBS的相互作用
4GBS对血小板TLR2/TLR4的影响
以β-actin为内参照,Western blotting检测GBS刺激血小板后TLR2和TLR4蛋白的表达水平。NS组血小板TLR2 蛋白的表达是0.347±0.048,639、81875及90604菌株刺激血小板后,血小板TLR2 蛋白的表达明显升高(P<0.05),分别是0.906±0.048、0.853±0.027及0.913±0.017,各组间无明显差异。但是GBS菌株刺激血小板后,TLR4 蛋白的表达未见明显变化,见图4。
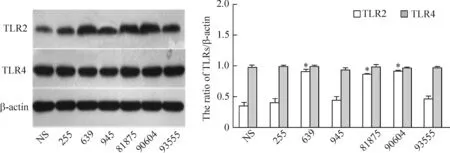
Figure 4.The expression of TLR2 and TLR4 in the platelets interacted with bacteria detected by Western blotting. Mean±SD.n=3.*P<0.05vsNS.
图4GBS菌株对血小板TLR2/4表达的影响
5抗TLR2/TLR4抗体封闭血小板TLR2/TLR4后的血小板聚集率
为了证明血小板TLRs参与GBS诱导的血小板活化,将抗TLR2抗体或抗TLR4抗体预先与血小板悬液孵育后再检测GBS对血小板聚集率的作用。未封闭前,639、81875及90604菌株诱导的血小板聚集率分别是(57.08±3.89)%、(42.13±3.78)%及(45.88±3.08)%;抗TLR2抗体封闭后,3株GBS诱导的血小板聚集率分别是(5.70±1.73)%、(2.40±0.96)%及(2.80±1.78)%,均较封闭前明显下降(P<0.05);抗TLR4抗体封闭TLR4活性后,3株GBS诱导的血小板聚集率分别是(54.84±5.70)%、(45.54±2.90)%及(43.38±4.20)%,较封闭前无明显变化,见图5。

Figure 5.GBS-induced platelet aggregation in a TLR2-dependent manner. Mean±SD.n=6.*P<0.05vscontrol.
图5抗TLR2/TLR4抗体封闭前后,GBS诱导的血小板聚集率
讨论
尽管炎症介质、白细胞及细菌在感染相关性血小板减少中的研究有一些进展,但细菌与血小板相互作用的具体机制并未阐明[10]。早在1987年,Usui等[11]就报道部分GBS菌株在体外可以诱导血小板聚集,但没有对细菌是如何与血小板相互作用进行更深入的解释。透光率比浊法检测的血小板聚集率被认为是血小板活化功能检测的“金标准”,其原理是检测富血小板血浆在各种激动剂刺激下发生血小板聚集或形成血凝块后透光率的变化。CD62P(P-选择素)是血小板α颗粒内的膜糖蛋白,静止期血小板不表达或少量表达,当血小板活化时暴露于血小板膜表面,因此CD62P被认为是反映血小板活化状态的敏感指标[12]。血小板聚集功能和CD62P是目前检测血小板活化中应用最多、也相对稳定的指标[13]。因此本文选择这2项指标进行GBS诱导血小板活化的实验。
首先我们对来自临床脓毒症患者的GBS菌株进行筛查,发现仅有3株细菌能诱导血小板聚集,且不同菌株引起血小板聚集的时间有先后,所引起的最大聚集率也不同,说明GBS诱导的血小板聚集具有菌株特异性。同时检测的血小板CD62P的表达结果与血小板聚集率一致,呈促进作用,而且程度不同,在3株中以GBS 639上调血小板CD62P的能力最强,说明GBS具有诱导血小板活化的作用。然而,血小板本身是如何识别GBS菌株从而产生相应的功能改变,是本研究的重点。
血小板膜TLRs作为模式识别受体,通过识别病原体上的某些特殊配体,继而激活下游级联信号通路,在宿主抗感染防御免疫反应中发挥关键作用[14-15]。目前被发现表达于血小板的TLRs主要包括TLR1~4、TLR6、TLR7 和 TLR9[15]。TLR4是细菌脂多糖(lipopolysaccharide,LPS)的配体,LPS通过TLR4途径刺激血小板释放细胞因子TNF-α、PMPs及阳离子抗菌肽,参与血小板对微生物的监测及杀伤[16]。Andonegui等[17]曾报道血小板通过TLR4识别病原体介导血小板产生活化和释放反应可能是脓毒症发生血小板减少和炎症放大反应的机制。也有研究显示血小板TLR2同样能增加血小板表面P-选择素和整合蛋白IIb/IIIa的表达,同时还产生活性氧,促进血液中血小板-粒细胞的聚集[8]。GBS诱导血小板活化是否也有可能是该途径。在本研究中,我们检测了GBS刺激后血小板TLR2和TLR4的表达,结果发现血小板TLR2表达明显增高,但是血小板TLR4表达无明显变化。为了进一步明确血小板TLR2/TLR4表达的功能性,在GBS孵育血小板之前,应用抗TLR2/TLR4单克隆抗体预先封闭血小板表面TLR2/TLR4,与不加抗TLR2/TLR4单抗的富血小板血浆比较血小板聚集率的变化。结果显示封闭TLR2能明显降低GBS诱导的血小板聚集率,而封闭TLR4并不影响GBS诱导的血小板聚集率,提示GBS诱导的血小板聚集率是通过血小板TLR2介导的,而不是TLR4。也就是说GBS被血小板TLR2识别后诱导了血小板的活化过程。类似的研究见于人巨细胞病毒[18]。
关于细菌本身是哪些成分参与识别血小板TLR2或其它蛋白,之前在其它标准野生链球菌菌株中有报道,如格氏链球菌通过其表面GspB和Hsa蛋白结合血小板GPIb受体[19],血链球菌通过其表面SrpA蛋白参与血小板黏附[20]。而GBS菌株是否通过其表面蛋白以及通过哪种蛋白活化血小板的具体机制不详,需要进一步研究证实。
综上研究,部分GBS菌株可以诱导血小板活化,而血小板表面TLR2可能是血小板识别GBS的关键受体,是血小板参与抗感染免疫的有力证据。我们将对GBS和血小板TLR2结合的方式或结构域以及TLR2通路进行更深入的探究。
[参考文献]
[1]Thiolliere F, Serre-Sapin AF, Reignier J, et al. Epidemiology and outcome of thrombocytopenic patients in the intensive care unit: results of a prospective multicenter study[J]. Intensive Care Medicine, 2013, 39(8):1460-1468.
[2]孙建,吴伟东. 脓毒症相关性血小板减少症的危险因素及预后分析[J]. 中华危重症医学杂志:电子版, 2014, 7(3):177-181.
[3]Kitchens CS. Thrombocytopenia and thrombosis in disseminated intravascular coagulation (DIC)[J]. Hematology Am Soc Hematol Educ Program,2009,2009(1):240-246.
[4]马丽萍,罗先明. 血小板与细菌感染[J]. 血栓与止血学, 2012, 18(6):245-246.
[5]Garraud O, Cognasse F. Are platelets cells? And if yes, are they immune cells?[J]. Front Immunol, 2015, 6:70.
[6]Morrell CN, Aggrey AA, Chapman LM, et al. Emerging roles for platelets as immune and inflammatory cells[J]. Blood, 2014, 123(18):2759-2767.
[7]Shiraki R, Inoue N, Kawasaki S, et al. Expression of Toll-like receptors on human platelets[J]. Thromb Res, 2004, 113(6):379-385.
[8]Rex S, Beaulieu LM, Perlman DH, et al. Immune versus thrombotic stimulation of platelets differentially regulates signalling pathways, intracellular protein-protein interactions, and α-granule release[J]. Thromb Haemost, 2009, 102(1): 97-110.
[9]Koupenova M, Vitseva O, Mackay CR, et al. Platelet-TLR7 mediates host survival and platelet count during viral infection in the absence of platelet-dependent thrombosis[J]. Blood, 2014, 124(5):791-802.
[10]de Stoppelaar SF, van ’t Veer C, van der Poll T. The role of platelets in sepsis[J]. Thromb Haemost, 2014, 112(4):666-677.
[11]Usui Y, Ohshima Y, Yoshida K. Platelet aggregation by group B streptococci[J]. J Gen Microbiol, 1987, 133(6):1593-1600.
[12]黎庆梅,韦建瑞,洪介民,等. 流式细胞术检测血小板活化的影响因素分析[J]. 中国病理生理杂志, 2009, 25(3):510-512.
[13]张晓晖. 葡萄籽原花青素体外抗血小板聚集的机制研究[J]. 中国病理生理杂志, 2012, 28(4):714-717.
[14]Beaulieu LM, Freedman JE. The role of inflammation in regulating platelet production and function: Toll-like receptors in platelets and megakaryocytes[J]. Thromb Res, 2010, 125(3):205-209.
[15]Cognasse F. The inflammatory role of platelets via their TLRs and Siglec receptors[J]. Front Immunol, 2015, 6:83.
[16]Aslam R, Speck ER, Kim M, et al. Platelet Toll-like receptor expression modulates lipopolysaccharide-induced thrombocytopenia and tumor necrosis factor-alpha productioninvivo[J]. Blood, 2006, 107(2):637-641.
[17]Andonegui G. Platelets express functional toll-like receptor-4[J]. Blood, 2005, 106(7):2417-2423.
[18]Assinger A, Kral JB, Yaiw KC, et al. Human cytomegalovirus-platelet interaction triggers Toll-like receptor 2-dependent proinflammatory and proangiogenic responses[J]. Arterioscler Thromb Vasc Biol, 2014, 34(4):801-809.
[19]Bensing BA, Lopez JA, Sullam PM. TheStreptococcusgordoniisurface proteins GspB and Hsa mediate binding to sialylated carbohydrate epitopes on the platelet membrane glycoprotein Ibα[J]. Infect Immun, 2004, 72(11):6528-6537.
[20]Plummer C, Wu H, Kerrigan SW, et al. A serine-rich glycoprotein ofStreptococcussanguismediates adhesion to platelets via GPIb[J]. Br J Haematol, 2005, 129(1):101-109.
(责任编辑: 林白霜, 罗森)
Effects of different group B streptococci strains on platelet activationLIU Xiao-yan1, LIU Hong-yun1, GAO Yan-min1, XIE Shuang-feng1, LUO Xian-ming1, CHANG Jian-xing2, XU Kang2, MA Li-ping1
(1DepartmentofHematology,2DepartmentofGeneralSurgery,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China.E-mail:mlp215@aliyun.com)
[ABSTRACT]AIM: To explore the ability of different group B streptococci (GBS) strains on inducing platelet activation. METHODS: Six strains of GBS, separated from the septic patients with thrombocytopenia, were used as the inducers. Light transmission aggregometry was used to measure platelet aggregation. Scanning electron microscopy (SEM) was performed to investigate the interaction of platelets with bacteria. The expression of platelet CD62P, Toll-like receptor 2 (TLR2) and TLR4 was determined by flow cytometry and Western blotting. Furthermore, the activity of platelet TLR2 (or TLR4) was blocked by anti-TLR2 (or anti-TLR4) monoclonal antibody, and the platelet aggregation induced by GBS was detected. RESULTS: Only 3 of 6 GBS strains isolated from the septic patients induced platelet aggregation and up-regulated the expression of CD62P and TLR2 in the platelets (P<0.05), but not TLR4. Incubation with anti-TLR2 antibody, but not anti-TLR4 antibody, significantly blocked platelet aggregation induced by GBS.CONCLUSION: Some GBS strains from the patients are able to trigger platelet activationinvitro, and platelet TLR2 may play an important role in the interaction between GBS and platelets.
[KEY WORDS]Group B streptococci; Platelet activation; Sepsis; Toll-like receptors
doi:10.3969/j.issn.1000- 4718.2016.02.024
[中图分类号]R363; R515.3
[文献标志码]A
通讯作者△Tel: 020-81332486; E-mail: mlp215@aliyun.com
*[基金项目]广东省自然科学基金资助项目(No. S2013010015539)
[收稿日期]2015- 07- 16[修回日期] 2015- 10- 14
[文章编号]1000- 4718(2016)02- 0333- 06
