红景天苷对内皮祖细胞的辐射防护作用*
2016-03-05刘善淘朱锦灿陈小宇刘革修
刘善淘, 朱锦灿, 陈小宇, 刘革修
(暨南大学血液病研究所,广东 广州 510632)
红景天苷对内皮祖细胞的辐射防护作用*
刘善淘,朱锦灿,陈小宇,刘革修△
(暨南大学血液病研究所,广东 广州 510632)
[摘要]目的: 探讨红景天苷对内皮祖细胞(EPCs)的辐射防护作用,并分析其机制。方法: 体外培养正常人外周血EPCs,观察红景天苷对辐射后EPCs活性、黏附、迁移及凋亡的影响。应用CCK-8法检测细胞活性,流式细胞术检测细胞凋亡率, Western blotting法检测细胞内磷脂酰肌醇3-激酶(PI3K)/Akt通路中Akt蛋白表达水平。结果: 4 Gy [60Co]γ射线辐射可导致EPCs损伤,不仅细胞活性、黏附和迁移能力下降,而且细胞凋亡增加;与辐射对照组比较, 红景天苷则能部分逆转辐射对EPCs的损伤,提高EPCs的活性、黏附和迁移能力,减少辐射导致的细胞凋亡,增加细胞内磷酸化Akt蛋白的水平。但这些作用可被PI3K特异性抑制剂LY294002削弱。结论: 红景天苷对内皮祖细胞辐射损伤具有一定的防护作用,其机制可能与增强PI3K/Akt通路的作用有关。
[关键词]红景天苷; 辐射; 内皮祖细胞
内皮祖细胞(endothelial progenitor cells, EPCs)是血管内皮细胞的前体细胞,是血管内皮更新与修复以及损伤组织新生血管形成的重要细胞。研究显示,EPCs在心血管疾病、脑缺血损伤、肺损伤以及造血干细胞移植等治疗中具有重要作用[1-7]。然而,影像检查及治疗、肿瘤放射治疗等不可避免损伤正常的EPCs,从而产生一定的副作用并最终影响患者身体健康状态。探索高效低毒或无毒的辐射防护剂,使其既不影响辐射对临床的运用作用,同时又能降低辐射对人体正常组织的放射损伤,一直是国内外抗辐射药物研究经久不衰的热点。最近,研究显示,藏药红景天在心脑血管疾病治疗方面显示显著效果[8-9],其重要提取物红景天苷(salidroside,Sal)具有扩张阻力血管和容量血管、降低周围阻力,使动脉血压和左室舒张末压下降。说明其对血管平滑肌细胞或者内皮细胞具有重要作用。本文通过研究红景天苷对内皮祖细胞的辐射防护作用并初步了解其信号途径机制,为红景天的应用提供基础。
材料和方法
1材料
内皮细胞基础培养基2(endothelial basal me-dium-2,EBM-2)和内皮细胞生长培养基2(endothelial growth medium-2,EGM-2)购自Clonetics;人纤维连接蛋白(human fibronectin, HFN)购自Chemicon;FITC-UEA-I 为Sigma 产品; DiI-acLDL购自Molecular Probe; 小鼠抗人丝氨酸-苏氨酸激酶(serine-threonine kinase, Akt)单克隆抗体和小鼠抗人磷酸化Akt单克隆抗体(Millipore);小鼠抗人GAPDH 为Chemicon International产品;Transwell小室购自Corning;红景天苷购自中国食品药品检定所,用培养基配制成40 mmol/L的储存液;磷脂酰肌醇3-激酶(phosphatidyl-inositol 3-kinase,PI3K)抑制剂LY294002 (Sigma)用DMSO配制成1 mmol/L的储存液,-20 ℃保存。
2方法
2.1EPCs培养与鉴定培养、鉴定方法参见文献进行[10]。3名在校健康志愿男生,年龄22~24岁,肘静脉取血,肝素抗凝,密度梯度离心法分离单个核细胞,PBS洗涤2次后接种于含20%胎牛血清的EBM-2和EGM-2混合培养基、HFN(5 μg/cm2)包被的培养瓶,5% CO2、37 ℃、饱和湿度培养。4 d后用PBS 洗去非贴壁细胞, 换培养液,6 d后再用PBS洗掉非贴壁细胞, 贴壁细胞供实验用。待鉴定的细胞去培养基,PBS洗2遍、加稀释的DiI-acLDL(用培养基按1∶100稀释)、37 ℃下孵育2 h、PBS洗2遍,4%多聚甲醛固定10 min、PBS洗2遍后,1%曲拉通孵育20 min、PBS洗2遍,加1∶100稀释的lectin孵育1 h、PBS洗2遍、DAPI染色、荧光显微镜下鉴定UEA-I和acLDL 双染色阳性的EPCs,随机选择10个视野(×200)计数EPCs。实验分组:正常对照组(normal control, NC)、照射组(irradiation control, IC)、Sal实验组(照射前1 h 加入Sal)以及LY294002组(Sal+LY294002)。IC组、Sal实验组和LY294002组均接受γ射线照射,剂量为 4.0 Gy,剂量率为0.35 Gy/min,在暨南大学第一附属医院辐照中心进行。Sal浓度(80.0 μmol/L)和LY294002浓度(20 μmol/L)均依据文献及预实验选定。每份血液来源的EPCs完成1次独立实验。
2.2CCK-8 法检测细胞活性将EPCs细胞处理为单细胞悬液,调整细胞密度为6×107/L,每孔 100 μL 细胞悬液接种于 96 孔板。一块板接种对照组细胞,另一块板接种照射组、Sal实验组和LY294002组细胞。37 ℃、5% CO2培养箱中培养 24 h,实验组换成含Sal的培养基,LY294002组换成含Sal和LY294002的培养基,对照组及空白组换成新的普通培养基。1 h后辐射组、实验组和LY294002组经[60Co]γ射线照射,总剂量4.0 Gy。37 ℃、5% CO2及饱和湿度培养箱中继续培养12、24、48及72 h后,弃上清液后向每孔加入 10μL CCK-8 溶液,培养箱内孵育 2 h,当颜色开始变深时用酶标仪测定 450 nm(参比波长为630 nm)处的吸光度(A)值。实验设3个复孔,重复3 次。
2.3EPCs黏附能力检测辐射后的EPCs经0.25%胰蛋白酶消化、收集、悬浮在500 μL培养液中并计数。将辐射处理的EPCs接种在HFN包被的96孔培养板,每孔接种1×104个细胞,在37 ℃下培养30 min,计数贴壁细胞。
2.4EPCs迁移能力检测用0.25%胰酶消化EPCs, 收集并计数。将含Sal的500 μL培养液加入Transwell小室的下室, 辐射处理含2×103EPCs 100 μL注入上室,培养24 h, 刮去滤膜上未迁移细胞,甲醇固定、Giemsa染色, 随机选择3个显微镜视野(×400), 计数迁移的细胞。
2.5流式细胞术检测EPCs凋亡率取EPCs单细胞悬液,以 1×108/L的细胞密度分别接种于 6 孔板中,照射组、Sal实验组和LY294002组照射后24 h 和 48 h 收集细胞,1 000 r/min离心 5 min,PBS洗涤细胞2次,再次1 000 r/min离心 5 min,收集细胞,经Annexin V-FITC和碘化丙啶(PI)双染色后,用流式细胞仪检测细胞凋亡率。
2.6Westertn blotting检测细胞Akt蛋白的表达处理24 h后收集细胞提取总蛋白,采用BCA法进行蛋白定量。取30 μg蛋白上样,进行8%~12%的SDS-PAGE及转膜,然后用含5%脱脂奶粉的TBST对膜封闭30 min,加入稀释的Ⅰ抗于4 ℃孵育过夜,次日加入辣根过氧化物酶(horseradish peroxidase, HRP)标记的相应Ⅱ抗IgG(1∶3 000)于室温孵育1 h,TBST洗膜10 min×3次。化学荧光法检测,采集图像,采用Gelpro 4.0软件对目的蛋白进行定量分析。以GAPDH作为内参照。
3统计学处理
采用SPSS 17.0统计软件处理数据,计量资料以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA);计数资料采用χ2检验。以P<0.05为差异有统计学意义。
结果
1Sal对辐射EPCs细胞活性的影响
辐射组EPCs活性较对照组低,Sal组EPCs活性较辐射组增加,在24 h时即有明显差异, 72 h时较对照组增加了1.83倍(P<0.05)。且Sal组EPCs活性较对照组有相对增加的趋势,但差异无统计学意义。而LY294002组EPCs活性较Sal组降低。这说明辐射显著抑制EPCs活性,Sal(80 μmol/L)则能保护辐射对EPCs活性减弱的作用,LY294002(20 μmol/L)则能抑制红景天苷对辐射后EPCs活性增加的作用,见表1。
表1红景天苷对辐射后内皮祖细胞的细胞活性的影响
Table 1.The effects of salidroside (Sal) on the viability of irradiated EPCs (A450.Mean±SD.n=3)
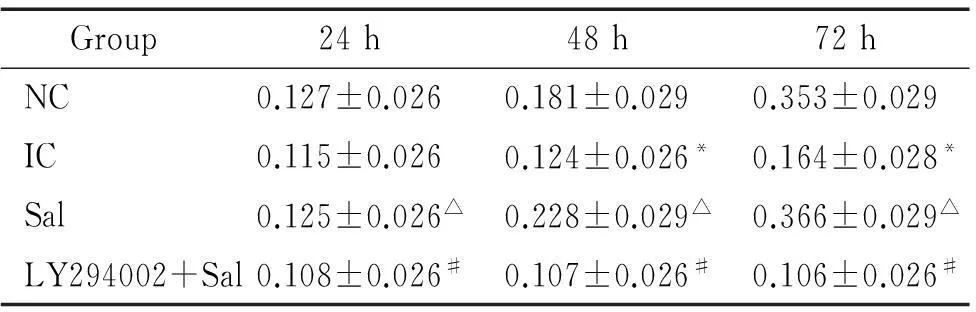
Group24h18h72hNC0.127±0.0260.181±0.0290.353±0.029IC0.115±0.0260.124±0.026*0.164±0.028*Sal0.125±0.026△0.228±0.029△0.366±0.029△LY294002+Sal0.108±0.026#0.107±0.026#0.106±0.026#
*P<0.05vsNC;△P<0.05vsIC;#P<0.05vsSal.
2Sal对辐射EPCs迁移的影响
Transwell小室培养检测细胞迁移,在400倍显微镜下计数迁移的细胞数,结果显示,辐射显著抑制EPCs迁移,辐射组迁移的细胞数是对照组的31%;Sal明显改善辐射处理的EPCs 的迁移能力,Sal组迁移的细胞数是辐射组的1.8倍;LY294002则能抑制Sal的作用,见图1。
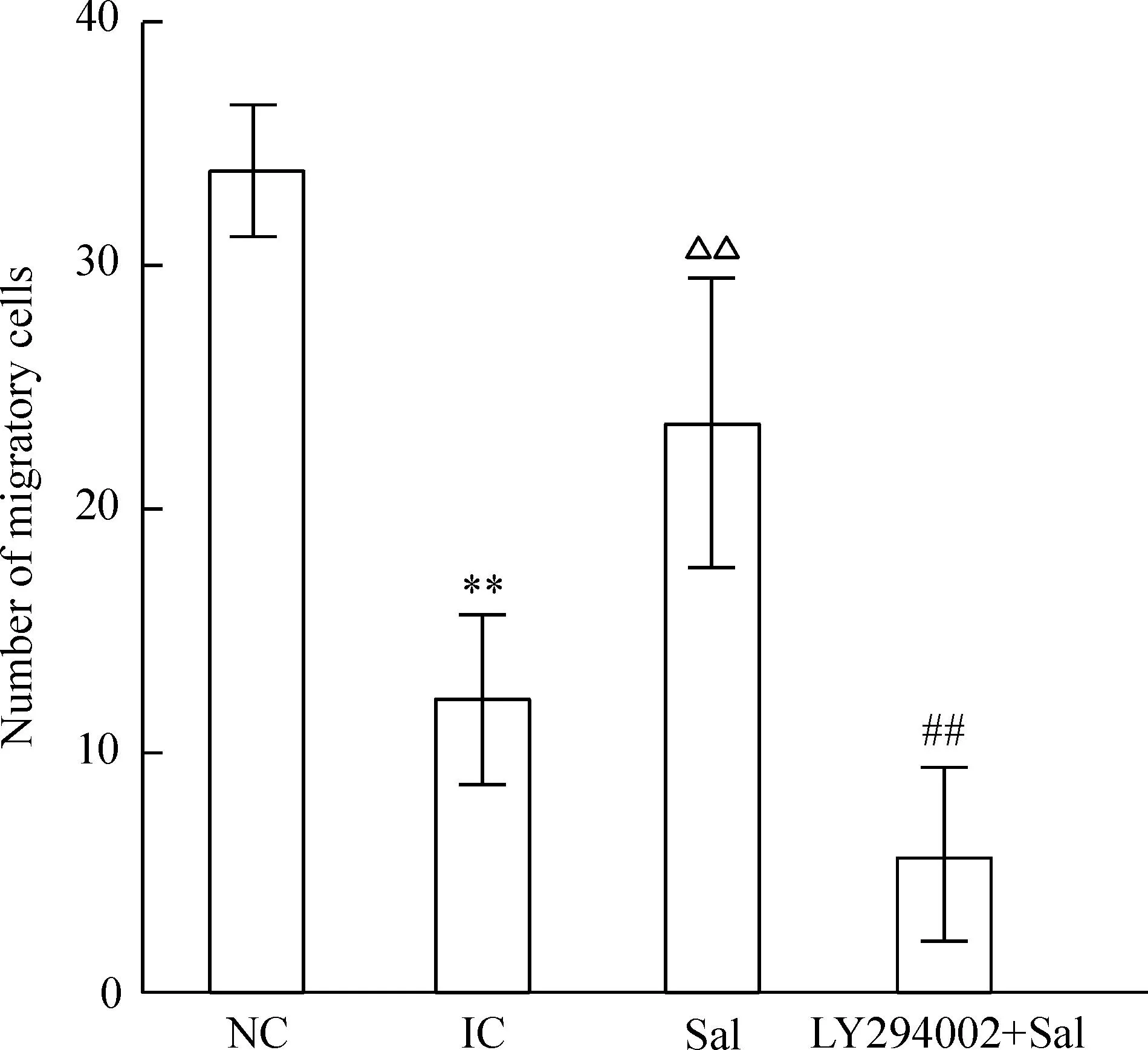
Figure 1.Effects of salidroside (Sal) on migration of irradiated EPCs. Mean±SD.n=3.**P<0.01vsNC;△△P<0.01vsIC;##P<0.01vsSal.
图1红景天苷对辐射后EPCs迁移能力的影响
3Sal对辐射EPCs黏附能力的影响
辐射显著抑制EPCs黏附能力,辐射组贴壁细胞数是对照组的30%;Sal明显改善辐射处理的EPCs 黏附能力,Sal组贴壁细胞数是辐射组2.1倍;LY294002则能抑制Sal的作用,见图2。

Figure 2.Effects of salidroside (Sal) on adhesion of irradiated EPCs. Mean±SD.n=3.**P<0.01vsNC;△△P<0.01vsIC;##P<0.01vsSal.
图2红景天苷对辐射后EPCs黏附能力的影响
4Sal对辐射EPCs凋亡的影响
结果显示,辐射诱导EPCs凋亡,辐射组EPCs 凋亡率是对照组的5.2倍;Sal明显抑制辐射诱导的EPCs 凋亡,LY294002则能抑制Sal的作用,见图3。
5Sal对辐射EPCs内p-Akt蛋白水平的影响
结果显示,红景天苷显著增加p-Akt蛋白水平;LY294002则能抑制红景天苷的作用,使p-Akt蛋白水平降低,见图4。
讨论
当今世界人类生活和工作中常常需要使用各种辐射,尤其在医学诊断与治疗中辐射已经成为重要工具。如临床上很多疾病在诊断或治疗上常常需要运用到辐射技术,如心血管疾病行冠脉造影术明确冠心病的诊断及在Χ线照射下行支架置入术及肿瘤行放射治疗等。同样,在脑缺血损伤、肺损伤以及造血干细胞移植等在医学诊治过程中应用辐射技术也很常见。但是辐射也对人身体造成严重损伤,影响组织细胞功能。辐射防护在生活与医学中仍然具有重要意义。内皮祖细胞是血管内皮更新与修复以及损伤组织新生血管形成的重要细胞,主要来源于骨髓。辐射技术是诊治疾病的重要手段,也是引起正常组织放射损伤的主要原因。所以,预防辐射损伤EPCs则可能对这些疾病预后具有重要影响。

Figure 3.Effects of salidroside (Sal) on apoptosis of irradiated EPCs. Mean±SD.n=3.**P<0.01vsNC;△△P<0.01vs IC;##P<0.01vsSal.
图3红景天苷对辐射后EPCs凋亡作用的影响

Figure 4.Effects of salidroside (Sal) on the expression of p-Akt protein in irradiated EPCs. Mean±SD.n=3.△P<0.05vsIC;#P<0.05vsSal.
图4红景天苷对辐射后EPCs细胞内p-Akt蛋白表达的影响
Sal来源于红景天属植物的块根,是藏药红景天的主要成分,不仅具有抗疲劳、抗氧化、神经保护、心血管保护等功能[1-3,11-12],而且在辐射预防方面也有相关研究报道。1997年邓伟国等[13]研究显示红景天苷有防护X线对脂质和细胞膜损伤的作用。朱锦灿等[14]研究显示红景天苷能促进辐射损伤的小鼠造血恢复。最近,Tang等[15]研究显示,红景天苷具有促进内皮祖细胞分化形成血管作用和对氧化应激损伤的保护作用。我们的研究结果显示,红景天苷能部分逆转辐射对EPCs的损伤,提高辐射损伤EPCs的活性、黏附和迁移能力,减少辐射导致的细胞凋亡,且其辐射防护作用与增强EPCs的PI3K/Akt通路作用有关。红景天苷对内皮祖细胞的辐射防护作用是本研究新发现,其增强EPCs的PI3K/Akt通路作用机制与已有的红景天苷作用机制有一定相关性[10,15]。这提示红景天苷在医学诊断与治疗中的辐射防护作用,为其辐射防护应用提供基础。
[参考文献]
[1]Zhang L, Xu Q. Stem/progenitor cells in vascular rege-neration[J]. Arterioscler Thromb Vasc Biol, 2014,34(6):1114-1119.
[2]Basile DP, Yoder MC. Circulating and tissue resident endothelial progenitor cells[J]. J Cell Physiol, 2014,229(1):10-16.
[3]Donahue M, Quintavalle C, Chiariello GA, et al. Endothelial progenitor cells in coronary artery disease[J]. Biol Chem, 2013,394(10):1241-1252.
[4]Zhao YH, Yuan B, Chen J, et al. Endothelial progenitor cells: therapeutic perspective for ischemic stroke[J]. CNS Neurosci Ther, 2013,19(2):67-75.
[5]Mao M, Xu X, Zhang Y, et al. Endothelial progenitor cells: the promise of cell-based therapies for acute lung injury[J]. Inflamm Res, 2013,62(1):3-8.
[6]Salter AB, Meadows SK, Muramoto GG, et al. Endothe-lial progenitor cell infusion induces hematopoietic stem cell reconstitutioninvivo[J]. Blood, 2009,113(9):2104-2107.
[7]Yan Z, Zeng L, Li Z, et al. Bone marrow-derived endothelial progenitor cells promote hematopoietic reconstitution after hematopoietic stem cell transplantation[J]. Transplant Proc, 2013,45(1):427-433.
[8]彭丽华. 红景天苷治疗心脑血管疾病相关药理作用的新进展[J]. 内蒙古中医药, 2013(28):101.
[9]王晴. 红景天与心脑血管疾病关系探讨[J]. 实用心脑肺血管病杂志, 2012,20(4):760-761.
[10]周芝兰,王林静,刘革修,等. 红景天苷对内皮祖细胞功能及其PI3K/Akt通路的影响[J]. 中国病理生理杂志, 2014, 30(7):1192-1195.
[11]Yu P, Hu C, Meehan EJ, et al. X-ray crystal structure and antioxidant activity of salidroside, a phenylethanoid glycoside[J]. Chem Biodivers, 2007,4(3):508-513.
[12]Li X, Sipple J, Pang Q, et al. Salidroside stimulates DNA repair enzyme Parp-1 activity in mouse HSC maintenance[J]. Blood, 2012,119(18):4162-4173.
[13]邓伟国,陈秋丽,傅艳,等. X 线对小鼠脂质及细胞表面电荷的影响和红景天苷的防护作用[J].白求恩医科大学学报,1997,23(1):17-19.
[14]朱锦灿, 陈小宇, 祝爱珍, 等. 红景天苷通过抑制骨髓脂肪细胞生成促进辐射损伤小鼠造血恢复[J].中华放射医学与防护杂志, 2014,34(10):17-20.
[15]Tang Y, Vater C, Jacobi A, et al. Salidroside exerts angiogenic and cytoprotective effects on human bone marrow-derived endothelial progenitor cells via Akt/mTOR/p70S6K and MAPK signalling pathways[J]. Br J Pharmacol, 2014,171(9):2440-2456.
(责任编辑: 卢萍, 罗森)
Protective effects of salidroside on endothelial progenitor cells damaged by radiationLIU Shan-tao, ZHU Jin-can, CHEN Xiao-yu, LIU Ge-xiu
(InstituteofHematology,JinanUniversity,Guangzhou510632,China.E-mail:tliugx@jnu.edu.cn)
[ABSTRACT]AIM: To explore the protective effects of salidroside on endothelial progenitor cells (EPCs) damaged by radiation and its mechanisms.METHODS: EPCs from normal peripheral blood were cultured in fibronectin-coated flasks with endothelial progenitor medium. The effects of salidroside on the viability, migration, adhesion and apoptosis of radiation-damaged EPCs were detected. The viability, apoptosis and migration of the cells were assayed by CCK-8 assay, flow cytometry and Transwell chamber experiment, respectively. The cell adhesion assay was performed by re-plating the cells on fibronectin-coated dishes, and then the adherent cells were counted. The expression of Akt protein in the cells was assessed by Western blotting. RESULTS: Salidroside improved the viability, and migratory and adhesive capacities of the EPCs, and decreased the apoptosis after radiation. Salidroside also increased the protein level of phosphorylated Akt. However, the effects of salidroside on radiation-damaged EPCs were inhibited by phosphatidylinositol 3-kinase inhibitor LY294002. CONCLUSION: Salidroside protects EPCs from radiation damages and its mechanism is associated with enhancing phosphatidylinositol 3-kinase/Akt signaling pathway.
[KEY WORDS]Salidroside; Radiation; Endothelial progenitor cells
doi:10.3969/j.issn.1000- 4718.2016.02.008
[中图分类号]R979.6; R363
[文献标志码]A
通讯作者△Tel: 020-85220262; E-mail: tliugx@jnu.edu.cn
*[基金项目]国家自然科学基金资助项目(No.81270568)
[收稿日期]2015- 07- 24[修回日期] 2015- 10- 12
[文章编号]1000- 4718(2016)02- 0240- 05
