柳蘑多糖对角质形成细胞作用实验研究
2016-03-03宋晶心董村张理涛王晋王玺
宋晶心,董村,张理涛,王晋,王玺
(1.天津中医药大学,天津 300193;2.天津达仁堂京万红药业有限公司,天津300112;3.天津市中医药研究院附属医院,天津300120;4.天津医科大学,天津300070)
·论著·
柳蘑多糖对角质形成细胞作用实验研究
宋晶心1,董村2,张理涛3,王晋3,王玺4
(1.天津中医药大学,天津 300193;2.天津达仁堂京万红药业有限公司,天津300112;3.天津市中医药研究院附属医院,天津300120;4.天津医科大学,天津300070)
目的观察柳蘑多糖对角质形成细胞株(HaCat细胞)生物学性状的影响,并探讨其相关作用机制。方法MTT法检测柳蘑多糖对HaCat细胞增殖活性的影响;Annexin V-PI染色法测定柳蘑多糖刺激HaCat细胞后的凋亡情况;PI法测定应用柳蘑多糖刺激后HaCat细胞周期的改变;重组人γ-干扰素(rhIFN-γ)诱导HaCat细胞活化,然后加入柳蘑多糖,用ELISA法检测IL-8和ICAM-1细胞因子分泌情况。结果MTT法证实柳蘑多糖对HaCaT细胞的增殖有抑制作用,且最佳抑制浓度为0.1 μg/mL,最佳作用时间为48 h;用Annexin V-PI染色法证实了柳蘑多糖可以促进HaCaT细胞凋亡,尤其是晚期凋亡;用PI法证实了柳蘑多糖可以影响HaCaT细胞的细胞周期,对细胞DNA合成期有影响;用ELISA法证明了rhIFN-γ活化后HaCaT细胞分泌的白介素-8(IL-8)及细胞间黏附分子-1(ICAM-1)明显增多,而柳蘑多糖可以使活化后HaCaT细胞分泌的IL-8及ICAM-1显著减少。结论柳蘑多糖可以抑制体外培养的角质形成细胞的增殖、促进角质形成细胞凋亡、改变角质形成细胞的细胞周期,减少细胞因子(IL-8,ICAM-1)分泌,提示柳蘑多糖有抑制角质形成细胞增殖、减轻炎症反应的潜力。
柳蘑多糖;HaCat细胞;银屑病
角质形成细胞(Keratinocyte,KC)是表皮最重要的细胞,在银屑病皮损区中KC表现出角化过度、角化不全、颗粒层消失及棘层肥厚的病理改变。KC不仅可作为免疫反应的靶细胞,而且可以通过表面分子及分泌的细胞因子等作用于皮损中浸润的炎细胞,尤其是T细胞,对其活性、功能及增殖能力等产生影响,这些都充分显示了KC的增殖为银屑病至关重要的致病因素之一,抑制其异常增殖是治疗银屑病的一种方法[1-2]。以往的研究表明,柳蘑软膏治疗寻常型银屑病有效[3],柳蘑软膏的主要成分是柳蘑和蜂蜡,而由柳蘑中提取的柳蘑多糖可以抑制体外培养的成纤维细胞株,有一定的抗增生作用,并且有抗微生物作用[4-6],另有研究表明柳蘑多糖具有免疫增强作用,有效地激活巨噬细胞[7]。本实验观察了柳蘑多糖对角质形成细胞株(HaCaT细胞)的影响,目的是为了探讨柳蘑软膏治疗寻常型银屑病可能的作用机制。
1 材料与方法
1.1 细胞材料 人角质形成细胞株(HaCat细胞)(天津医科大学基础医学院细胞生物学王玺课题组惠赠)。
1.2 试剂与仪器 重组人γ-干扰素(rhIFN-γ)、人IL-8 ELISA检测试剂盒、人sICAM-1 ELISA检测试剂盒(联科生物),AnnexinV-FITC/PI细胞凋亡检测试剂盒、DMEM培养基(南京凯基生物),胎牛血清(PAN-Biotech GmbH),二甲基亚砜(DMSO)、噻唑盐(MTT)(GIBCO),胰酶(AMRESCO);-80℃超低温冰箱、Centrifuge5810R离心机(Eppendorf Research),倒置显微镜(Leica),Chemvak负压吸液器(上海人和科学仪器),酶联免疫检测仪(Biotek),BD FACS Calibur流式细胞仪(碧迪医疗器械)。
1.3 方法
1.3.1 MTT法测柳蘑多糖对HaCat细胞增殖的影响 收集对数期生长HaCat细胞,将细胞以每孔约8 000个细胞,铺于96孔板中,按每个浓度设6个复孔,共设有6个浓度梯度(1 000 mg/L,100 mg/L, 10 mg/L,1 mg/L,0.1 mg/L,0.01 mg/L),同时设空白组(无细胞组)和对照组(溶剂组),也设6个复孔,共计48个孔,每孔加入DMEM完全培养基补至100 μL,边缘孔用PBS填充,移入CO2培养箱(37℃,饱和湿度,5%CO2)培养;细胞贴壁后,吸弃每孔上清,加入事先配好的各浓度梯度的柳蘑多糖和DMEM完全培养基混悬液100 μL,空白组加入100 μL DMEM完全培养基,对照组加入ddH2O和DMEM完全培养基混悬液,移入CO2培养箱培养;分别在24 h和48 h后加入20 μL MTT溶液(5 g/L),继续培养4 h;小心吸弃孔内培养液,每孔加入150 μL DMSO,使结晶紫充分溶解,室温放置约10 min后,在酶联免疫检测仪OD490处测各孔吸光值。
1.3.2 Annexin V-PI染色法测定柳蘑多糖刺激HaCaT细胞后的凋亡情况 收集对数期生长HaCat细胞,计数后,以每孔约2×105个铺于六孔板中,设阴性对照组(加溶剂,加FITC和PI染料)、药物组(加适当浓度药物及FITC和PI染料),待细胞贴壁后,阴性对照组加入ddH2O水,药物组加入配好的药物,移入CO2培养箱培养48 h。收集细胞(用不含EDTA的胰酶消化细胞,并要防止消化过度),将各孔的细胞团块用PBS洗涤2次,每孔加入250 μL binding buffer重悬细胞,移入1.5 mL EP管内,每管各取150 μL,再分别加入3个新的1.5 mL EP管中,每管100 μL,3孔分别为空白组、FITC单染孔、PI单染组。每管加入400 μL binding buffer补足至500 μL,避光分别加入5 μL FITC和PI,空白组不加染料,FITC单染孔加FITC染料,不加PI染料,PI单染组加PI染料,不加FITC染料,室温避光孵育10 min,将每管细胞移入流式管内(用黄膜过滤),用流式细胞仪收集10 000个细胞。以上实验重复3遍,取平均值。
1.3.3 PI法测定应用 柳蘑多糖刺激HaCaT细胞后的周期情况HaCat细胞铺板及加药收集处理同
1.3.2 ,收集细胞,用PBS洗涤细胞2次,再用PBS重悬细胞,取2个10 mL离心管,每管加入4 mL事先配制好的70%乙醇溶液,将1 mL PBS重悬的细胞,缓慢加入乙醇溶液中,放入-20℃,固定2 h以上。取出固定好的细胞,2 000 r/min,5 min离心,弃上清,用PBS洗涤细胞2次,得到细胞团块后,用500 μL 1×PI重悬细胞,室温孵育20 min,将每管细胞移入流式管内(用黄膜过滤),用流式细胞仪收集10 000个细胞。以上实验重复3遍,取平均值。
1.3.4 ELISA法检测柳蘑多糖对rhIFN-γ活化的HaCat细胞分泌ICAM-1和IL-8的影响 取对数生长期生长状态良好的HaCaT细胞,经消化液消化细胞,离心5 min后计数,以2×105/孔接种于六孔板(对照组,空白组,药物组),加入500 U/mL rhIFN-γ刺激培养细胞24 h后,分别用ddH2O(对照组)、待测药物(药物组)处理48 h后,收集细胞上清,4℃,1 000 r/min,离心10 min,弃沉淀得到细胞上清待用。按试剂盒说明配制1×洗液、1×检测缓冲液、检测抗体,重溶人ICAM-1(IL-8)标准品,制作标准曲线,根据标准曲线计算各组细胞上清中ICAM-1(IL-8)的含量。
2 结果
2.1 MTT法测柳蘑多糖对HaCat细胞增殖的影响柳蘑多糖在浓度为10~0.01 mg/L,时间为24 h或48 h时,对HaCat细胞的增殖均有抑制作用,且差异有统计学意义(P<0.05),但柳蘑多糖在浓度为0.1 mg/L,作用时间为48 h时,对HaCat细胞增殖的抑制作用最强,所以笔者后续实验选择作用浓度为0.1 mg/L,作用时间为48 h。见表1,图1。
表1 柳蘑多糖对HaCat细胞增殖的影响(24 h和48 h)(s)
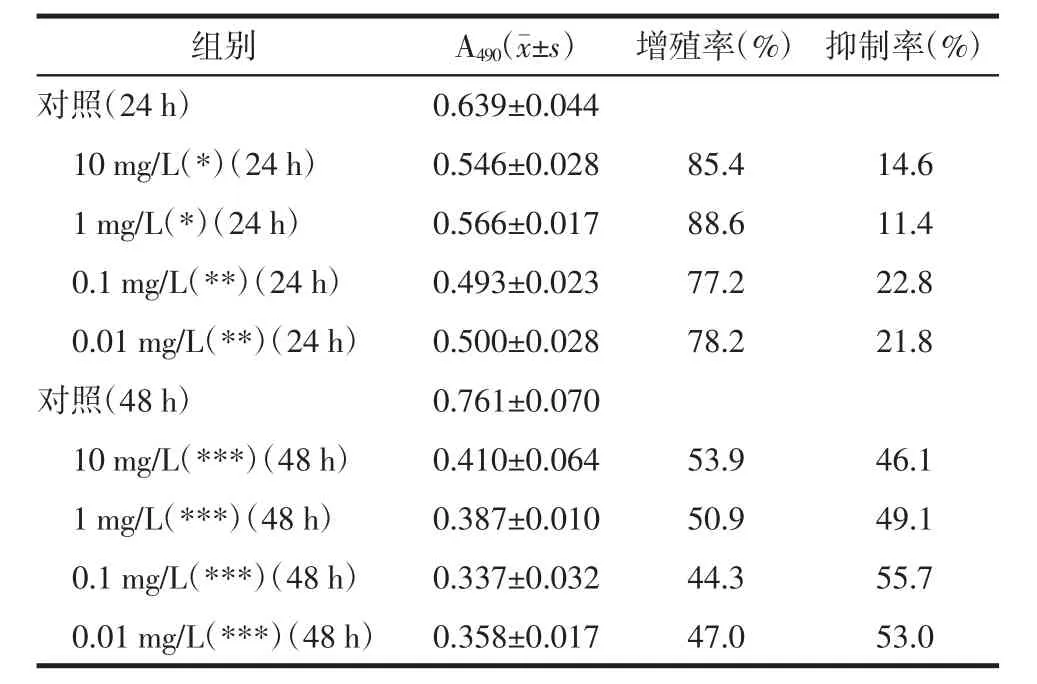
表1 柳蘑多糖对HaCat细胞增殖的影响(24 h和48 h)(s)
注:与对照组相比,*P<0.05*,**P<0.01,***P<0.001。
增殖率(%) 抑制率(%)对照(24 h) 0.639±0.044 10 mg/L(*)(24 h) 0.546±0.028 85.4 14.6 1 mg/L(*)(24 h) 0.566±0.017 88.6 11.4 0.1 mg/L(**)(24 h) 0.493±0.023 77.2 22.8 0.01 mg/L(**)(24 h) 0.500±0.028 78.2 21.8对照(48 h) 0.761±0.070 10 mg/L(***)(48 h) 0.410±0.064 53.9 46.1 1 mg/L(***)(48 h) 0.387±0.010 50.9 49.1 0.1 mg/L(***)(48 h) 0.337±0.032 44.3 55.7 0.01 mg/L(***)(48 h) 0.358±0.017 47.0 53.0组别 A490(s)

图1 柳蘑多糖对HaCat细胞增殖的影响
2.2 Annexin V-PI染色法测定柳蘑多糖刺激HaCaT细胞后的凋亡情况 浓度为0.1 mg/L的柳蘑多糖对HaCat细胞的凋亡产生影响,使凋亡晚期细胞增多,凋亡早期细胞减少,且差异有统计学意义(P<0.05),见表2。因此,柳蘑多糖可以促进HaCat细胞的凋亡,且意义可能为促进早期凋亡过渡至晚期凋亡。见图2~4。
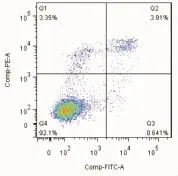
图2 对照组凋亡情况

图3 0.1 mg/L组凋亡情况

图4 柳蘑多糖对HaCat细胞凋亡的影响
表2 柳蘑多糖对HaCat细胞凋亡的影响 (s)
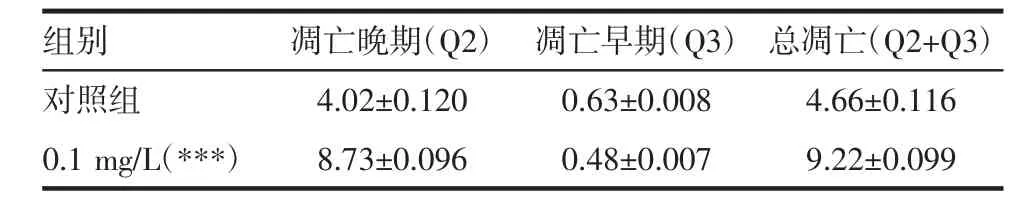
表2 柳蘑多糖对HaCat细胞凋亡的影响 (s)
注:与对照组相比,***P<0.001。
组别 凋亡晚期(Q2) 凋亡早期(Q3) 总凋亡(Q2+Q3)对照组 4.02±0.120 0.63±0.008 4.66±0.116 0.1 mg/L(***) 8.73±0.096 0.48±0.007 9.22±0.099
2.3 PI法测定应用 柳蘑多糖刺激HaCaT细胞后的周期情况 浓度为0.1 mg/L的柳蘑多糖可以影响HaCaT细胞的细胞周期,且是对细胞DNA合成期有影响,差异有统计学意义(P<0.05),但对细胞DNA合成前期(G1期)及DNA合成后期(G2期)无影响,差异无统计学意义(P>0.05)。见表3,图5~7。
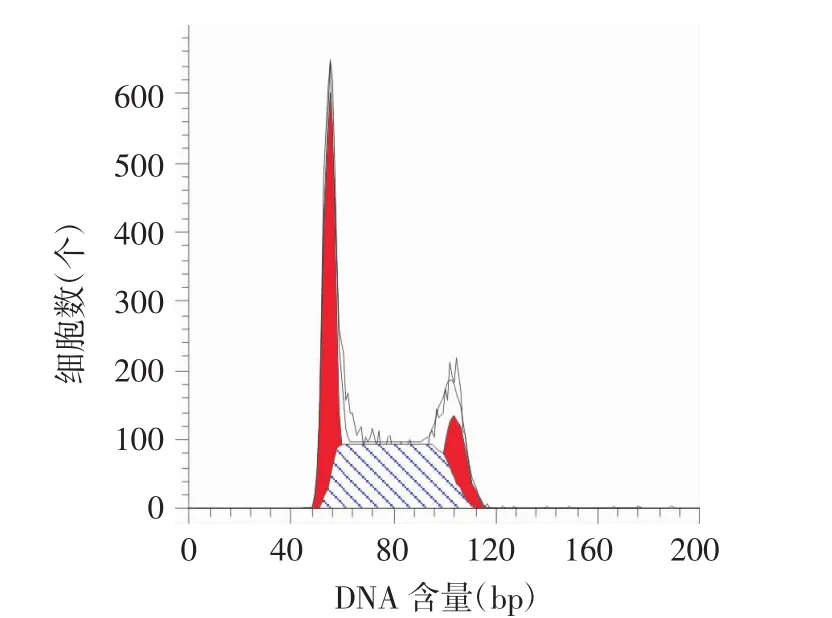
图5 对照组细胞周期情况

图6 0.1 μg/mL组细胞周期情况
2.4 ELISA法检测 柳蘑多糖对rhIFN-γ活化的HaCat细胞分泌ICAM-1和IL-8的影响HaCat细胞可自发分泌ICAM-1和IL-8,经rhIFN-γ刺激后,HaCat细胞的ICAM-1和IL-8分泌量明显增多,差异有统计学意义(P<0.05),且浓度为0.1 mg/L的柳蘑多糖对活化后的HaCaT细胞分泌的ICAM-1和IL-8有抑制作用,差异具有统计学意义(P<0.05)。见表4,图8、9。

图7 细胞周期占比比较
表3 柳蘑多糖对HaCat细胞细胞周期的影响(s,%)
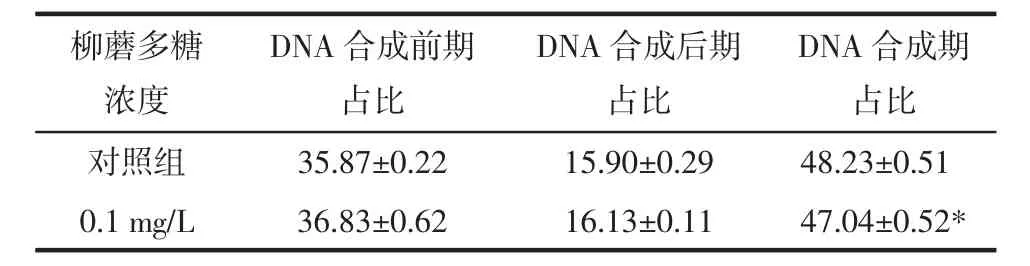
表3 柳蘑多糖对HaCat细胞细胞周期的影响(s,%)
注:与对照组相比,*P<0.05。
柳蘑多糖浓度DNA合成期占比对照组 35.87±0.22 15.90±0.29 48.23±0.51 0.1 mg/L 36.83±0.62 16.13±0.11 47.04±0.52* DNA合成前期占比DNA合成后期占比
表4 柳蘑多糖对ICAM-1及IL-8分泌的影响 (s)

表4 柳蘑多糖对ICAM-1及IL-8分泌的影响 (s)
注:与对照组相比,*P<0.05,**P<0.001。
已活化 柳蘑多糖浓度IL-8分泌浓度(pg/mL)对照组 2 353.01±86.27 3 305.40±88.73 0.1 mg/L 1 678.48±85.64* 1 922.14±69.89**未活化 123.84±34.56** 131.80±25.84** ICAM-1分泌浓度(pg/mL)
3 讨论

图8 柳蘑多糖对ICAM-1分泌的影响
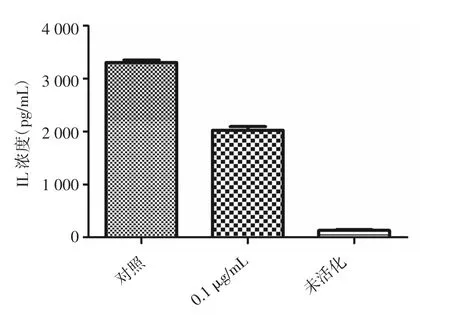
图9 柳蘑多糖对IL-8分泌的影响
银屑病是一种临床常见的以KC过度增生为特点的炎症性皮肤病,其患者具有特征性的红色丘疹、斑块,上覆银白色鳞屑,有点状出血,表现出角化过度、角化不全、颗粒层消失及棘层肥厚的病理改变[8]。银屑病的确切病因及发病机理尚未完全清楚,但目前多数学者认为银屑病是一种T细胞介导的自身免疫性疾病,由活化T细胞产生的细胞因子(如γ-干扰素)刺激KC增殖,而增殖的KC又能释放出其他细胞因子(如IL-8、ICAM-1),进一步增强活化的T细胞的作用,形成一种正反馈调节[1-3]。KC不仅可作为免疫反应的靶细胞,而且可以通过表面分子及分泌的细胞因子等作用于皮损中浸润的炎细胞,尤其是T细胞,对其活性、功能及增殖能力等产生影响,而由IFN-γ等细胞因子诱导KC产生的IL-8、ICAM-1等细胞因子增强皮损中细胞的活化状态,这些都充分显示KC在银屑病的发病机制中主动参与了免疫紊乱过程[9-11]。因此KC的增殖为银屑病至关重要的致病因素,抑制其异常增殖是治疗银屑病的一种方法。IFN-γ是Thl淋巴细胞分泌的重要细胞因子之一,是调节皮肤炎症和免疫反应的最有效的促炎因子,对KC有活化作用,并可使KC表达许多趋化因子、细胞因子和膜分子,进一步级联放大了炎症反应[12]。多形核中性粒细胞聚集至表皮是通过IL-8的趋化作用来实现的,而KC与炎性细胞间的黏附是由ICAM-1实现的,这3种细胞因子在T细胞与KC之间形成一种桥梁,使二者可以相互影响,相互作用[9]。笔者研究结果显示用IFN-γ刺激KC(HaCaT细胞),可以使KC(HaCaT细胞)分泌的ICAM-1及IL-8水平显著升高,具有活化KC(HaCaT细胞)的作用。皮肤中浸润的T细胞分泌的IFN-γ诱导KC表面ICAM-1表达,促进KC与淋巴细胞间的相互作用,同时促进白细胞移入表皮。IL-8能促进中性粒细胞、淋巴细胞趋化,同时也是KC的促生长因子,可加速表皮增殖,其主要的生物学功能是在炎症反应中趋化中性粒细胞和T细胞向表皮浸润,引起局部炎症反应[13]。
而柳蘑软膏是一种外用的柳蘑为主要成分的药膏,已上市多年,根据长期临床疗效观察,柳蘑软膏治疗轻中度银屑病有一定的疗效[3],但具体作用机制尚未得到探讨。柳蘑软膏主要成分是柳蘑,柳蘑又名又黄伞、黄蘑,是8~10月份群生于阔叶树的蛀眼或倒木上,尤其是柳树上居多的一种北方特有的野生珍稀食用菌。其主要成分为柳蘑多糖,柳蘑多糖可以抑制体外培养的成纤维细胞株,有一定的抗增生作用,并且有抗微生物作用,其对金黄色葡萄球菌、大肠杆菌、结核分枝杆菌等有较强的抗菌活性;同时,柳蘑多糖还有较强的还原性及抗氧化活性[4-6]。另外,还有文献表明,柳蘑多糖具有免疫增强作用,其对小鼠腹腔巨噬细胞的激活效应研究证明,其能有效地激活巨噬细胞,通过增强细胞因子分泌、增强NO的产生水平、增强其吞噬功能及体外杀伤活性等多种途径来调节免疫系统,并可起到抑制肿瘤的生长效应[7]。而本实验研究证实,柳蘑多糖可以对HaCaT细胞造成影响,其作用机制是通过抑制KC增殖,促进KC凋亡,改变KC的细胞周期及细胞因子(IL-8,ICAM-1)分泌这4个方面实现的,从KC的角度初步探讨了柳蘑软膏治疗银屑病的分子及细胞机制,但本实验尚未涉及柳蘑多糖对免疫细胞(如T淋巴细胞)的影响,这也是笔者今后工作会继续的方向。
[1] 王刚,张开明.银屑病[M].人民卫生出版社,2005,4(1):29-31, 238.
[2] 万永山,张开明.角质形成细胞在银屑病发病中的再认识[J].中国麻风皮肤病杂志,2008,24(1):45-47.
[3] 董村,宋晶心,孟令贺,等.顽癣敌软膏治疗寻常型银屑病临床疗效观察[J].中国中西医结合皮肤性病学杂志,2016,15(4): 227-229.
[3] Deng P,Zhang G,Zhou B,et al.Extraction and in vitro antioxidant activity of intracellular polysaccharide by Pholiota adiposa SX-02 [J].Biosci Bioeng,2011,111:50-54.
[4] Dulger B.Antimicrobial activity of the macrofungus Pholiota adiposa[J].Fitoterapia,2004,75:395-397.
[5] Zhang GQ,Sun J,Wang HX,et al.A novel lectin with antiproliferative activity from the medicinal mushroom Pholiota adiposa[J].Acta Biochim Pol,2009,56:415.
[6] 苏延友,康莉,杨志孝.柳蘑多糖的提取及对小鼠腹腔巨噬细胞的激活效应研究[J].泰山医学院学报,2004,25(1):9-11.
[7] 赵辨.中国临床皮肤病学[M].南京:江苏科学技术出版社,2012, 8:1008-1011.
[8] 李红,胡晋红.银屑病发病机制的免疫学研究进展[J].药学服务与研究,2012,12(4):277-279.
[9] Tonel G,Cornad C.Interplay between keratinocytes and immune cell-recent insights into psoriasis pathogenesis[J].Int J Biochen Cell Biol,2009,41:963-968.
[10]金玲爽,沈志忠.干扰素γ对角质细胞与破骨细胞的影响[J].医学综述,2008,10(14):3064-3067.
[11]张理涛,闫学真,夏青,等.细胞因子和链球菌抗原对人角质形成细胞的作用[J].中国皮肤性病学杂志,2000,14(1):383-384.
[12]刘玉琴.细胞因子与银屑病关系的研究进展[J].医学综述,2001, 7(7):393.
[13]沈芳,谢韶.细胞因子与银屑病发病关系的研究进展[J].中国麻风皮肤病杂志,2015,13(3):156-159.
Effects of Pholiota Adiposa Polysaccharide on Keratinocytes
Song Jingxin1,Dong Cun2,Zhang Litao3,Wang Jin3,Wang Xi4
1.Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2.Tianjin Darentang Jingwanhong Pharmaceutical Co.,Ltd,Tianjin 300112,China;3.Tianjin Academy of Traditional Chinese Medicine Affiliated Hospital, Tianjin 300120,China;4.Tianjin Medical University,Tianjin 300070,China
ObjectiveIn order to investigate the influence of pholiota adiposa polysaccharide on keratinocytes(HaCat cells) and its possible mechanism.Method MTT method was used to detect proliferation situation of HaCaT cells that stimulated by pholiota adiposa polysaccharides;Annexin V-PI staining method was used to detect apoptosis situation of HaCaT cells that stimulated by pholiota adiposa polysaccharides;PI method was used to detect the cell cycle’s change of HaCaT cells that stimulated by pholiota adiposa polysaccharides;rhIFN-γ was used to active HaCaT cells,then the pholiota adiposa polysaccharides was added to detect the excretion of IL-8 and ICAM-1(ELISA method).ResultsThe MTT method proved that pholiota adiposa polysaccharide inhibited the proliferation of HaCaT cells;the best inhibiting concentration was 0.1 g/mL; and the best action time was 48 h.The Annexin V-PI staining method proved that pholiota adiposa polysaccharide promoted the apoptosis of HaCaT cells.The PI method proved that pholiota adiposa polysaccharide could effected on the HaCaT cells cycle(cells’DNA synthesis phase).The ELISA method proved that HaCaT cell excreted IL-8 and ICAM-1 increasing significantly after activated by rhIFN-γ,on the contrary,pholiota adiposa polysaccharide could reduce the excretion of IL-8 and ICAM-1 by activated HaCaT cells.ConclusionPholiota adiposa polysaccharide could affected on keratinocytes(HaCaT cells).And the mechanism is possibly by inhibiting the proliferation of keratinocytes,promoting the apoptosis of keratinocytes, changing the cell cycle of keratinocytes and the excretion of cytokines(IL-8 and ICAM-1).
Pholiota adiposa polysaccharide;HaCaT cell;Psoriasis
R331
A
1672-0709(2016)06-0331-05
2016-03-22)
