精子DNA碎片率对男性不育及早期复发性流产的影响
2016-02-27史海跃郑娟周黎明等
史海跃+郑娟+周黎明+等
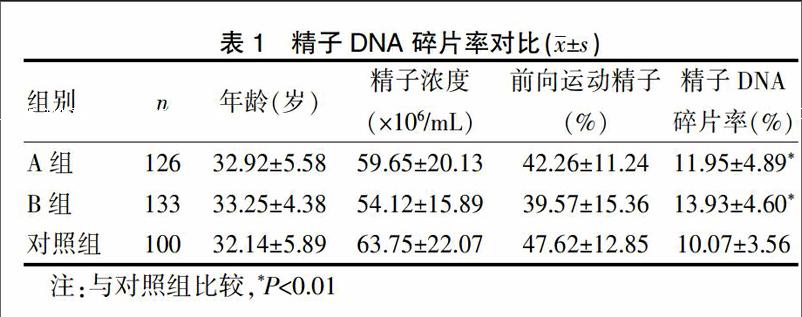
[摘要] 目的 探讨精子DNA 碎片率对男性不育及早期复发性流产的影响。 方法 应用病例对照研究方法,分别比较研究组A(原因不明的原发性不育症男性)与对照组(近3个月内配偶正常分娩的男性)间、研究组B(配偶有早期复发性流产史的男性)与对照组(近3个月内配偶正常分娩的男性)间精子DNA 碎片率的差异。 结果 研究组A 126例,精子DNA碎片率为(11.95±4.89)%,研究组B 133 例,精子DNA碎片率为(13.93±4.60)%,对照组100 例,精子DNA碎片率为(10.07±3.56)%,研究组A、B与对照组间精子DNA 碎片率均存在显著性差异。 结论 精子DNA碎片率与男性不育及早期复发性流产间存在相关性。
[关键词] 精子DNA 碎片率;男性不育;早期复发性流产
[中图分类号] R714.8 [文献标识码] B [文章编号] 1673-9701(2015)26-0072-04
Effect of Sperm DNA fragmentation on male infertility and early recurrent miscarriage
SHI Haiyue ZHENG Juan ZHOU Liming CAI Jie RONG Chunhao
Reproductive Medical Center,Ningbo Women and Children Hospital,Ningbo 315012,China
[Abstract] Objective To explore the effect of sperm DNA fragmentation on male infertility and early recurrent miscarriage. Methods Case-control study method was used. Sperm DNA fragmentation rates were compared between the study group A(the primary infertile males for unknown reasons),as well as the study group B(the males whose spouses undergoing early recurrent miscarriage)and the cross reference group(the males whose spouses undergoing delivery in three months),respectively. Results The sperm DNA fragmentation rate of the study group A(n=126) was(11.95±4.89)%,whereas that of the study group B(n=133) was (13.93±4.60)%. The sperm DNA fragmentation rate of the cross reference group(n=100) was (10.07±3.56)%. The sperm DNA fragmentation rates were significant different between the study groups A and B with the cross reference group. Conclusion Sperm DNA fragmentation rate has effect on male infertility and early recurrent miscarriage.
[Key words] Sperm DNA fragmentation rate; Male infertility; Early recurrent miscarriage
在生殖医学领域,目前尚存在许多令医务工作者困扰的难题,大部分都是因为缺乏有效的检测手段而使人一筹莫展。其中,男性原因不明性不育及早期复发性流产就很典型。两者目前的检测手段均很有限且具有局限性,无法切实有效地指导临床诊治。近年来的研究显示,精子染色体的完整性或许能为解决上述两个难题打开突破口。精子染色体承载着将父辈的遗传信息传递给后代的作用,通常可分为三种结构,分别是环状结构、螺线管结构及核基质结合域,各自具有不同的生理功能[1]。这些结构的完整性影响生殖的多个方面,包括受精、卵裂、流产等。本文采用病例对照的方法,对原因不明的原发性不育症男性、配偶有早期复发性流产史的男性以及近3个月内配偶正常分娩的男性精子进行DNA碎片率检测并分别进行比较,探讨精子DNA碎片对男性不育及早期复发性流产的影响,现报道如下。
1 资料与方法
1.1 一般资料
收集2013年8月~2014年7月间在我院男科门诊就诊的原因不明的原发性不育男性作为研究组A,共126例。纳入标准:婚后同居至少1年、性生活正常、未避孕未育的男性,排除引起不育的因素,如先天性异常、精索静脉曲张、附属性腺感染等,配偶检查正常。收集2013年8月~2014年7月间在我院门诊就诊的配偶有早期复发性流产史的男性作为研究组B,共133 例。收集2013年8月~2014年7月间在我院产科成功分娩的男性配偶作为对照组,共100例。三组研究对象中夫妇任意一方存在解剖学异常、内分泌异常、染色体异常或免疫因素所致均不纳入研究范围。三组男性精液常规及精子形态按照世界卫生组织(WHO)《人类精液检查与处理实验室手册》(2011年,第5版)[2]检测均正常。
1.2 精子DNA碎片检测
受试者禁欲3~5 d,手淫法收集精液,置于37℃培养箱中液化后进行检测。DNA碎片检测试剂为安徽安科生物工程公司生产的精子DNA碎片染色试剂盒,采用精子染色质扩散试验(SCD)检测DNA碎片率,推荐的参考范围为<10%。具体检测步骤如下:①取精液待检样本用PBS调整浓度至(500~1 000)万/mL;②取溶液A溶解(沸水90℃~100℃,5 min)后,37℃ 5 min,加入30 μL标本,混匀;③取预处理玻片一张(事先置于4℃冰箱),将琼脂糖精液20 μL加到玻片上并标记位置,盖上盖玻片,加入4℃冰箱5 min;④将溶液B加入9 mL蒸馏水中,平皿中混匀;小心划拉取开盖玻片,水平置入溶液B中室温7 min;⑤取出玻片,水平置入10 mL溶液C平皿中室温25 min后,置入装有蒸馏水平皿中5 min,然后分别置入70%、90%、100%乙醇中2 min,取出自然晾干;⑥染色:加溶液D,1 min;加溶液E用洗耳球吹匀,染色10~15 min;⑦应用纯净水洗涤玻片,封片剂封片;⑧应用光学显微镜,于400倍镜下计数500个精子,观察精子光晕大小[3]。根据光晕与精子头部直径的比例,分为大、中、小和无光晕4个等级,大和中光晕表示精子DNA完整无碎片,小和无光晕表示精子DNA断裂为碎片。小光晕以精子头直径≤1/4为判断标准;中光晕精子头直径>1/4,而精子头直径≤2/3;大光晕精子头直径>2/3。精子DNA碎片率(%)=存在DNA碎片精子数/计数精子总数×100%。
1.3统计学处理
采用SPSS13.0统计学软件进行分析,计量资料以均数±标准差(x±s)表示,组间比较采用t检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 精子DNA碎片率比较
研究组A共126例,精子DNA碎片率为5%~25.5%。研究组B共133 例,精子DNA碎片率为7%~28%。对照组共100例,精子DNA碎片率为4.5%~18.5%。见表1。
2.2 男性不育率比较
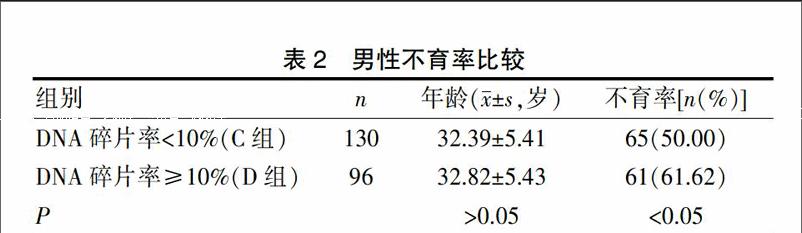
按照试剂盒推荐的参考范围10%将研究组A 126例、对照组100 例共226例男性分组,比较DNA碎片率<10%组(C组)与DNA碎片率≥10%组(D组)男性不育率。其中C组130例,平均年龄(32.39±5.41)岁,不育症发生率50.0%(65例),D组96例,平均年龄(32.82±5.43)岁,不育症发生率61.62%(61例)。两组间不育症发生率差异有统计学意义(P<0.05)。见表2。
表2 男性不育率比较
2.3 早期复发性流产率比较
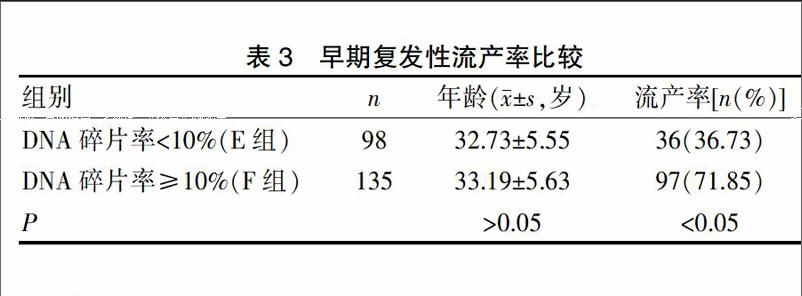
按照试剂盒推荐的参考范围10%,将研究组B 133 例、对照组100 例共233例男性分组,比较DNA碎片率<10%组(E组)与DNA碎片率≥10%组(F组)早期复发性流产的发生率。其中E组98例,平均年龄(32.73±5.55)岁,流产率36.73%(36例),F组135例,平均年龄(33.19±5.63)岁,流产率71.85%(97例)。两组间早期复发性流产率差异有统计学意义。见表3。
表3 早期复发性流产率比较
3 讨论
在生殖医学领域,男性原因不明性不育及早期复发性流产一直困扰着广大医务工作者。不育症是指已婚夫妇有规律的性生活超过1年,双方没有采取避孕措施未能获得自然受孕。发病率大约占生育年龄妇女的8%~17%,平均为10%,其中男性因素约占50%。但是男性生育能力的检测手段相对缺乏,目前通常通过检测精液常规参数,如精子浓度、活力、形态等来评估男性生育能力。但研究表明,上述常规参数对男性不育的诊断存在一定的局限性,无法做出准确评估[4]。同时约有15%的男性不育患者因精液常规检查结果分析正常[5]而被诊断为不明原因性不育。
早期复发性流产是指连续遭受2次或2次以上发生于妊娠12周之前的胎儿丢失者,发生率约为0.4%~0.8%[6],且有逐年增加的趋势。治疗手段主要是根据病因采取针对性治疗,但目前病因筛查主要针对女性,男性因素主要针对遗传学异常,相关检测手段却极其有限,这一现状导致原因不明者占比近50%。这些患者缺乏有效的治疗手段,已经成为生殖医学急需解决的难题。
近期研究表明,以精子DNA损伤作为特征的精子染色体结构异常可能对男性生育能力及早期复发性流产存在一定的预测价值[7-10]。本实验采用精子染色质扩散法(SCD)对原因不明的原发性不育症男性、配偶有早期复发性流产史的男性及近3个月内配偶正常分娩的男性的精子DNA 碎片率进行检测,发现前两组的DNA碎片率均显著高于配偶正常分娩的男性。
同时,按照试剂盒推荐的参考范围10%将原发性不育症男性 126例、配偶正常分娩男性100 例共226例男性分组,比较DNA碎片率<10%组与DNA碎片率≥10%组男性不育率,发现DNA碎片率≥10%组男性不育率明显高于DNA碎片率<10%组。
按照试剂盒推荐的参考范围10%将配偶有早期复发性流产史的男性133例、配偶正常分娩男性100 例共233例男性分组,比较DNA碎片率<10%组与DNA碎片率≥10%组早期复发性流产的发生率。发现DNA碎片率≥10%组男性早期复发性流产率明显高于DNA碎片率<10%组。
研究结果提示:男性精子DNA碎片率对于男性生育能力及早期复发性流产具有一定的评估及预测价值。人精子染色体具备特殊的结构,不同的结构各自具有不同的生理功能,这些结构的完整性在受精与胚胎发育过程中占据了非常重要的地位[1,11-13]。精子DNA碎片化的发生机制尚不清楚。一般认为可能与精子发生过程中出现的凋亡异常、氧压胁迫、异常染色质包装有关[14-16]。
精子DNA碎片率的检测手段可以分为两大类[1]。第一种是用探针来检测DNA断裂的位点,通过收集探针信号来评估精子DNA的损伤程度,如原位缺口平移法(ISNT)和末端转移酶介导的dUTP 末端标记法(TUNEL)等;第二种是根据双链DNA比受损的DNA不容易变性的原理,如精子染色质扩散试验(SCD)、精子染色质结构分析试验(SCSA)、吖啶橙试验(AOT)和彗星实验(COMET assay)。相比于其他方法,精子染色质扩散试验(SCD)操作简便、费用低、敏感度高,无需昂贵的仪器,适合基层单位开展。Rybar等[17]研究表明,在不育症患者中,精子DNA受损程度较正常人严重。而Giwercman等[18]研究发现男性发生不育的危险性随着碎片率的升高而增加。本研究结果显示常规精液参数均正常的不育男性及正常生育男性中,研究组的DNA碎片率明显高于对照组,支持上述研究结果,表明精子DNA碎片率的检测能对男性生育能力进行较好的评估和预测。Robinson等[19]发现DNA损伤较严重的人群比无明显DNA损伤的人群自然流产几率大幅度增加。Zini等[20]认为DNA损伤的精子可能是导致男性不育的重要因素,即使有时可以使配偶受孕,但大多数都在早期发生自然流产。本研究结果同样证明了这些观点。配偶有早期复发性流产史的男性的DNA碎片率明显高于正常生育男性。表明精子DNA碎片率的检测同样能对早期复发性流产具有一定的评估和预测作用。
综上所述,男性不育及早期复发性流产与男性精子DNA碎片率升高有关。但是精子DNA碎片化的发生机制尚未完全清楚,临床医务人员还不能“寻找”出一种特别有效的能够预防精子DNA碎片产生以及精子DNA碎片产生后如何治疗等一系列针对性措施[21-23]。并且上述两大类检测方法对精子均有损伤,检测后的精子不能用于辅助生殖。因此,迫切需要寻找有效的治疗手段及无创的检测技术。期待进一步的探讨和研究能解决这两方面问题。
[参考文献]
[1] 赵凯,熊承良. 人精子染色质损伤及其检测的研究进展[J].中华男科学杂志,2013,19(5):460-463.
[2] 谷翊群. 世界卫生组织人类精液检查与处理实验室手册[M]. 第5版. 北京:人民卫生出版社,2011:52-54.
[3] Fernandez JL,Muriel L,Goyanes V,et al. Simpledetermination of human sperm DNA fragementation with an improved sperm chromatin dispersion(SCD)test[J]. Fertil Steril,2005,84(4):833-842.
[4] Guzick DS,Overstreet JW,Factor-Litvak P,et al. Sperm morphology,motility, and concentration in fertile and infertile men[J]. N Engl J Med,2001,345(19):1388-1393.
[5] Shamsi MB,Imam SN,Dada R. Sperm DNA integrity assays:diagnostic and prognostic challenges and implications in management of infertility[J]. J Assist Reprod Genet,2011,28(11):1073-1085.
[6] Wransby ML,Sten-Linder M,Bremme K,et al. Primary habitual abortions are associated with high frequency of factor V Leiden mutation[J]. Fertil Steril,2000,74(5):987-991.
[7] Venkatesh S,Singh A,Sharnsi MB,et al. Clinical significance of sperm DNA damage threshold value in the assessment of male infertility[J]. Reprod Sci,201l,18(10):1005-1013.
[8] Evenson DP,Larson KL,Jost LK. Sperm chromatin structure assay:Its clinical use for detecting sperm DNA fragmentation in male infertility and comparisons with other techniques[J]. J Androl,2002,23(1):25-43.
[9] 费前进,黄航,金建远,等. 精子DNA损伤在男性不育中的诊断价值[J]. 中华医学遗传学杂志,2014,31(1):60-64.
[10] Carrell DT,Liu L,Peterson CM. Sperm DNA fragmentation is increased in couples with unexplained recurrent pregnancy loss[J]. Arch Androl,2003,49(1):49-55.
[11] Sotolongo B,Lino E,Ward WS. Ability of hamster spermatozoa to digest their own DNA[J]. Biol Reprod,2003, 69(6):2029-2035.
[12] Van der Heijden GW,Ramos L,Baart EB,et al. Sperm-derived histones contribute to zygotic chromatin in humans[J]. BMC Dev Biol,2008,8:34.
[13] Yamauchi Y,Shaman JA,Ward WS. Topoisomerase II-mediated breaks in spermatozoa cause the specific degradation of paternal DNA in fertilized oocytes[J]. Biol Reprod,2007,76(4):666-672.
[14] Boe-hansen GB,Fedder J,Ersboll AK,et al. The sperm chromatin structure assay as a diagnostic tool in the human fertility clinic[J]. Hum Reprod,2006,21(6):1576-1582.
[15] Smith R,Kaune H,Parodi D,et al. Increased sperm DNA damage in patients with varicocele:Relationship with seminal oxidative stress[J]. Hum Reprod,2006,21(4):986-993.
[16] Rodrguez S,Goyanes V,Segrelles E,et al. Critically short telomeres are associated with sperm DNA fragmentation[J].Fertil Steril,2005,84(4):843-845.
[17] Rybar R,Markova P,Veznik Z,et al. Sperm chromatin integrity in young men with no experiences of infertility and men from idiopathic infertility couples[J]. Andrologia,2009,41(3):141-149.
[18] Giwercman A,Lindstedt L,Larsson M,et al. Sperm chromatin structure assay as an independent predictor of fertility in vivo:A case-control study[J]. Int J Androl,2010, 33(1):e221-e227.
[19] Robinson L,Gallos ID,Conner SJ,et al. The effect of sperm DNA fragmentation on miscarriage rates:A systematic review and meta-analysis[J]. Hum Reprod,2012,27(10):2908-2917.
[20] Zini A,Sigman M. Are tests of sperm DNA damage clinically useful[J]. Pros and Cons Journal of Andrology,2009, 30(3):219-229.
[21] Dugum M,Sandlow JI,Brannigan RE. Sperm DNA damage evaluation techniques[J]. Androl,2011,32(3):207-279.
[22] 仕治达,陶国振,孙林. Y染色体微缺失影响男性不育的研究进展[J]. 中国性科学,2014,23(7):75-78.
[23] 杜强,邹宝林,潘永峰,等. 中国男性不育患者CFTR基因M470V检测及其意义[J]. 中国性科学,2013,22(4):14-17.
(收稿日期:2015-01-27)
