塑化剂邻苯二甲酸二丁酯对秀丽隐杆线虫的氧化损伤作用研究
2016-02-17米生权
李 萍,米生权,赵 卓
(北京联合大学应用文理学院,北京 100191)
塑化剂邻苯二甲酸二丁酯对秀丽隐杆线虫的氧化损伤作用研究
李 萍,米生权,赵 卓*
(北京联合大学应用文理学院,北京 100191)
为了探讨塑化剂邻苯二甲酸二丁酯(DBP)对秀丽隐杆线虫的氧化损伤作用,将L2期秀丽隐杆线虫暴露于不同浓度DBP(32.5、131、522 mg/L)48 h后,检测秀丽隐杆线虫体内总超氧化物歧化酶(T-SOD)和过氧化氢酶(CAT)活力、谷胱甘肽(GSH)及丙二醛(MDA)含量的影响。实验结果表明,随着DBP浓度升高,线虫体内MDA含量升高。与对照组相比,522 mg/L DBP处理组秀丽隐杆线虫体内T-SOD和CAT酶活力、GSH含量均极显著降低(p<0.01)。结论:DBP对秀丽隐杆线虫产生氧化损伤作用。
秀丽隐杆线虫,邻苯二甲酸二丁酯,氧化损伤
邻苯二甲酸二丁酯(DBP)是一种重要的邻苯二甲酸酯类物质(PAEs),由于性能优良,工艺成熟,价格低廉[1],是工业上常用的增塑剂和软化剂,多用于轮胎、橡胶、粘合剂和电线外皮等工业生产[2],还用于人工瓣膜的润滑剂和皮肤软化剂等医疗领域。由于PAEs与高分子聚合物之间不以共价键形式结合,而仅仅以氢键或范德华力结合,彼此仍保持独立的化学结构[3],随着使用和时间的推移,DBP不断从塑料材料中逸出,污染空气、土壤、水源乃至食品,对人类健康造成潜在影响[4]。
DBP的主要毒性是生殖发育毒性,DBP染毒大鼠出现睾丸萎缩和附睾发育不全等雄性生殖系统损害;仔鼠体重增长变缓和睾丸损害等[5]。神经毒性方面,PAEs使雄性大鼠神经细胞核深染固缩,染色质凝结成团,胞浆泡沫样改变而呈现出一系列神经反射异常现象。同时DBP经口对啮齿类动物有肝肾毒性作用,主要是通过对其体内的过氧化脂质以及抗氧化酶活力的影响来实现[6]。Tseng等研究发现,DBP诱导秀丽隐杆线虫行为缺陷,包括身体弯曲,翻转频率及趋温性改变等[7]。目前有关DBP对哺乳动物、浮游生物、节肢动物和鱼类毒性作用的研究均有报道,但多集中在生殖毒性、胚胎毒性和发育毒性,本实验主要研究DBP对秀丽隐杆线虫的氧化损伤作用。
秀丽隐杆线虫(Caenorhabditiselegans,简称C.elegans)是多细胞无脊椎生物,具有结构简单、遗传背景清晰、进化高度保守、饲养方便、身体透明、生命周期短、基因可操纵性强等特点,是一种理想的毒理研究模式生物,已发展为应用行为学指标研究化学物神经毒性和生殖毒性的成熟模型[8-9]。由于增塑剂邻苯二甲酸酯类物质对秀丽隐杆线虫毒性效应的研究极少,本实验选择秀丽隐杆线虫为动物模型,研究不同浓度DBP对秀丽隐杆线虫体内总超氧化物歧化酶活力(SOD)等抗氧化酶和抗氧化剂的影响,从而探讨DBP对秀丽隐杆线虫的氧化损伤作用,为DBP在功能食品中的应用提供毒理学评价依据。
1 材料与方法
1.1 材料与仪器
大肠杆菌OP50与N2野生型C.elegans中国科学院生物物理研究所惠赠;邻苯二甲酸二丁酯(DBP 纯度:98.0%) 上海阿拉丁生化科技股份有限公司;二甲基亚砜(DMSO 纯度:99.0%) 北京鼎国昌盛生物技术有限责任公司;SOD试剂盒(测总)、(CAT)可见光试剂盒、(GSH)试剂盒、丙二醛(MDA)测试盒 南京建成生物工程研究所;BCA蛋白定量测定试剂盒 北京鼎国昌盛生物技术有限责任公司等。
XDS-1B型倒置显微镜 重庆重光实业有限公司;SW-CJ-1F型超净工作台 苏州净化设备有限公司;MLS-3780型高压蒸汽灭菌锅 日本三洋公司;MJ-250F-II型霉菌生化培养箱 上海一恒科技有限公司;5804R型高速离心机 德国Eppendorf公司;UV-2000型紫外可见分光光度计 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 样品板制备 无菌条件下,分别吸取0.3125、1.25和5 mL的邻苯二甲酸二丁酯于对应离心管中,依次加入DMSO使溶液终体积为10 mL,再依次从中取出0.2 mL样品溶液于200 mL灭菌融化的NGM培养基中,配制成DBP 浓度为32.5、131、522 mg/L的样品培养基(DMSO≤0.1%)。再取0.2 mL DMSO于200 mL灭菌融化的NGM培养基中,配制成0.1%DMSO对照组培养基。每个浓度组200 mL NGM培养基平均倒12个平板,其中每6个平板合并为1个平行,即分为2组平行。
在NGM培养基中涂布100μL OP50菌液,于20恒温培养48 h,待大肠杆菌长出薄薄一层后备用。
1.2.2 线虫转接培养 将同步化后L2期虫子切块,分别接种到制备好的含样品和DMSO的培养皿上,每个平板培养线虫150~200条左右,20恒温培养48 h[10]。
1.2.3 抗氧化酶、抗氧化剂和MDA指标的检测 取研磨管4支,标记为DMSO对照组、32.5、131、522 mg/L DBP浓度组,转移各样本组线虫至相应研磨管中,加入PBS使各研磨管中液体总体积为0.5 mL,加入研磨珠适量,组织研磨仪设置为1500 r/min,60 s运行时间,10 s间歇时间,进行3次研磨循环,最后在倒置显微镜下取20 μL虫液观察线虫是否研磨充分(研磨管和研磨珠提前在冰上预冷)。若线虫研磨充分,离心线虫研磨液,取上清,按照SOD试剂盒(测总)、(CAT)可见光试剂盒、(GSH)试剂盒、丙二醛(MDA)测试盒说明书进行测定,并且测定各样本组蛋白浓度。
1.2.4 数据处理 用SPSS 20.0处理数据,以ANOVA分析方法比较不同组间T-SOD和CAT酶活力、GSH和MDA含量,用OriginPro 9.1作图。
2 结果与分析
2.1 DBP处理对秀丽隐杆线虫T-SOD活力的影响
超氧化物歧化酶(SOD)是机体重要的抗氧化酶,负责清除机体超氧阴离子自由基,起到抗氧化保护作用。如图1所示,与对照组相比,131 mg/L DBP处理组秀丽隐杆线虫体内T-SOD酶活力提高(p<0.05),而522 mg/L DBP处理组T-SOD酶活力极显著降低(p<0.01)。该结果表明,低浓度131 mg/L DBP激活了线虫体内T-SOD酶活力,而高浓度522 mg/L DBP显著降低T-SOD酶活力,可能原因为低浓度131 mg/L DBP胁迫激活机体免疫机能,高浓度522 mg/L DBP胁迫产生的氧化压力超出了机体自我调节能力,使抗氧化酶活性降低,对机体产生氧化损伤。

图1 不同浓度DBP对线虫体内总超氧化物歧化酶活力的影响Fig.1 Effects of different concentrations of DBP on the activities of superoxide dismutase in C.elegans注:与DMSO对照组相比,* p<0.05,** p<0.01;图2~图4同。
2.2 DBP处理对秀丽隐杆线虫体内CAT活力的影响
过氧化氢酶(CAT)是机体重要的抗氧化酶,机体细胞呼吸过程中部分氧会被还原为H2O2,H202易被细胞内还原剂还原为强氧化剂·OH自由基,过氧化氢酶能消除由机体代谢产生的H202,阻断·OH的累积,防止机体氧化损伤。如图2所示,与DMSO处理组相比,32.5 mg/L和131 mg/L DBP处理组秀丽隐杆线虫体内CAT酶活力均极显著升高(p<0.01),而522 mg/L DBP处理组CAT酶活力极显著降低(p<0.01)。该结果表明,低浓度DBP显著激活了线虫体内CAT酶活力,而高浓度DBP显著降低CAT酶活力。

图2 不同浓度DBP对线虫体内过氧化氢酶活力的影响Fig.2 Effects of different concentrations of DBP on the activities of catalase in C.elegans

图3 不同浓度DBP对线虫体内谷胱甘肽含量的影响Fig.3 Effects of different concentrations of DBP on the contents of glutathione in C.elegans
2.3 DBP处理对秀丽隐杆线虫体内GSH含量的影响
还原型谷胱甘肽(GSH)是机体内重要的抗氧化剂和自由基清除剂,与自由基、重金属等结合,具有清除自由基、抗氧化、抗衰老等生理功能。如图3显示,与对照组相比,32.5 mg/L与131 mg/L DBP处理组GSH含量没有变化(p>0.05)。522 mg/L DBP处理组GSH含量极显著降低(p<0.01)。
2.4 DBP处理对秀丽隐杆线虫体内MDA含量的影响
丙二醛(MDA)是脂质氧化终产物,常用于评价机体脂质过氧化程度和氧化受损伤程度,MDA的含量越大则说明机体氧化损伤越严重。如图4所示,与对照组相比,522 mg/L DBP处理组秀丽隐杆线虫体内MDA含量极显著升高(p<0.01)。且随着DBP浓度逐渐增大,MDA含量逐渐升高。以上结果表明,DBP造成线虫细胞脂质过氧化损伤。
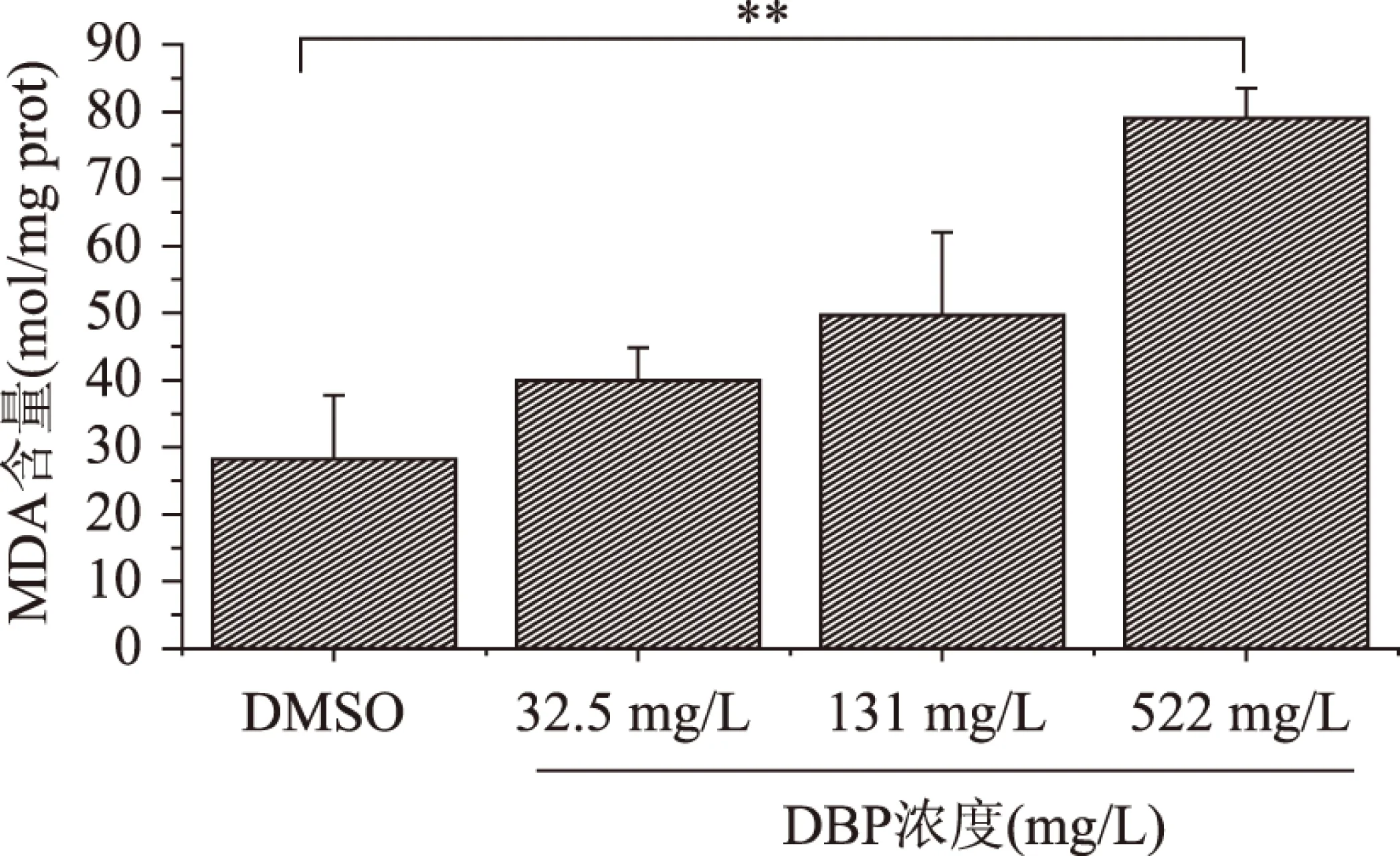
图4 不同浓度DBP对线虫体内氧化产物MDA含量的影响Fig.4 Effects of different concentrations of DBP on the contents of MDA in C.elegans
3 讨论与结论

本实验所测T-SOD和CAT为酶抗氧化系统,GSH为非酶抗氧化系统。当机体存在氧化应激压力时,抗氧化防御系统清除机体产生的活性氧,共同作用保护机体免受氧化损伤;但当抗氧化防御系统不能有效清除机体内过量的自由基时,则导致机体产生氧化损伤,使细胞膜发生脂质过氧化反应,产生大量的MDA[11]。
研究证实,DBP在生物体内代谢过程中可诱发活性氧自由基的大量产生,从而对生物体产生氧化损伤[12]。SOD和CAT是机体内重要的抗氧化酶,SOD将氧自由基转化成H2O2,CAT进一步分解H2O2为H2O。防止机体氧化损伤。本实验研究表明,低浓度DBP(131 mg/L)激活T-SOD酶活力,低浓度DBP(32.5 mg/L和131 mg/L)激活CAT酶活力,高浓度DBP(522 mg/L)显著降低T-SOD和CAT酶活力。低浓度DBP对T-SOD和CAT酶活力影响不同,这可能与两种酶的受影响模式不同有关,SOD歧化超氧阴离子产生的H202不完全由CAT还原,且细胞色素P450氧化酶激活也可产生H202。王艳[13]研究了几种邻苯二甲酸酯对蚯蚓的分子毒性机理,结果表明DBP单一污染对蚯蚓体内CAT酶活性的影响为低浓度激活,随着DBP浓度的增加,CAT活性逐渐降低。蔡立哲等[14]研究PAHs对菲律宾蛤仔抗氧化酶活性的影响时发现,PAHs对SOD和CAT活性的影响均表现为先诱导后抑制。Pan等[15]实验过程中发现,低浓度PAHs胁迫下栉孔扇贝血淋巴SOD活性持续上升,高浓度胁迫下SOD活性表现为先升后降。其可能原因为低浓度DBP胁迫激活机体免疫机能,高浓度DBP胁迫产生的氧化压力超出了机体自我调节能力,使抗氧化酶活性降低,对机体产生氧化损伤。
GSH是机体重要的抗氧化剂,本实验研究表明,522 mg/L DBP处理组秀丽隐杆线虫体内GSH含量显著降低。秦文娟[16]研究邻苯二甲酸二丁酯对雄性小鼠生殖毒性及氧化损伤作用发现,DBP能使肝脏和睾丸组织受到损伤,引起GSH含量降低,诱导肝脏组织发生脂质过氧化作用,产生MDA。
MDA是脂质过氧化的最终产物,是反映机体脂质过氧化程度和氧化受损伤程度的重要指标[17]。本实验研究表明,随着DBP浓度逐渐增大,无论秀丽隐杆线虫体内SOD和CAT活性被激活还是被抑制,MDA含量逐渐升高,DBP暴露处理可诱导机体细胞脂质过氧化。蔡凤云[18]等研究邻苯二甲酸二丁酯对体外大鼠肝脏细胞的氧化损伤作用,结果表明随着DBP染毒浓度的升高,大鼠肝脏细胞的MDA含量逐渐上升。
综上所述,DBP具有造成生物体氧化损伤的作用,DBP做为塑料工业的主要增塑剂和软化剂,是一种已被确定的环境内分泌干扰物,食品中含有DBP将对食用者造成严重氧化应激负荷,从而引发多种神经疾病,如记忆功能下降[19],神经反射降低[20]等,尤其对儿童健康危害更加严重,使幼儿智力下降,发育畸形[21]等,因此食品中DBP的危害及安全标准应该给予足够重视,本实验以抗氧化酶(SOD和CAT)、抗氧化物质(GSH)及氧化产物(MDA)等指标研究DBP的氧化损伤作用,为DBP在功能食品中的应用提供毒理学评价依据。
[1]Schettler T. Human exposure to phthalates via consumer products[J]. Int J Androl,2006,29(1):134-139.
[2]Wormuth M,Scheringer M,Vollenweider M,et al. What are the sources of exposure to eight frequently used phthalic acid esters in Europeans[J]. Risk Anal,2006,26(3):803-824.
[3]王立鑫,杨旭. 邻苯二甲酸酯毒性及健康效应研究进展[J]. 环境与健康杂志,2010,27(3):276-281. .
[4]郭永梅. 邻苯二甲酸酯的毒性及相关限制法规[J]. 广州化学,2012,37(2):75-79.
[5]常兵,刘德瑜,梁玉香,等. 邻苯二甲酸二丁酯对青春期雄性大鼠的生殖毒性研究[J]. 中国自然医学杂志,2007,9(3):164-168.
[6]陈洪涛. 邻苯二甲酸酯毒理学研究进展[J]. 食品与机械,2012,28(5):251-254.
[7]Tseng IL,Yang YF,Yu CW,et al. Phthalates induce neurotoxicity affecting locomotor and thermotactic behaviors and AFD neurons through oxidative stress in Caenorhabditis elegans[J]. PLoS One,2013,8(12):e82657.
[8]Rankin CH. From gene to identified neuron to behaviour in Caenorhabditis elegans[J]. Nat Rev Genet,2002,3(8):622-630.
[9]Leung MCK,Williams PL,Benedetto AAC,et al. Caenorhabditis elegans:an emerging model in biomedical and environmental toxicology[J]. Toxicol Sci,2008,106(1):17-19.
[10]屈长青,徐林丽,陆娟,等. 罗勒水提物对秀丽隐杆线虫
脂肪沉积的影响[J]. 中国生化药物杂志,2012,33(2):165-166.
[11]夏世钧,吴中亮. 分子毒理学基础[M]. 武汉:湖北科学技术出版社,2001.
[12]秦洁芳,陈海刚,蔡文贵,等. 邻苯二甲酸二丁酯对翡翠贻贝抗氧化酶及脂质过氧化水平的影响[J]. 应用生态学报,2011,22(7):1878-1884.
[13]王艳. 几种邻苯二甲酸酯对蚯蚓(Eisenia fetida)的分子毒性机理[D].杭州:浙江工业大学,2013:5-10.
[14]蔡立哲,马丽,高阳,等. 蒽、菲、芘、混合液对菲律宾蛤仔抗氧化酶活性的影响[J]. 海洋科学,2005,29(8):47-52.
[15]Pan LQ,Ren J,Liu J. Responses of antioxidant systems and LPO level to benzo(a)pyrene and benzo(k)fluoranthene in the haemolymph of the scallop Chlamys ferrari[J]. Environ Pollut,2006,141(3):443-451.
[16]秦文娟. 邻苯二甲酸二丁醋对雄性小鼠生殖毒性及氧化损伤作用的研究[D]. 武汉:华中师范大学,2011:15-20.
[17]Ourique GM,Finamor IA,Saccol EM,et al. Resveratrol improves sperm motility,prevents lipid peroxidation and enhances antioxidant defences in the testes of hyperthyroid rats[J]. Reproductive Toxicology,2013,37:31-39.
[18]蔡风云,王萌,王婧,等. 邻苯二甲酸二丁酯对体外大鼠肝脏细胞的氧化损伤作用[J]. 公共卫生与预防医学,2009,20(4):4-7.
[19]Min A,Liu F,Yang X,et al. Benzyl butyl phthalate exposure impairs learning and memory and attenuates neurotransmission and CREB phosphorylation in mice[J]. Food Chem Toxicol,2014,71:81-89.
[20]Yolton K,Xu Y,Strauss D,et al. Prenatal exposure to bisphenol A and phthalates and infant neurobehavior[J]. Neurotoxicol Teratol,2011,33(5):558-566.
[21]Cho SC,Bhang SY,Hong YC,et al. Relationship between environmental phthalate exposure and the intelligence of school-age children[J]. Environ Health Perspect,2010,118(7):1027-1032.
2
Study on the oxidative damage effects of dibutyl phthalate inCaenorhabditiselegans
LI Ping,MI Sheng-quan,ZHAO Zhuo*
(College of Applied Arts And Science of Beijing Union University,Beijing 100191,China)
The aim of this article was to investigate the oxidative damage effect of dibutyl phthalate(DBP)inC.elegans.C.elegansin L2period were expoused to the different concentrations of DBP(32.5,131 and 522 mg/L)for 48 h. Then the activities of T-SOD,CAT and the contents of GSH,MDA inC.eleganswere measured. Results:With increasing DBP concentration,the contents of MDA increased. Compared with the control group,the activities of T-SOD and CAT and the contents of GSH were significantly decreased in 522 mg/L DBP treatment group(p<0.01). These results suggested that DBP could induce the oxidative damage inC.elegans.
Caenorhabditiselegans;dibutyl phthalate;oxidative damage
2016-07-20
李萍(1990-),女,在读硕士研究生,研究方向:营养与慢性病,E-mail:1114176776@qq.com。
*通讯作者:赵卓(1963-), 男,博士,教授, 研究方向: 营养与慢性病, E-mail:zhaozhuo@buu.edu.cn。
北京市教委研究项目资助(SQKM201311417014);北京市属高等学校人才强教计划资助项目(PHR201107150)。
TS
A
1002-0306(2016)24-0000-00
10.13386/j.issn1002-0306.2016.24.000
