体外冲击波治疗早中期膝关节骨性关节炎效果观察及其机制
2016-02-15席立成李宏宇赵子星郁少林刘搏宇田文
席立成,李宏宇,赵子星,郁少林,刘搏宇,田文
(广西壮族自治区人民医院,南宁530021)
体外冲击波治疗早中期膝关节骨性关节炎效果观察及其机制
席立成,李宏宇,赵子星,郁少林,刘搏宇,田文
(广西壮族自治区人民医院,南宁530021)
目的 探讨体外冲击波(ESW)治疗早中期膝关节骨性关节炎(KOA)的临床疗效及其可能的机制。方法选择65例早中期KOA患者,与患者说明治疗方案后按患者意愿分为观察组33例和对照组32例。观察组采用ESW治疗(1次/周);对照组口服塞来昔布胶囊,200 mg/次,1次/d;两组疗程均为4周。两组分别于治疗前、治疗后即刻及治疗后2、6个月行疼痛视觉模拟评分(VAS)评价疼痛情况,采用 WOMAC骨性关节炎指数评分(简称WOMAC评分)评价膝关节功能,采用ELISA法检测关节液IL-1β、IL-10和NO。结果与治疗前比较,观察组治疗后即刻、治疗后2个月、治疗后6个月VAS及WOMAC评分均降低,对照组治疗后即刻、治疗后2个月VAS及WOMAC评分均降低(P均<0.05)。观察组治疗后2、6个月VAS及WOMAC评分均低于对照组(P均<0.05)。与治疗前比较,观察组治疗后即刻、治疗后2个月、治疗后6个月关节液IL-1β和NO水平均降低,对照组治疗后即刻、治疗后2个月关节液IL-1β和NO水平均降低(P均<0.05)。观察组治疗后2、6个月关节液IL-1β和NO水平均低于对照组,治疗后即刻及治疗后2个月关节液IL-10水平均高于治疗前及对照组治疗后(P均<0.05)。结论ESW治疗早中期KOA疗效较好、作用时间长;降低关节液IL-1β、NO水平及升高IL-10水平可能是其作用机制。
骨性关节炎;中早期;膝关节;体外冲击波;白细胞介素1β;白细胞介素10;一氧化氮
骨性关节炎(OA)是由于多种因素引起的关节软骨病变,继发关节间隙狭窄,从而引起关节功能障碍的一种疾病,以膝关节多发。OA的治疗是目前临床的一大难题,除晚期行人工关节置换外,其早中期治疗尚缺乏有效的方法。体外冲击波(ESW)具有刺激关节软骨修复的作用,能够调节关节液中致炎因子和抑炎因子的表达[1],以往多应用于动物实验中,相关的临床研究报道较少。本研究观察ESW治疗早中期膝关节骨性关节炎(KOA)的临床疗效,并探讨其可能的机制。
1 资料与方法
1.1 临床资料 选择2013年12月~2015年2月我院收治的KOA患者65例,男30例、女35例,年龄(68.07±6.74)岁,病程(64.11±30.94)个月;Kellgren-Lawrence(K-L)分期为Ⅰ期28例,Ⅱ期37例。纳入标准:①符合《骨关节炎诊治指南(2007年版)》中的KOA诊断标准;②K-L分期为Ⅰ~Ⅱ期;③近3个月内未服用药物或使用其他方式治疗;④心、肺、肝、肾功能良好,能耐受ESW治疗;⑤年龄50~75岁。排除标准:① K-L分期为0期或Ⅳ期;②患肢有血管神经疾病史或有严重膝关节内外翻畸形,或合并严重骨质疏松症;③类风湿性关节炎、关节结核、风湿性关节炎、关节感染或局部有伤口;④合并有心脑血管、肺、肾或造血系统等系统性疾病,或安装有心脏起搏器;⑤对非甾体类药物过敏;⑥既往有消化道溃疡或出血史。与患者说明治疗方案后按患者意愿分为观察组33例和对照组32例。两组性别、年龄等一般资料均具有可比性。本研究通过医院伦理委员会审核,患者均知情同意。
1.2 治疗方法 观察组于患处确定和标记痛点,包括患膝关节局部压痛点、膝关节屈伸活动痛点;以痛点作为冲击点,非麻醉状态下行ESW治疗:调整冲击波碎石机(瑞士storz medical ag公司生产)能流密度为0.2 mJ/mm2、冲击频率为8 Hz、治疗压力为3 bar,每个部位冲击2 000次,1次/周,共治疗4周。对照组常规口服塞来昔布胶囊200 mg/次,1次/d,共治疗4周。
1.3 相关指标观察
1.3.1 疼痛和关节功能情况 两组分别于治疗前、治疗后即刻及治疗后2、6个月,采用疼痛视觉模拟评分(VAS)评价疼痛情况,总分10分,评分越高说明疼痛越严重;采用 WOMAC骨性关节炎指数评分(简称WOMAC评分)评价膝关节功能情况,总分96分,评分越高说明膝关节功能越差。
1.3.2 关节液IL-1β、IL-10及NO水平 两组分别于治疗前、治疗后即刻及治疗后2、6个月抽取患侧膝关节液1 mL,离心后取上清液,置于-20 ℃冰箱中待检。采用ELISA法检测关节液IL-1β、IL-10和NO,严格按照试剂盒说明书操作(试剂盒均购自武汉博士德生物工程有限公司)。

2 结果
患者均完成治疗,治疗6个月后观察组和对照组分别有1、2例患者因失访而剔除研究,最终观察组和对照组分别纳入32、30例。
2.1 两组治疗前后VAS及WOMAC评分比较 与治疗前比较,观察组治疗后即刻、治疗后2个月、治疗后6个月VAS及WOMAC评分均降低,对照组治疗后即刻、治疗后2个月VAS及WOMAC评分均降低(P均<0.05);对照组治疗后6个月VAS及WOMAC评分与治疗前比较差异均无统计学意义(P均>0.05)。观察组治疗后2、6个月VAS及WOMAC评分均低于对照组(P均<0.05)。见表1。
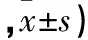
表1 两组治疗前后VAS及WOMAC评分比较(分
注:与同组治疗前比较,*P<0.05;与对照组同时间点比较,#P<0.05。
2.2 两组治疗前后关节液IL-1β、IL-10和NO水平比较 与治疗前比较,观察组治疗后即刻、治疗后2个月、治疗后6个月关节液IL-1β和NO水平均降低,对照组治疗后即刻、治疗后2个月关节液IL-1β和NO水平均降低(P均<0.05)。观察组治疗后2、6个月关节液IL-1β和NO水平均低于对照组,治疗后即刻及治疗后2个月关节液IL-10水平均高于治疗前及对照组治疗后(P均<0.05)。对照组治疗前后关节液IL-10水平比较差异均无统计学意义(P均>0.05)。见表2。
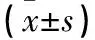
表2 两组治疗前后关节液IL-1β、IL-10及NO水平比较
注:与同组治疗前比较,*P<0.05;与对照组同时间点比较,#P<0.05。
3 讨论
ESW是一种非侵入性治疗方法,最初被用于治疗泌尿系结石,随后逐步扩展到骨骼疾病的治疗,并展现出良好的应用前景[2]。2005年国外学者将ESW用于治疗马OA模型,发现马患侧关节功能得到明显改善[3],从而开创了ESW治疗OA的先河。进一步研究发现,ESW能有效降低末梢神经敏感性,减少P物质等疼痛因子的释放,抑制疼痛信号在神经细胞的传递[4],对多种骨骼疾病具有很好的镇痛效应[5]。OA的早期病理改变主要是软骨表面的机械磨损,而ESW能改善软骨代谢和软骨细胞的增殖分化,促进软骨组织修复[6]。此外,ESW对局部骨组织的直接作用可以造成微骨折,改变局部生物学环境,促进大量具有成骨作用的细胞因子释放,有利于软骨下骨重塑,增加关节的承重能力[7]。本研究结果显示,与治疗前比较,观察组治疗后即刻、治疗后2个月、治疗后6个月VAS及WOMAC评分均明显降低,对照组治疗后即刻、治疗后2个月上述指标均降低,但观察组治疗后2、6个月上述指标均明显低于对照组,说明ESW治疗KOA的远期疗效较好。
OA的具体发病机制目前尚不十分明确,主要由生物和力学因素共同导致的软骨下骨、软骨细胞和细胞外基质三者的降解和合成失衡所致[8]。细胞因子与炎性介质在OA的发生、发展中具有重要作用,目前以IL-1β相关研究最多。IL-1β是一种广泛存在于组织细胞中的具有强大致炎作用的炎性因子,是促使OA关节软骨破坏和软骨基质降解最为关键的始动因子,在OA炎症介导过程中起关键作用[9,10]。IL-1β能通过NF-κB通路促进金属基质蛋白酶的合成与释放,加速蛋白聚糖及Ⅱ型胶原的降解,破坏软骨基质[11]。软骨细胞在受到 IL-1β等细胞因子刺激下,能诱导一氧化氮合酶(iNOS)表达,合成高水平NO,关节液中NO水平是判断 OA 关节软骨损害的重要指标之一[12]。在OA疾病的进程中,高水平NO使细胞内外发生强烈的氧化应激反应,抑制软骨细胞增殖和细胞外基质的合成,促进软骨细胞凋亡,NO水平与炎症的发展和转归关系密切[13]。IL-10是近年来发现的一个具有炎性抑制作用的细胞因子,对维持局部微环境的稳定具有重要意义,其可以通过反馈作用抑制 IL-1β、TNF-α等炎症递质的分泌[14];能阻断NF-κB活性,参与对JAK-STAT信号通路的调控,抑制促炎细胞因子的合成;还能抑制软骨降解蛋白酶和 iNOS 表达,从而抑制软骨破坏,对OA患者软骨和滑膜起到保护作用[15,16]。本研究结果显示,与治疗前比较,观察组治疗后即刻、治疗后2个月、治疗后6个月关节液IL-1β和NO水平均明显降低,对照组治疗后即刻、治疗后2个月关节液IL-1β和NO水平均明显降低,但观察组治疗后2、6个月关节液IL-1β和NO水平均明显低于对照组,说明ESW和塞来昔布治疗均能下调关节液IL-1β、NO水平,而ESW的远期调控效果更明显。本研究对照组治疗前后关节液IL-10水平比较差异均无统计学意义,可能与塞来昔布治疗OA可能主要是通过抑制NF-κB、JNK通路,从而抑制IL-1β、NO等炎性介质的产生有关[17,18]。本研究观察组治疗后即刻及治疗后2个月关节液IL-10水平均明显高于对照组,提示IL-10能反馈性抑制 IL-1β等炎症递质的分泌和iNOS 的表达;上调IL-10等抑炎因子表达,以抑制IL-1β和NO等致炎因子的分泌,可能是ESW治疗OA的机制之一。
[1] Teunis T, Beekhuizen M, Van Osch GV, et al. Soluble mediators in posttraumatic wrist and primary knee osteoarthritis[J]. Arch Bone Jt Surg, 2014,2(3):146-150.
[2] Wang CJ. Extracorporeal shockwave therapy in musculoskeletal disorders[J]. J Orthop Surg Res, 2012(7):11.
[3] Revenaugh MS. Extracorporeal shock wave therapy for treatment of osteoarthritis in the horse: clinical applications[J]. Vet Clin North Am Equine Pract, 2005,21(3):609-625.
[4] Kawcak CE, Frisbie DD, McIlwraith CW. Effects of extracorporeal shock wave therapy and polysulfated glycosaminoglycan treatment on subchondral bone, serum biomarkers, and synovial fluid biomarkers in horses with induced osteoarthritis[J]. Am J Vet Res, 2011,72(6):772-779.
[5] Gollwitzer H, Saxena A, DiDomenico LA, et al. Clinically rele-
vant effectiveness of focused extracorporeal shock wave therapy in the treatment of chronic plantar fasciitis: a randomized, controlled multicenter study[J]. J Bone Joint Surg Am, 2015,97(9):701-708.
[6] Wang CJ, Sun YC, Wong T, et al. Extracorporeal shockwave therapy shows time-dependent chondroprotective effects in osteoarthritis of the knee in rats[J]. J Surg Res, 2012,178(1):196-205.
[7] Lyon R, Liu XC, Kubin M, et al. Does extracorporeal shock wave therapy enhance healing of osteochondritis dissecans of the rabbit knee: a pilot study[J]. Clin Orthop Relat Res, 2013,471(4):1159-1165.
[8] Berenbaum F. New horizons and perspectives in the treatment of osteoarthritis[J]. Arthritis Res Ther, 2008(10):S1.
[9] Santangelo KS, Nuovo GJ, Bertone AL. In vivo reduction or blockade of interleukin-1β in primary osteoarthritis influences expression of mediators implicated in pathogenesis[J]. Osteoarthritis Cartilage, 2012,20(12):1610-1618.
[10] Schepens SL, Kratz AL, Murphy SL. Fatigability in osteoarthritis: effects of an activity bout on subsequent symptoms and activity[J]. J Gerontol A Biol Sci Med Sci, 2012,67(10):1114-1120.
[11] Wang X, Li F, Fan C, et al. Effects and relationship of ERK1 and ERK2 in interleukin-1β-induced alterations in MMP3, MMP13, type Ⅱ collagen and aggrecan expression in human chondrocytes[J]. Int J Mol Med, 2011,27(4):583-589.
[12] EI Mansouri FE, Chabane N, Zayed N, et al. Contribution of H3K4 methylation by SET-1A to interleukin-1-induced cyclooxygenase 2 and inducible nitric oxide synthase expression in human osteoarthritis chondrocytes[J]. Arthritis Rheum, 2011,63(1):168-179.
[13] Tao R, Wang S, Xia X, et al. Pyrroloquinoline quinone slows down the progression of osteoarthritis by inhibiting nitric oxide production and metalloproteinase synthesis[J]. Inflammation, 2015,38(4):1546-1555.
[14] Paul A, Bishayee K, Ghosh S, et al. Chelidonine isolated from ethanolic extract of Chelidonium majus promotes apoptosis in HeLa cells through p38-p53 and PI3k/AKT signalling pathway[J]. Zhong Xi Yi Jie He Xue Bao, 2012,10(9):1025-1038.
[15] Schulze-Tanzil G, Zreiqat H, Sabat R, et al. Interleukin-10 and articular cartilage: experimental therapeutical approaches in cartilage disorders[J]. Curr Gene Ther, 2009,9(4):306-315.
[16] Rojas-Ortega M, Cruz R, Vega-López MA, et al. Exercise modulates the expression of IL-1β and IL-10 in the articular cartilage of normal andosteoarthritis-induced rats[J]. Pathol Res Pract, 2015,211(6):435-443.
[17] Tsutsumi R, Ito H, Hiramitsu T, et al. Celecoxib inhibits production of MMP and NO via down-regulation of NF kappaB and JNK in a PGE2 independent manner in human articular chondrocytes[J]. Rheumatol Int, 2008,28(8):727-736.
[18] Berenbaum F. Signaling transduction: target in osteoarthritis[J]. Curr Opin Rheumatol, 2004,16(5):616-622.
广西科学研究与技术开发计划项目(桂科攻1598012-10);广西医疗卫生适宜技术研究与开发项目( S201313-05)。
李宏宇(E-mail: lihongyu36@sohu.com)
10.3969/j.issn.1002-266X.2016.48.020
R684.3
B
1002-266X(2016)48-0060-03
2016-05-04)
