抗IL-17A单克隆抗体对系统性硬化病小鼠纤维化病变的抑制作用及其机制
2016-02-15王旭黄舒柠雷玲
王旭,黄舒柠,雷玲
(广西医科大学第一附属医院,南宁530021)
抗IL-17A单克隆抗体对系统性硬化病小鼠纤维化病变的抑制作用及其机制
王旭,黄舒柠,雷玲
(广西医科大学第一附属医院,南宁530021)
目的 观察抗白介素17A(IL-17A)单克隆抗体对系统性硬化病(SSc)小鼠纤维化病变的影响,并探讨其相关机制。方法将24只小鼠随机分为正常对照组、模型组、抗体组、同型对照组,每组6只。模型组于背部中央区域皮下注射博来霉素(BLM),抗体组注射BLM+抗IL-17A单克隆抗体,同型对照组注射BLM+同型对照抗体,正常对照组注射磷酸盐缓冲液,共3周。取其皮肤和肺组织,观察病理变化;测量皮肤厚度,进行皮肤炎症评分和肺炎症、纤维化评分;采用实时荧光定量PCR法检测皮肤和肺组织IL-17A、转化生长因子β1(TGF-β1)、Ⅰ型胶原(CollagenⅠ)mRNA相对表达量。结果正常对照组皮肤无明显炎症细胞浸润及胶原增生,肺泡结构正常。模型组真皮层和肺泡间隔明显增厚,皮肤胶原明显增生;肺间质内有大量炎症细胞浸润,纤维组织增生,可见胶原束形成。同型对照组皮肤和肺组织病理改变与模型组相似。抗体组皮肤增厚,皮肤和肺组织炎症细胞浸润,肺纤维组织增生,但程度均轻于模型组和同型对照组。与正常对照组比较,模型组、抗体组、同型对照组皮肤厚度和炎症评分、肺炎症和纤维化评分均升高,皮肤和肺组织IL-17A、TGF-β1、CollagenⅠ mRNA相对表达量均升高,但模型组和同型对照组均高于抗体组(P<0.05或<0.01)。模型组和同型对照组上述指标比较差异均无统计学意义(P均>0.05)。结论抗IL-17A单克隆抗体可抑制SSc小鼠的皮肤和肺纤维化病变;减少TGF-β1和CollagenⅠ生成可能是其作用机制。
系统性硬化病;抗白介素17A单克隆抗体;转化生长因子β1;Ⅰ型胶原;肺纤维化;小鼠
系统性硬化病(SSc)是一种以组织纤维化,血管病变及免疫调节异常为主要特点的慢性结缔组织
疾病,发病率为(50~300)/100万[1]。SSc的发病机制尚不明确,普遍认为可能与血管病变、免疫系统激活等有关,目前临床上尚无逆转纤维化的有效措施。免疫细胞特别是T淋巴细胞在SSc发病中发挥重要作用,Th17细胞为近年发现的一种辅助性T细胞,白介素17A(IL-17A)为其主要的效应因子,具有促炎作用。多项研究显示,SSc患者Th17细胞比例和IL-17A表达升高,IL-17A能够促进SSc小鼠皮肤成纤维细胞增殖和胶原合成,并参与SSc的免疫炎症反应及纤维化病变[2~5]。但目前关于IL-17A是否具有促纤维化作用尚存有一定争议[3,6]。为此我们于2015年1~6月进行了如下研究。
1 材料与方法
1.1 材料 动物:雌性BALB/c小鼠24只,SPF级,6~8周龄,体质量18~20 g,由广西医科大学实验动物中心提供。试剂及仪器:注射用博来霉素(BLM,15 mg/支)购于日本化药株式会社;小鼠抗IL-17A单克隆抗体、同型对照兔IgG2a均购于美国R&D公司;TRIzol试剂、逆转录试剂盒、荧光定量PCR试剂及引物均购于日本TaKaRa公司。
1.2 模型制备及分组处理 将24只小鼠随机分为正常对照组、模型组、抗体组、同型对照组,每组6只。各组均采用10%硫化钠溶液脱去小鼠背部中央区域毛发(面积约1.5 cm×1.5 cm),模型组、抗体组、同型对照组均参照文献[5]建立SSc模型:以4.5无菌注射针头于小鼠背部中央区皮下注射1 g/mL BLM溶液0.1 mL,1次/d,连续3周。抗体组、同型对照组分别于建模第4、10、16天腹腔注射抗IL-17A单克隆抗体0.1 mL(200 μg/只)、同型对照兔IgG2a 0.1 mL(200 μg/只)。正常对照组于背部中央区皮下注射磷酸盐缓冲液0.1 mL,1次/d,连续3周。
1.3 标本采集 皮肤标本:各组处理3周后处死小鼠,剪下背部无毛皮肤,分为两份。一份置于10%中性甲醛溶液固定、脱水、石蜡包埋,4 μm厚度连续切片;另一份于-80 ℃保存待测。肺组织标本:打开小鼠胸腔,取出右肺后参照上法制成石蜡标本,4 μm厚度连续切片;取出左肺迅速移至-80 ℃冰箱保存。
1.4 相关指标观察
1.4.1 皮肤和肺组织病理变化 取1.3中制备的皮肤及肺组织石蜡切片,分别进行HE染色(观察皮肤和肺部的炎症)及Masson染色(观察皮肤和肺部的胶原沉积)。HE染色:切片脱蜡至水,苏木素浸染,1%盐酸乙醇分化,0.5%伊红溶液复染,脱水透明封片。Masson染色:切片脱蜡至水,苏木素染5~10 min,1%盐酸乙醇分化,流水冲洗数分钟;丽春红酸性品红染液染5~10 min,流水稍冲洗;1%磷钼酸溶液处理5 min,亮绿液复染5 min,1%冰醋酸处理1 min,脱水透明封片。将HE染色及Masson染色后的切片分别置于40、200倍光镜下,观察皮肤和肺组织病理变化。
1.4.2 皮肤厚度及炎症评分 取1.4.1中经HE染色后的皮肤组织切片,采用病理图像分析仪系统软件测量皮肤厚度。参照Yamamoto等[7]的方法对皮肤炎症情况进行半定量评分,没有炎症为0分、少许炎症为1分、轻度炎症为2分、中度炎症为3分、重度炎症为4分。由2位病理科医生采取盲法进行阅片。
1.4.3 肺炎症及纤维化评分 取1.4.1中经HE染色后的肺组织切片,参照Serena等[8]的方法行肺组织炎症评分,计数每个视野中肺间质、血管旁及支气管旁区域的白细胞数,其中散落的白细胞为0分、<15个为1分、15~50个为2分、>50个为3分。取1.4.1中经Masson染色后的肺组织切片,随机选择切片区域,于200倍光镜下按照Ashcroft半定量评分[9]评价其纤维化情况,总分为8分,正常肺组织为0分,全部区域纤维性闭塞为8分。由2位病理科医生采取盲法进行阅片。
1.4.4 皮肤和肺组织IL-17A、转化生长因子β1(TGF-β1)、Ⅰ型胶原(CollagenⅠ)mRNA相对表达量 采用实时荧光定量PCR法。取冻存的小鼠左肺组织、皮肤组织各100 mg,TRIzol试剂提取总RNA,按照逆转录盒操作说明,将总RNA逆转录为cDNA。采用SYBR绿色核酸染料进行荧光定量PCR检测,以β-actin为内参物。IL-17A:上游引物:5′-GGAAAGCTGGACCACCACA-3′,下游引物:5′-CACACCCACCAGCATCTTCTC-3′;反应条件:95 ℃、30 s,95 ℃、5 s,60 ℃、31 s,40个循环。TGF-β1:上游引物:5′-GTGTGGAGCAACATGTGGAACTCTA-3′,下游引物:5′-TTGGTTCAGCCACTGCCGTA-3′;反应条件:94 ℃、3 min,94 ℃、20 s,54℃、30 s,72 ℃、31 s,40个循环。CollagenⅠ:上游引物:5′-GACATGTTCAGCTTTGTGGACCTC-3′,下游引物:5′-GGGACCCTTAGGCCATTGTGTA-3′;反应条件:94 ℃、3 min,94 ℃、18 s, 58 ℃、30 s,72 ℃、31 s,40个循环。β-actin:上游引物:5′-ATCCACGAAACTACCTTCAA-3′,下游引物:5′-ATCCACACGGAGTACTTGC-3′;反应条件:94 ℃、3 min,94 ℃、20 s,57.5 ℃、30 s,72 ℃、31 s,40个循环。各样本均设3个复孔,以2-ΔΔCT法计算皮肤和肺组织IL-17A、TGF-β1、CollagenⅠ mRNA相对表达量。

2 结果
2.1 皮肤和肺组织病理变化 皮肤组织切片HE染色及Masson染色显示,正常对照组无明显炎症细胞浸润及胶原增生。模型组真皮层明显增厚,附属器萎缩,可见炎症细胞浸润,胶原明显增生。同型对照组皮肤相关病理改变与模型组相似。抗体组可见皮肤增厚及炎症细胞浸润,但程度轻于模型组和同型对照组。肺组织切片HE染色和Masson染色显示,正常对照组肺泡结构正常,无明显炎症及纤维化改变。模型组肺泡间隔增厚,肺间质内有大量炎症细胞浸润,肺泡结构被破坏,纤维组织增生,可见胶原束形成。同型对照组肺组织病理改变与模型组相似。抗体组可见炎症细胞及纤维组织增生,但轻于模型组和同型对照组,部分肺泡结构尚存在。
2.2 皮肤厚度及炎症评分 与正常对照组比较,模型组、抗体组和同型对照组皮肤厚度和炎症评分均升高,但模型组和同型对照组均高于抗体组(P均<0.01)。模型组和同型对照组皮肤厚度和炎症评分比较差异均无统计学意义(P均>0.05)。见表1。
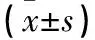
表1 各组皮肤厚度及炎症评分比较
注:与正常对照组比较,*P<0.01;与模型组比较,#P<0.01;与抗体组比较,△P<0.01。
2.3 肺炎症及纤维化评分 与正常对照组比较,模型组、抗体组和同型对照组肺炎症及纤维化评分均升高,但模型组和同型对照组均高于抗体组(P均<0.01)。模型组和同型对照组肺炎症及纤维化评分比较差异均无统计学意义(P均>0.05)。见表2。
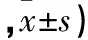
表2 各组肺炎症及纤维化评分比较(分
注:与正常对照组比较,*P<0.01;与模型组比较,#P<0.01;与抗体组比较,△P<0.01。
2.4 皮肤和肺组织IL-17A、TGF-β1、CollagenⅠ mRNA相对表达量 与正常对照组比较,模型组、抗体组、同型对照组皮肤和肺组织IL-17A、TGF-β1、CollagenⅠ mRNA相对表达量均升高,但模型组和同型对照组均高于抗体组(P<0.05或<0.01)。模型组、同型对照组皮肤和肺组织IL-17A、TGF-β1、CollagenⅠ mRNA相对表达量比较差异均无统计学意义(P均>0.05)。见表3、4。
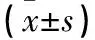
表3 各组皮肤组织IL-17A、TGF-β1、CollagenⅠ mRNA相对表达量比较
注:与正常对照组比较,*P<0.01;与模型组比较,#P<0.05,△P<0.01;与抗体组比较,▲P<0.05,○P<0.01。
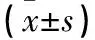
表4 各组肺组织IL-17A、TGF-β1、CollagenⅠ mRNA相对表达量比较
注:与正常对照组比较,*P<0.01,▲P<0.05;与模型组比较,#P<0.05;与抗体组比较,△P<0.05。
3 讨论
SSc是一种以炎症反应、血管病变、皮肤及内脏纤维化为主要病理特点的疾病,其中炎症反应及血管病变为早期SSc的主要病理改变,纤维化为晚期SSc的主要病理改变。SSc早期组织纤维化成分主要为弹性纤维,后期主要为CollagenⅠ。BLM诱导的SSc小鼠模型能够很好地反映皮肤及肺组织炎症、纤维化等病理改变,为目前应用最广泛的SSc建模方法[10]。本研究结果显示,与正常对照组比较,模型组皮肤增厚、肺组织结构破坏,皮肤和肺组织可见胶原纤维沉积及炎症细胞浸润,呈现出典型的SSc纤维化及炎症病理改变。
IL-17A主要有促炎作用,促纤维化作用尚未完全明确。国外研究发现,SSc小鼠皮肤IL-17A表达升高,与皮肤的炎症及纤维化程度呈正相关;IL-17A能够增加SSc小鼠皮肤成纤维细胞中TGF-β1、结缔组织生长因子(CTGF)等促纤维化因子的表达及胶原合成[2]。肺间质纤维化是SSc的主要并发症,也是其主要的致死原因。既往研究发现,SSc小鼠肺组织IL-17A表达明显升高,与肺组织炎症、纤维化程度呈正相关[2]。SSc患者IL-17A表达亦升高,与高分辨率CT评分呈正比[11]。上述研究提示,IL-17A可能参与SSc炎症及纤维化病变的发生和发展。国外学者发现,在BLM诱导的小鼠SSc模型中,IL-17A基因敲除小鼠的皮肤及肺组织纤维化程度明显轻于野生型小鼠[12]。Mi等[13]发现多个肺纤维化动物模型中IL-17A表达均升高,而降低体内IL-17A表达可减轻其肺组织纤维化。本研究制备SSc小鼠模型,同时以抗IL-17A单克隆抗体阻断IL-17A表达;结果发现,与模型组和同型对照组比较,抗体组皮肤厚度明显变薄,肺泡间隔增厚和肺泡结构破坏程度明显减轻,皮肤和肺组织炎症细胞浸润及胶原纤维沉积明显减少,且皮肤炎症评分和肺炎症、纤维化评分亦降低。上述结果说明IL-17A可促进SSc小鼠皮肤和肺炎症、纤维化的发生和发展,而抗IL-17A单克隆抗体可阻断这一过程。
TGF-β1能够促进成纤维细胞的趋化和增殖,并通过诱导细胞外基质合成等发挥促纤维化作用。研究表明,SSc小鼠外周血及皮肤TGF-β1水平均升高,其下游因子CTGF表达水平亦升高[2]。TGF-β1与Th17关系密切,被认为是调节Th17分化的主要细胞因子。既往研究发现,BLM诱导IL-17A的产生依赖于TGF-β1,阻断TGF-β1能够显著抑制BLM和IL-17A诱导的纤维化[12]。前期研究发现,SSc小鼠血清TGF-β1、IL-17A水平均与皮肤、肺纤维化程度呈正相关[14]。本研究模型组、抗体组和同型对照组皮肤和肺组织TGF-β1、CollagenⅠ mRNA相对表达量均明显高于正常对照组,而抗体组上述指标均明显低于模型组及同型对照组,提示拮抗IL-17A可抑制TGF-β1、CollagenⅠ表达,从而延缓SSc小鼠皮肤和肺纤维化病变,与以往研究[15~18]结论一致。
综上所述,IL-17A参与了SSc的炎症及纤维化过程,抗IL-17A单克隆抗体具有抑制SSc小鼠炎症及纤维化的作用;抑制TGF-β1、CollagenⅠ表达可能为其作用机制。IL-17A可能是SSc治疗的新靶点,阻断IL-17A或其信号转导将成为治疗SSc的新途径。
[1] Gabrielli A, Avvedimento EV, Krieg T. Scleroderma[J]. N Engl J Med, 2009,360(19):1989-2003.
[2] Okamoto Y, Hasegawa M, Matsushita T, et al. Potential roles of interleukin-17A in the development of skin fibrosis in mice[J]. Arthritis Rheum, 2012,64(11):3726-3735.
[3] Kurasawa K, Hirose K, Sano H, et al. Increased interleukin-17 production in patients with systemic sclerosis[J]. Arthritis Rheum, 2000,43(11):2455-2463.
[4] Nakashima T, Jinnin M, Yamane K, et al. Impaired IL-17 signaling pathway contributes to the increased collagen expression in scleroderma fibroblasts[J]. J Immunol, 2012,188(8):3573-3583.
[5] Lei L, Zhong XN, Zhao C, et al. Expression and significance of Th17 cells and related cytokines in a murine model of systemic sclerosis[J]. Beijing Da Xue Xue Bao, 2012,44(2):259-264.
[6] Brembilla NC, Montanari E, Truchetet ME, et al. Th17 cells favor inflammatory responses while inhibiting type Ⅰ collagen deposition by dermal fibroblasts: differential effects in healthy and systemic sclerosis fibroblasts[J]. Arthritis Res Ther, 2013,15(5):151.
[7] Yamamoto T, Takagawa S, Katayama I, et al. Effect of superoxide dismutase on bleomycin-induced dermal sclerosis: implications for the treatment of systemic sclerosis[J]. J Invest Dermatol, 1999,113(5):843-847.
[8] Serena F, Massimo B, Yves D, et al. In vivo investigations on anti-fibrotic potential of proteasome inhibition in lung and skin fibrosis[J]. Am J Respir Cell Mol Biol, 2008,39(4):458-465.
[9] Ashcroft T, Simpson JM, Timbrell V. Simple method of estimating severity of pulmonary fibrosis on a numerical scale[J]. J Clin Pathol, 1988,41(4):467-470.
[10] Yamamoto T, Takagawa S, Katayama I, et al. Animal model of sclerotic skin. I: local injections of bleomycin induce sclerotic skin mimicking scleroderma[J]. J Invest Dermatol, 1999,112(4):456-462.
[11] Olewicz-Gawlik A, Danczak-Pazdrowska A, Kuznar-Kaminska B, et al. Interleukin-17 and interleukin-23: importance in the pathogenesis of lung impairment in patients with systemic sclerosis[J]. Int J Rheum Dis, 2014,17(6):664-670.
[12] Wilson MS, Madala SK, Ramalingam TR, et al. Bleomycin and IL-1beta-mediated pulmonary fibrosis is IL-17A dependent[J]. J Exp Med, 2010,207(3):535-552.
[13] Mi S, Li Z, Yang HZ, et al. Blocking IL-17A promotes the resolution of pulmonary inflammation and fibrosis via TGF-β1-dependent and-independent mechanisms[J]. J Immunol, 2011,187(6):3003-3014.
[14] 雷玲,钟小宁,何志义,等.白细胞介素-17在系统性硬化病小鼠模型中的表达及与转化生长因子-β1的相关性[J].中华风湿病学杂志,2012,16(1):42-46.[15] Hara M, Kono H, Furuya S, et al. Interleukin-17A plays a pivotal role in cholestatic liver fibrosis in mice[J]. J Surg Res,2013,183(2):574-582.
[16] 刘心娟,高娜,李梦涛,等.系统性硬化病患者外周血中调节性T细胞与辅助性T细胞17平衡关系的变化[J].中华风湿病学杂志,2016,20(3):148-153.
[17] 雷玲,钟小宁,赵铖,等.Th17细胞及相关细胞因子在系统性硬化病小鼠模型中的表达及意义[J].北京大学学报医学版,2012,44(2):259-264.
[18] 雷玲,钟小宁,赵铖,等.Th17及Tc17细胞在博来霉素致系统性硬化病小鼠模型外周血、皮肤和肺组织中的表达[J].中华微生物学和免疫学杂志,2012,32(4):295-301.
广西省自然科学基金资助项目(2013GXNSFAA019135);广西研究生教育创新计划资助项目(YCSZ2014102)。
雷玲(E-mail: leiling1972@aliyun.com)
10.3969/j.issn.1002-266X.2016.48.012
R593.2
A
1002-266X(2016)48-0038-04
2015-01-11)
