阳离子化牛血清白蛋白膜性肾病大鼠模型的建立与鉴定
2016-02-15彭素英王玉洁何宇陶友丽刘文佳李婷曹灵
彭素英,王玉洁,何宇,陶友丽,2,刘文佳,3,李婷,曹灵
(1 泸州医学院附属医院,四川泸州 646000;2 重庆市第七人民医院;3 自贡市第一人民医院)
阳离子化牛血清白蛋白膜性肾病大鼠模型的建立与鉴定
彭素英1,王玉洁1,何宇1,陶友丽1,2,刘文佳1,3,李婷1,曹灵1
(1 泸州医学院附属医院,四川泸州 646000;2 重庆市第七人民医院;3 自贡市第一人民医院)
目的 建立阳离子化牛血清白蛋白(C-BSA)膜性肾病(MN)大鼠模型。方法选取雄性SD大鼠33只,分为对照组5只,尾静脉低、中、高剂量组各7只,腹腔组7只。尾静脉低、中、高剂量组及腹腔组均皮下注射0.5 mg C-BSA和等体积不完全弗氏佐剂(ICFA)预先免疫1周,对照组皮下注射等体积生理盐水和ICFA;1周后正式免疫:尾静脉低、中、高剂量组分别隔日尾静脉注射20、40、60 mg/kg C-BSA,腹腔组隔日腹腔注射60 mg/kg C-BSA,对照组尾静脉注射等体积生理盐水。正式免疫4周,采用生化指标(TC、TG、血清白蛋白)、24 h尿蛋白定量(24 h UTP)、PASM染色、Masson染色、免疫荧光及电镜观察鉴定模型。结果与对照组比较,尾静脉低、中、高剂量组TC、TG及24 h UTP均升高,血清白蛋白均降低,腹腔组24 h UTP升高(P均<0.05)。尾静脉低、中、高剂量组PASM染色示肾小球基底膜(GBM)弥漫性增厚、钉突改变;Masson染色示肾小球上皮下嗜复红复合物沉积;免疫荧光显示IgG沿GBM呈细小颗粒状沉积;电镜下见GBM弥漫性增厚;病理改变呈剂量依赖性加重。腹腔组光镜及电镜未见明显病理变化。结论成功采用尾静脉注射C-BSA建立大鼠MN模型,临床及病理鉴定符合MN的特征。
膜性肾病;阳离子化牛血清白蛋白;尾静脉注射;腹腔注射;大鼠
膜性肾病(MN)是引起中老年人原发性肾病综合征的常见原因,主要病理特点为肾小球基底膜(GBM)上皮侧免疫复合物的沉积,GBM弥漫性增厚[1~3]。建立良好有效的动物模型对于MN的深入研究具有重要意义[4]。目前,MN常用的动物模型有被动型海曼性肾炎(PHN)模型和阳离子化牛血清白蛋白(C-BSA)模型。相对于PHN模型,C-BSA模型的造模成本低、成模率高、模型稳定,但目前国内外建立C-BSA模型所用的C-BSA剂量不统一,且均采用现配现用的方式,方法相对复杂。2014年4~12月,本研究通过腹腔注射和尾静脉注射不同剂量冻存多年的C-BSA制备大鼠MN模型,并进行鉴定,力求寻找一种建立简单、方便、典型的MN大鼠模型的新方法。
1 材料与方法
1.1 材料 健康雄性大鼠33只,体质量150~160 g,由泸州医学院实验动物中心提供,动物许可证号:SCXK(川)2013-17。随机分为对照组5只,尾静脉注射低、中、高剂量组各7只,腹腔组7只。清洁环境饲养,室温18~22 ℃,普通饲料饲养,瓶装水自由饮水。C-BSA为9年前本课题组参照改良Border法[5]制备的等电点为8.4以上的粉剂,使用无菌玻璃瓶于-20 ℃密封存放。
1.2 动物分组及模型建立 大鼠均适应性喂养1周,检测24 h尿蛋白定量(24 h UTP),24 h UTP<0.05 mg/d的大鼠进入实验。尾静脉低、中、高剂量组及腹腔组均皮下注射0.5 mg C-BSA和等体积不完全弗氏佐剂(ICFA)预免疫;对照组皮下注射等体积生理盐水和ICFA。1周后进行正式免疫:尾静脉低、中、高剂量组分别隔日尾静脉注射20、40、60 mg/kg C-BSA,腹腔组隔日腹腔注射 60 mg/kg C-BSA,对照组尾静脉注射等体积生理盐水。
1.3 模型鉴定 临床鉴定: 正式免疫4周收集血液、尿液和肾脏标本做进一步检查。血、尿标本均在泸州医学院检验科检测,检测指标包括TG、TC、血清白蛋白(ALB)、24 h UTP。病理鉴定:将肾脏组织分为三部分,分别进行PASM染色、Masson染色、免疫荧光和电镜观查:取1/2肾脏经甲醛固定,石蜡包埋,常规切片,进行PASM、Masson染色(送泸州医学院病理科);取3 cm×3 cm的肾皮质行IgG直接免疫荧光染色;取左肾上极2 mm×2 mm的肾皮质,用戊二醛电镜固定液固定后送四川大学华西医院电镜中心制备电镜样品,并进行拍照。

2 结果
对照组、尾静脉低剂量组及腹腔组均无大鼠死亡,尾静脉中剂量组分别于正式免疫2、3周末死亡1只;尾静脉注射高剂量组在正式免疫2周末死亡2只,3周末死亡1只。
2.1 临床特征鉴定结果 正式免疫4周,各组TC、TG、ALB及24 h UTP比较见表1。
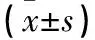
表1 各组TC、TG、ALB及24 h UTP比较
注:与对照组比较,*P<0.05;与腹腔组比较,△P<0.05。
2.2 病理学特征鉴定结果 正式免疫4周,PASM染色示尾静脉低、中、高剂量组部分GBM空泡变性、绸缎样变,部分增厚,偶有钉突形成、双轨样改变,随剂量增加,病理改变加重;腹腔注射组见GBM绸缎样变,无GBM增厚、钉突等病变。Masson染色示尾静脉注射低、中、高剂量组少量上皮下嗜复红复合物沉积,随剂量增加,沉积物逐渐增多;对照组及腹腔组无免疫复合物沉积。免疫荧光示尾静脉低、中、高剂量组IgG沿GBM呈细颗粒状沉积,各组间无明显差异;腹腔组少许IgG沿GBM沉积;对照组无沉积。电镜下可见尾静脉低、中、高剂量组GBM上皮侧有电子致密物沉积,基底膜增厚,足突广泛融合,随剂量增加,电子致密物逐渐增多。
3 讨论
MN发病机制复杂,近年来大量研究提示血清抗M型磷酯酶A2受体抗体(PLA2R)是MN的敏感性和特异性标记物,70%的活动性MN患者PLA2R呈中高表达[6~11],但其机制尚未完全阐明,治疗上仍存在很大争议[12]。相对于PHN模型,C-BSA模型不仅临床症状类似人类MN,基因改变与人类MN也高度相似[13],即更具有人类MN的特征。目前制备C-BSA模型尚无统一的C-BSA用量,多是现配现用,程序复杂。
既往造模多采用16、50 mg/kg等剂量[5,13,14],本实验考虑C-BSA密封存放时间长,为寻求合适剂量及简单方式,预实验采用20、40、60、80 mg/kg尾静脉注射及80 mg/kg腹腔注射,均为1周3次;预实验结束时,80 mg/kg组大鼠全部死亡,可能为药物剂量过大所致,故本实验采用了20、40、60 mg/kg三种剂量尾静脉注射,并首次探索腹腔注射的方式(60 mg/kg)。本实验发现尾静脉低、中、高剂量组呈肾病综合征表现,且肾脏病理检查示上皮下免疫复合物沉积,GBM弥漫性增厚,部分有钉突形成,IgG沿肾小球毛细血管壁细颗粒状沉积,电镜下见上皮下电子致密物沉积,与既往采用新鲜C-BSA制备MN大鼠模型效果相当[14],均具有MN临床及病理改变特点。病理改变呈C-BSA剂量依赖性加重,可能是C-BSA作为异种抗原或抗体进入体内后易于与富含负电荷的GBM结合,从而形成免疫复合物,通过激活补体形成膜攻击复合物C5b-9,进而损伤足细胞,导致GBM通透性改变、增厚等[1,15],从而出现一系列临床症状。本研究腹腔组有蛋白尿,但无明显血液生化指标变化,有轻度的非特征性病理改变,可能因为造模时间不够长或C-BSA腹腔注射吸收较少,导致实际吸收的C-BSA不足,甚或是本身腹腔注射不能制备MN大鼠模型,有待进一步研究。本实验首次采用配制多年的C-BSA,通过尾静脉注射成功建立MN大鼠模型,提示C-BSA配置后严格密封,-20 ℃保存9年仍有效,便于今后MN的科研工作,可节省C-BSA的制备时间及费用。
综上所述,本实验中采用存放多年的C-BSA分为三种不同剂量经尾静脉注射制备大鼠MN模型,经过电镜鉴定造模成功,且符合MN的临床表现及病理特点。三个剂量比较,20 mg/kg C-BSA尾静脉注射即可成功制备MN模型。
[1] 丁小强,刘春凤.特发性膜性肾病研究进展[J].中国实用内科杂志,2011,31(2):108-112.
[2] Volovăt C, C runtu I, Costin C, et al. Changes in the histological spectrum of glomerular diseases in the past 16 years in the North-Eastern region of Romania [J]. BMC Nephrology, 2013,(14):148.
[3] Ponticelli C, Passerini P. Management of idiopathic membranous nephropathy[J]. Expert Opin Pharmacother, 2010,11(13): 2163-2175.
[4] 敖广宇,曹灵.膜性肾病动物模型研究进展[J].山东医药,2015,55(34):96-98.
[5] Zhang S, Xin H, Li Y, et al. Skimmin, a coumarin from hydrangea paniculata, slows down the progression of membranous glomerulonephritis by anti-Inflammatory effects and inhibiting immune complex deposition[J]. Evid Based Complement Alternat Med, 2013,2013:819296.
[6] Zhu P, Zhou FD, Wang SX, et al. Increasing frequency of idiopathic membranous nephropathy in primary glomerular disease: a 10-year renal biopsy study from a single Chinese nephrology centre[J]. Nephrology (Carlton, Vic), 2015,20(8):560-566.
[7] 张玲,李益明,王志芳,等.青年特发性膜性肾病临床病理及预后59例分析[J].实用医学杂志,2014,30(19):3144-3147.
[8] Lai WL, Yeh TH, Chen PM, et al. Membranous nephropathy: a review on the pathogenesis, diagnosis, and treatment[J]. J Formos Med Assoc, 2015,114(2):102-111.
[9] Kattah A, Ayalon R, Beck LH, et al. Anti-phospholipase A(2) receptor antibodies in recurrent membranous nephropathy[J]. Am J Transplant, 2015,15(5):1349-1359.
[10] Oh YJ, Yang SH, Kim DK, et al. Autoantibodies against phospholipase A2 receptor in Korean patients with membranous nephropathy[J]. PloS One, 2013,8(4):e62151.
[11] 曹鹏龙,李士军,郐婷婷,等.血清抗M型磷酯酶A2受体抗体与成人特发性膜性肾病的相关性[J].实用医学杂志,2014,30(15):2441-2444.
[12] 李婷,何宇,宋林淋,等.环孢素A、他克莫司治疗特发性膜性肾病的研究进展[J].山东医药,2015,55(36):93-95.
[13] Wu CC, Chen JS, Huang CF, et al. Approaching biomarkers of membranous nephropathy from a murine model to human disease[J]. J Biomed Biotechnol, 2011,2011:581928.
[14] 梁静,孙兴旺,曹灵,等.不同剂量阳离子化牛血清白蛋白对膜性肾病大鼠造模的影响[J].中国组织工程研究与临床康复,2008,12(37):7322-7325.
[15] Ronco P, Debiec H. Pathogenesis of membranous nephropathy: recent advances and future challenges[J]. Nat Rev Nephrol, 2012,8(4):203-213.
四川省卫生厅科研基金资助项目(120342);泸州市科技局重点项目(2012-S-37)。
曹灵(E-mail: LZcaoling@163.com)
10.3969/j.issn.1002-266X.2016.48.011
R692.3
A
1002-266X(2016)48-0036-03
2015-10-29)
