口蹄疫病毒VP1蛋白可溶性表达标签筛选
2016-02-14舒静超李赛赛申欢欢郭豫杰河南农业大学农业部动物生化与营养重点开放实验室河南郑州450002
舒静超,李赛赛,申欢欢,郭豫杰(河南农业大学/农业部动物生化与营养重点开放实验室,河南 郑州 450002)
口蹄疫病毒VP1蛋白可溶性表达标签筛选
舒静超,李赛赛,申欢欢,郭豫杰*
(河南农业大学/农业部动物生化与营养重点开放实验室,河南 郑州 450002)
为了提高口蹄疫病毒VP1蛋白的可溶性表达,根据A型口蹄疫病毒核酸序列设计并合成了口蹄疫病毒VP1片段,将其克隆到pET21b(+)载体上,设计1对通用引物扩增10个融合标签Grifin、GST、NusA、SUMO、Thioredoxin、ProteinG、γ-crystallin、ArsC、PpiB、MBP,并分别将扩增的融合标签与VP1连接构建重组质粒,将重组质粒转化大肠杆菌BL21(DE3),0.5 mmol/L IPTG诱导其表达。SDS-PAGE结果表明,MBP、Grifin和GST能够促进口蹄疫病毒VP1蛋白的可溶性表达,其中MBP与VP1融合表达蛋白可溶部分占60%;Western blot鉴定分析结果显示,小鼠抗His标签单克隆抗体能识别表达的重组蛋白。表明成功表达了具有免疫学活性的融合蛋白MBP-VP1。
口蹄疫病毒; VP1蛋白; 可溶性; 融合标签
口蹄疫(foot-and-mouth disease,FMD)是由口蹄疫病毒引起的偶蹄动物烈性接触性传染病,主要危害牛、羊、猪等,发病率极高,传播速度极快,易造成严重的经济损失,世界动物卫生组织将其列为A类传染病之首,我国农业部也将其划定为一类动物传染病[1]。口蹄疫病毒(foot-and-mouth disease virus,FMDV)属于小RNA病毒科(Picomaviridae)、口蹄疫病毒属(Aphthovirus),有7个血清型,包括A型、O型、C型、Asia l型、SAT 1型、SAT 2型和SAT 3型等血清型,其中O型、A型口蹄疫在世界范围内分布广泛,近年来A型口蹄疫的流行范围和暴发频率呈现扩大和增强的趋势。目前已知的FMDV各型之间没有交叉免疫保护性。根据国家口蹄疫参考实验室疫情监测结果,我国目前主要流行O型和A型2个血清型,2013—2014年我国共报道发生A型疫情22次,疫情主要分布于广东、新疆、西藏、青海、云南和江苏等6个省(自治区)[2]。
FMDV存在很强的变异性,7个血清型又分为60多个血清亚型[3]。FMDV含有单股正链RNA基因组,长约8 300 nt,主要包括3部分:5′非翻译区、开放阅读框(ORF)和 3′非翻译区。FMDV基因组无帽子结构,5′端共价连接有病毒自身编码的VPg蛋白,3′端为poly(A)尾巴。ORF编码的多聚蛋白依靠自身编码的蛋白酶(L、2A、3C)及少数的宿主因子裂解为3~4种病毒结构蛋白(VP4、VP2、VP3和VP1)和8~9种非结构蛋白(Lab、Lb、2A、2B、2C、3A、3B、3C和3D)[4]。其中,结构蛋白VP1是诱导产生中和抗体的主要抗原表位,暴露在病毒颗粒的表面,VP1上的B细胞表位是主要的保护性抗原位点,在其顶部形成高度保守的Arg-Gly-Asp序列,该序列是FMDV的细胞受体位点[5]。VP1上另1个抗原位点是辅助性 T 细胞表位,与B细胞表位形成一个非连续的形态表位,在免疫中起关键作用[6]。研究表明,从病毒衣壳蛋白分离的VP1可诱导动物产生针对该表位的中和性抗体[7]。因此,研究者尝试利用衣壳蛋白上的抗原表位设计重组基因工程抗原以检测和预防FMD[8]。鉴于VP1结构蛋白对研究FMDV的重要意义,笔者所在课题组以人工合成的方法将FMDV VP1上的主要抗原表位串联起来,构建VP1多抗原表位片段,大小为636 bp。为得到高效表达的FMDV可溶性VP1蛋白,将VP1基因与Grifin 、GST、NusA、SUMO、Thioredoxin、ProteinG、γ-crystallin、ArsC、PpiB、MBP 10种不同融合表达标签相连,研究不同融合标签对VP1蛋白在大肠杆菌中可溶性表达效率的影响,以筛选出提高VP1蛋白可溶性表达的融合标签,为进一步研究FMDV及其基因工程疫苗提供试验材料。
1 材料和方法
1.1 载体
含VP1多抗原表位基因载体pET21b-VP1由宝生物(大连)公司合成构建;含有10种融合标签的pEX系列载体由本实验室保存,载体质粒信息见表1。

表1 载体信息
1.2 试剂
DNA Marker DL2000、DL5000购自宝生物(大连)公司;限制性内切酶BamHⅠ、NheⅠ购自Thermo Scientific公司;IPTG、质粒切胶回收纯化试剂盒、质粒小量提取试剂盒购自生工生物工程(上海)股份有限公司;Tryptone、Yeast Extract、Agar power购自OXIOD公司;Prestained Protein MarkerⅠ、Agarose购自GENVIEW公司;四甲基乙二胺(TEMED)、2×SDS-PAGE电泳上样缓冲液购自鼎国昌盛生物技术有限公司。
1.3 方法
1.3.1 含融合标签的T载体构建 设计1对通用引物,上游引物为 F:5′-CTAGCTAGCTCTCACCATCACCATCACCATG-3′(下划线部分为NheⅠ酶切位点),下游引物为R:5′-CGGGATCCGGATTGGAAGTACAGGTTTTC-3′(下划线部分为BamHⅠ酶切位点),以上述10个pEX载体为模板分别扩增融合标签片段。 PCR产物经琼脂糖凝胶电泳鉴定,切胶回收后连接至pMD19-T载体,连接产物转化大肠杆菌DH5α,菌液涂布于LB(含Amp)固体平板,37 ℃培养12 h,使用上述通用引物进行PCR鉴定,将初步鉴定为阳性的菌液送生工生物工程(上海)股份有限公司测序鉴定。
1.3.2 重组表达载体的构建 将测序正确的10个重组融合标签pMD19-T载体及pET21b-VP1质粒用NheⅠ和BamHⅠ进行双酶切,回收相应目的片段,使用T4 DNA连接酶把回收的10个融合标签片段分别与双酶切后的pET21b-VP1质粒连接,分别命名为pET-2—9、pET-16、pET-21。同样方法连接产物分别经转化和单菌落扩大培养后,将经PCR鉴定融合标签与pET21b-VP1质粒成功连接的阳性菌液送生工生物工程(上海)股份有限公司测序鉴定。
1.3.3 VP1蛋白的诱导表达 将测序正确的10个pET重组质粒和pET21b-VP1质粒分别转化大肠杆菌感受态BL21(DE3),经转化扩大培养后通过PCR-PEF-21筛选阳性克隆菌液。将10个pET重组质粒和pET21b-VP1质粒的阳性菌液按1︰100的比例接种到50 mL LB(含100 mg/L的Amp)液体培养基中,37 ℃培养至OD600=0.6 ~0.8时,加入IPTG至0.5 mmol/L。18 ℃、160 r/min诱导12 h后离心收集菌体,5 mL PBS溶液重悬,超声波破碎(功率160 W,工作4 s,间歇8 s,持续25 min),用12%分离胶和5%浓缩胶SDS-PAGE电泳检测未诱导全菌、诱导后全菌、破碎后上清和沉淀中蛋白质的表达。1.3.4 融合标签的筛选及鉴定 10组重组质粒经过SDS-PAGE电泳后,经考马斯亮蓝染色并脱色,对比诱导后全菌中目的蛋白的表达量来筛选能够提高目的蛋白表达量的融合标签,并比较上清中目的蛋白量筛选出能够促进FMDV VP1蛋白可溶性表达的融合标签。
取可溶性表达较好的VP1蛋白进行Western blot鉴定,初步检测蛋白质是否正确翻译。取处理好的诱导后全菌和上清先进行SDS-PAGE电泳,随后将蛋白质转印至PVDF膜上,再将膜在室温用含5%脱脂奶粉的TBST封闭40 min,随后加入1∶3 000鼠抗6×His单克隆抗体,4 ℃孵育过夜后TBST洗膜3次,再加入1∶5 000 HRP标记的羊抗鼠IgG二抗,作用60 min后TBST洗膜3次,最后用ECL试剂曝光显影。
2 结果与分析
2.1 含融合标签的T载体构建结果
融合标签PCR扩增结果显示(图1),分别在502、739、1 194、1 570、385、412、256、619、508、583 bp出现目的条带,与pMD19-T载体连接后测序与预期片段大小和序列一致,表明融合标签与pMD19-T载体连接成功。

M:DL2000 Marker; 1—10:分别为Grifin、GST、MBP、NusA、SUMO、Thioredoxin、ProteinG、γ-crystallin、ArsC、PpiB标签PCR产物图1 融合标签PCR扩增结果
2.2 重组表达载体的构建结果
含融合标签pMD19-T载体的双酶切结果(图2)显示,Grifin、GST、MBP、NusA、SUMO、Thioredoxin、ProteinG、γ-crystallin、ArsC、PpiB分别在502、739、1 194、1 570、385、412、256、619、508、583 bp处有相应的融合标签片段,2 692 bp的片段为pMD19-T载体片段;载体pET21b-VP1双酶切结果显示(图3),在6 068 bp处有含VP1的载体片段。
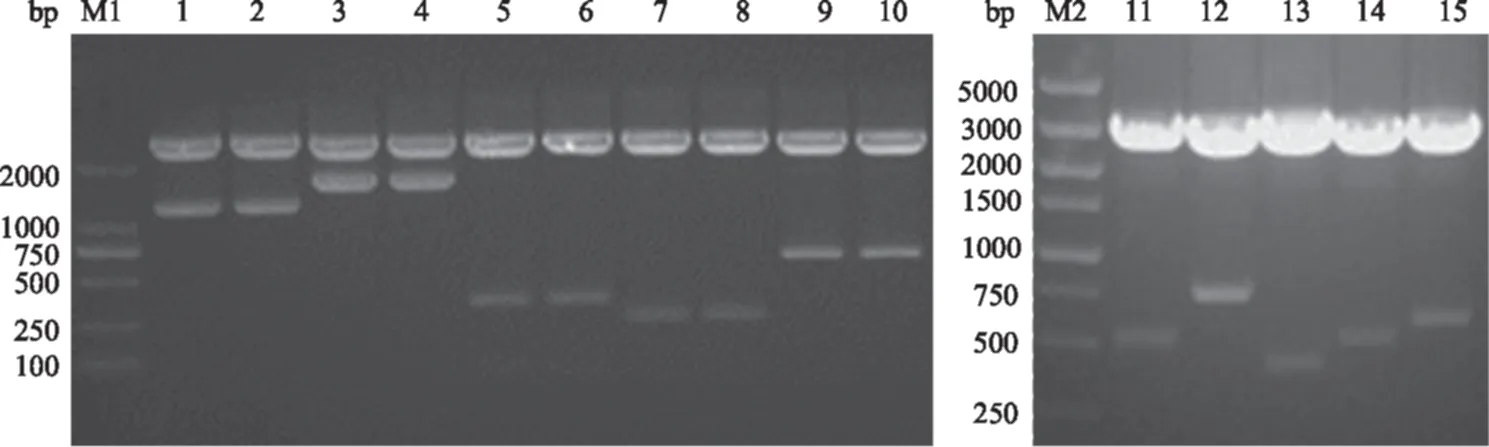
M1:DL2000 Marker; M2:DL5000 Marker; 1—10:分别为MBP、NusA、SUMO、ProteinG、γ-crystallin的pMD19-T载体双酶切(2个重复);11—15:分别为Grifin、GST、Thioredoxin、ArsC、PpiB的pMD19-T载体双酶切图2 融合标签载体双酶切结果
重组表达载体菌液PCR结果显示(图4),10个重组质粒均出现阳性条带,菌液PCR鉴定为阳性的重组质粒经测序比对完全正确,说明融合标签和VP1的重组表达载体构建成功。

M:DL5000 Marker; 1—2:pET21b-VP1双酶切图3 pET21b-VP1双酶切结果

M:DL2000 Marker; 1—10:分别为10个pET重组质粒Grifin、GST、MBP、NusA、SUMO、Thioredoxin、ProteinG、γ-crystallin、ArsC、PpiB标签的PCR结果图4 重组质粒菌液PCR扩增结果
2.3 VP1重组蛋白表达鉴定
从图5可以看出,对照组pET21b-VP1目的蛋白在28 ku的位置有目的条带;Thioredoxin、ProteinG、ArsC 与VP1的重组载体未能表达目的蛋白;Grifin、GST、MBP、NusA、SUMO、γ-crystallin、PpiB与VP1融合表达之后分别在43、52、69、82.5、39、48、46 ku的位置有目的条带,箭头所指即为带VP1的融合蛋白条带。

pET21b-VP1 以及VP1与Grifin、GST、MBP、NusA、SUMO、γ-crystallin、PpiB等标签的融合表达结果; UN为未诱导菌体; IN为诱导后菌体;S为菌体超声破碎后上清; IB为包涵体; M为Prestained Protein MarkerⅠ图5 VP1重组蛋白SDS-PAGE分析
2.4 融合标签的筛选及鉴定结果
由图5可知,pET21b-VP1目的蛋白主要表达在沉淀中,为包涵体表达,溶解度很低;Thioredoxin、ProteinG、ArsC 与VP1的重组载体虽然构建成功,但诱导后没有表达出融合蛋白;SUMO融合蛋白少量表达且在上清中,即SUMO标签可促进蛋白的可溶性表达,但表达量低;NusA、γ-crystallin、PpiB融合蛋白表达量很高,以不溶的包涵体为主,上清中目的蛋白很少,提示这些标签能提高目的蛋白表达量,但未提高重组蛋白的可溶性;与原质粒pET21b-VP1蛋白表达相比,Grifin、GST、MBP标签不仅提高融合蛋白表达量,且上清中重组蛋白比例明显提高,表明Grifin、GST、MBP标签能促进VP1蛋白的可溶性表达。经灰度分析软件分析,10种融合标签中MBP标签表达的VP1蛋白可溶部分占60%,明显促进VP1可溶性表达。
取pET-4(MBP)诱导后全菌及上清进行Western blot鉴定,在69 ku位置有阳性条带,即pET-4(MBP)重组表达蛋白与6×His的抗体特异性结合,证实该蛋白为MBP-VP1融合蛋白(图6)。

M:Prestained Protein Marker Ⅰ; 1.pET-4(MBP)诱导后全菌; 2.pET-4(MBP)上清图6 VP1重组蛋白 Western blot结果
3 结论与讨论
口蹄疫重组蛋白亚单位疫苗作为新型基因工程疫苗正在受到越来越高的重视[9-10],亚单位疫苗由于只含病毒衣壳蛋白不含核酸,不仅在体液免疫应答和细胞免疫方面具有其独特的优势,而且具有很高的安全性。VP1片段是FMDV的主要抗原位点,能够诱导机体产生保护性的中和抗体。大肠杆菌、酵母、杆状病毒和痘病毒等都能被用作表达目的蛋白的载体,其中大肠杆菌以其自身优点经常被用作宿主菌。Kleid等[12]首次在大肠杆菌中成功表达FMDV A12株VP1重组蛋白抗原,该重组蛋白抗原能够诱导机体产生中和抗体,免疫动物后能抵御同源病毒的攻击,不仅证明了VP1蛋白是FMDV重要的保护性抗原之一,也为研制重组亚单位口蹄疫表位疫苗提供了理论依据。
普通外源基因转入大肠杆菌之后一般为包涵体表达,包涵体对于蛋白质的进一步应用是不利的[13]。研究者采用了很多的方法来提高蛋白质的可溶性,比如降低诱导的温度[14]、改变宿主菌[15]、改变启动子、改变诱导的条件[16]、采用分子伴侣和折叠调节因子的共表达[17]。然而,在很多情况下,改变以上这些条件也无法解决在大肠杆菌中过表达蛋白形成包涵体[18]。蛋白质的诱导表达有3个重要因素:温度、诱导时间及诱导剂浓度,温度太高易形成包涵体,IPTG本身对细菌有毒性,所以浓度不宜太高。目前,蛋白质的表达和纯化已不再是技术难题,但重组蛋白的可溶性表达依然是个瓶颈,导致蛋白质不可溶有2个主要因素,1个是蛋白质翻译的速率,另1个是蛋白质折叠的速率[19]。Costa等[20]曾在研究中使用ubiquitin、SUMO、MBP、GST、Thioredoxin和NusA 6种融合标签对增强型绿色荧光蛋白、基质金属蛋白酶13和生长分化因子8等公认的难溶蛋白的可溶性表达进行对比,得出不同的融合标签对不同蛋白质的促可溶效果不同,其中,SUMO 和NusA提高重组蛋白的表达水平和溶解度最为明显。Miroux等[14]发现,Grifin、GST、NusA、MBP等常用融合标签可以提高重组蛋白的溶解度。为了筛选提高FMDV蛋白可溶性表达的融合标签,本研究将目的基因与Grifin、GST、NusA、SUMO、Thioredoxin、ProteinG、γ-crystallin、ArsC、PpiB、MBP等10种融合标签连接,在18 ℃条件下,经0.5 mmol/L IPTG诱导12 h,研究10种融合标签对FMDV蛋白VP1在大肠杆菌中的表达量和可溶性表达的影响,发现SUMO标签融合蛋白溶解度高,但表达量很低;NusA、γ-crystallin、PpiB标签促进蛋白质高表达,但可溶性表达不高;Thioredoxin、ArsC 和ProteinG未能诱导出重组蛋白;MBP、Grifin和GST标签不仅能提高FMDV蛋白的表达量,又能促进其可溶性表达。综合表达量和可溶性两方面的结果,MBP标签提高重组蛋白表达量和溶解度效果最好,Western blot结果显示,诱导的蛋白质为带6×His的目的蛋白。本研究通过在融合部位的N端放置TEV标签,作为蛋白质酶切割位点[22],在获得高纯度蛋白质后,便于从N端进行切割来获得不带融合标签的口蹄疫VP1蛋白,为后续口蹄疫VP1蛋白及口蹄疫亚单位疫苗的研究奠定基础。
本研究中构建的10个原核表达载体以及FMDV VP1蛋白的可溶性表达,不仅有利于目的蛋白的纯化,为其生物学功能和A型口蹄疫亚单位疫苗研究提供试验材料,也为融合标签的研究提供参考。
[1] Domingo E,Baranowski E,Escarmis C,etal.Foot-and-mouth disease virus[J].Comp Immun Microbiol Infect Dis,2002, 25(5/6):297-308.
[2] 何继军,郭建宏,刘湘涛.我国口蹄疫流行现状与控制策略[J].中国动物检疫,2015(6):10-14.
[3] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:395-413.
[4] Sobrino F.Foot and mouth disease:Current perspectives[M].Horizon Bioscience,2004:19-76.
[5] 张显升,刘在新,赵启祖.口蹄疫病毒基因组RNA结构与功能研究进展[J].病毒学报,2001,17(4):375-380.
[6] 柳纪省.口蹄疫研究进展[J].中国兽医科技,1999(3):17-22.
[7] Golde W T,Nfon C K,Toka F N.Immune evasion during foot-and-mouth disease virus infection of swine[J].Immunol Rev,2008,225:85-95.
[8] He D M,Qian K X,Shen G F,etal.Stable expression of foot-and-mouth disease virus protein VP1 fused with cholera toxin B subunit in the potato (Solanumtuberosum)[J].Colloids Surf B Biointerfaces,2007,55(2):159-163.
[9] Chan E W,Wong H T,Cheng S C,etal.An immunoglobulin G based chimeric protein induced foot-and-mouth disease specific immune response in swine[J].Vaccine,2000,19(4/5):538-546.
[10] Zhang Y L,Guo Y J,Wang K Y,etal.Enhanced immunogenicity of modified hepatitis B virus core particle fused with multiepitopes of foot-and-mouth disease virus[J].Scandinavian Journal of Immunology,2007,65(4):320-328.
[11] Kleid D G,Yansura D,Small B,etal.Cloned viral protein vaccine for foot-and-mouth disease:Responses in cattle and swine[J].Science,1981,214(4525):1125-1129.
[12] 朱红裕,李强.外源蛋白在大肠杆菌中的可溶性表达策略[J].过程工程学报,2006,6(1):150-155.
[13] Hammarstrom M,Hellgren N,van Den Berg S,etal.Rapid screening for improved solubility of small human proteins produced as fusion proteins inEscherichiacoli[J].Protein Sci,2002,11(2):313-321.
[14] Miroux B,Walker J E.Over-production of proteins inEscherichiacoli:Mutant hosts that allow synthesis of some membrane proteins and globular proteins at high levels[J].Journal of Molecular Biology,1996,260(3):289-298.
[15] Qing G,Ma L C,Khorchid A,etal.Cold-shock induced high-yield protein production inEscherichiacoli[J].Nature Biotechnology,2004,22(7):877-882.
[16] de Marco A,De Marco V.Bacteria co-transformed with recombinant proteins and chaperones cloned in independent plasmids are suitable for expression tuning[J].Journal of Biotechnology,2004,109 (1/2):45-52.
[17] Chayen N E.Turning protein crystallisation from an art into a science[J].Current Opinion in Structural Biology,2004,14(5):577-583.
[18] Widmann M,Christen P.Comparison of folding rates of homologous prokaryotic and eukaryotic proteins[J].The Journal of Biological Chemistry,2000,275(25):18619-18622.
[19] Marblestone J G,Edavettal S C,Lim Y,etal.Comparison of SUMO fusion technology with traditional gene fusion systems:Enhanced expression and solubility with SUMO[J].Protein Science,2006,15(1):182-189.
[20] Costa S,Almeida A,Castro A,etal.Fusion tags for protein solubility,purification,and immunogenicity inEscherichiacoli:The novel Fh8 system[J].Front Microbiol,2014,5:63.
Screening of Fusion Tags that Enhanced Expression and Solubility of Type A Foot-and-mouth Disease Virus VP1 Protein
SHU Jingchao,LI Saisai,SHEN Huanhuan,GUO Yujie*
(Key Laboratory of Animal Biochemistry and Nutrition of Ministry of Agriculture/Henan Agricultural University,Zhengzhou 450002,China)
In order to improve the soluble expression of FMDV VP1 protein,FMDVVP1 gene fragment was designed and synthesized according to the nucleic acid sequence of type A FMDV,and was cloned into the vector pET21b (+).A pair of universal primers and ten fusion tags(Grifin,GST,NusA,SUMO,Thioredoxin,ProteinG,γ-crystallin,ArsC,PpiB,MBP)were recombinanted with VP1 respectively,and then they were transformed intoE.coliBL21(DE3) and induced by 0.5 mmol/L IPTG,respectively.The results of SDS-PAGE showed that MBP,Griffin and GST increased the solubility of the FMDV VP1 protein,which worked best with MBP,and the proportion of soluble cellular lysate was 60%.Western blot analysis showed that the recombinant protein could be recognized by mouse anti-his tag monoclonal antibody.It indicated that the fusion protein MBP-VP1 with immunological activity was successfully expressed.
FMDV; VP1 protein; solubility; fusion tags
2016-02-10
农业部转基因重大专项(2014ZX0801015B)
舒静超(1990-),男,河南安阳人,在读硕士研究生,研究方向:兽医生物技术。E-mail:shujch1995@163.com
*通讯作者:郭豫杰(1978-),女,河南商丘人,讲师,博士,主要从事生物化学研究。E-mail:cngyuj@163.com
S855.3
A
1004-3268(2016)09-0114-06
