高血糖对非酒精性脂肪性肝炎大鼠肝纤维化形成的影响及机制探讨
2016-02-09杜卫东陈士明
项 标 杜卫东 夏 超 陈士明
高血糖对非酒精性脂肪性肝炎大鼠肝纤维化形成的影响及机制探讨
项 标 杜卫东 夏 超 陈士明
目的探讨高血糖对非酒精性脂肪性肝炎(NASH)大鼠肝纤维化形成的影响及机制。方法将60只SD大鼠随机数字法分成正常对照组、高血糖模型组、高血糖伴NASH组、氨基胍组和虎杖组,分别检测各组大鼠血糖值,病理学变化(HE染色),纤维化程度,肝组织基质金属蛋白酶组织抑制因子-1(TIMP-1)、转化生长因子-β1(TGF-β1)和晚期糖基化终产物(AGEs)含量的变化及各组大鼠α-平滑肌动蛋白(α-SMA)、结蛋白(desmin)的表达评分。结果(1)血糖:氨基胍组和虎杖组大鼠血糖[(14.20±11.74)/(5.25±0.92)mmol/L]低于高血糖组[(22.20±1.70)mmol/L]和NASH组[(22.21±5.49)mmol/L](均P<0.05);(2)病理学改变:与正常对照组比较,高血糖组和NASH组肝组织出现细胞变性和纤维化改变。与NASH组比较,虎杖组肝细胞结构形态较正常,只有较轻度水肿、脂肪变性等炎性改变,未见明显纤维化;α-SMA[(4.92±1.69)分]、Desmin[(4.75±1.75)分]表达及TIMP-1[(3473.76±372.06)pg/mL]、TGF-β1[(125.26±28.60)ng/mL]、AGEs[(75.86±22.36)ng/mL]含量也显著降低(均P<0.01)。氨基胍组肝组织脂肪变性、水样变性、纤维化程度有所减轻,α-SMA表达增高(9.00±2.04)分(P<0.05),TIMP-1[(3543.67±377.05)pg/mL]、AGEs[(75.86±22.35)ng/mL]含量降低(P均<0.01),同时TGF-β1表达减低[(145.31±43.14)ng/mL],但差异无统计学意义(P>0.05)。结论高血糖可促进NASH大鼠肝纤维化形成,降低血糖和减少AGEs形成可减轻或抑制肝纤维化的发生;作用机制之一是激活肝星状细胞。虎杖较氨基胍改善NASH大鼠肝纤维化的作用更明显。
大鼠;高血糖;非酒精性脂肪性肝炎;肝纤维化;虎杖;氨基胍
肝纤维化是一组免疫介导的炎症性疾病,是多种慢性肝病发展的终末阶段,近年来脂肪肝导致的肝纤维化发病率明显上升。不同于西方,在中国非酒精性脂肪肝发病率明显高于酒精性脂肪肝[1]。糖尿病和非酒精性脂肪肝现已成为我国常见的慢性病之一。两者在发病时多会出现胰岛素抵抗(IR)和晚期糖基化终产物(AGEs)过度蓄积等现象,可能含有某些共同的发病基础。糖尿病患者体内AGEs过度累积,可在肝组织中引起氧化应激反应和炎症反应而损伤肝细胞[2]。当前对降低血糖及AGEs形成能否减轻合并糖代谢异常的脂肪性肝炎肝纤维化受到了广泛关注。有报道降低血糖以及抑制体内胰岛素抵抗,能够抑制脂质过氧化,减少氧化应激反应,从而对脂肪性肝炎起到一定的保护[3]。中药虎杖已证实为植物源性α-葡萄糖苷酶抑制剂[4],可抑制或延缓肺纤维化[5],并对ConA诱导的小鼠急性肝损伤有保护作用[6],氨基胍可抑制AGEs。本实验探讨高血糖对高脂饮食所致大鼠肝纤维化影响及用降糖药物处理后的效果及机制。
1 实验材料
1.1 动 物 8周龄SPF级雄性,SD大鼠60只,体质量(200±20)g,上海斯莱克实验动物有限公司提供,许可证号:SCXK(沪)2012-0002,饲养于浙江中医药大学实验动物中心SPF环境。
1.2 主要材料 血糖试纸、血糖测试仪(强生(中国)医疗器械有限公司),柠檬酸三钠、柠檬酸柠檬酸三钠、柠檬酸(无锡市晶科化工有限公司,批号20110827);链脲佐菌素(STZ)(Sigma-S0130)、盐酸氨基胍(美国Sigma公司),兔抗大鼠α-平滑肌肌动蛋白(α-SMA)抗体(Proteintech,批号00015168);兔抗大鼠结蛋白抗体(Santa,批号k0812);羊抗兔SP免疫组化染色试剂盒、DAB显色试剂盒、苏木素染液(福州迈新生物技术有限公司);TIMP1检测试剂盒(abcam,批号GR127277-1);TGF-β1测试盒(abcam,批号GR122868-1);TUNEL细胞凋亡原位检测试剂盒(南京凯基生物科技发展有限公司);大鼠晚期糖基化终末产物(AGEs)测试盒(武汉Uscnk公司,批号L130521573)。虎杖浸膏(浙江中医药大学制剂中心,1g/mL)。
2 实验方法
2.1 分 组 将60只SD大鼠随机分成正常对照组(10只)、高血糖模型组(12只)、NASH组(14只)、氨基胍组(12只)和虎杖组(12只)五组。
2.2 造 模 (1)链脲佐菌素(STZ)配制:A液:取柠檬酸2.10g加入双蒸水100mL;B液:柠檬酸钠2.94g加入双蒸水100mL;将A、B液1:1混合,调pH到4.2~4.5。使用时以柠檬酸缓冲液溶解STZ配制成浓度为1%的STZ溶液。(2)造模步骤:正常对照组喂以普通饲料,其余四组大鼠造模前1天禁食不禁水至少12h,一次性以65mg/kg进行腹腔注射链脲佐菌素,建模完成3周内每周测定血糖,以血糖值>16.7mmol/L为造模成功[7]。并予以高脂饮食(胆固醇2%,胆酸钠0.5%,丙硫氧嘧啶0.2%,蔗糖5%,猪油10%,基础饲料82.3%)饲养9周。
2.3 给 药 在喂养高脂饮食同时,氨基胍组予氨基胍(10mg/mL)1mL/100g灌胃;虎杖组予虎杖(1g生药/mL)1mL/100g灌胃;高血糖组、正常对照组、NASH组予等量0.9%氯化钠溶液灌胃。均为1天1次,共9周。
2.4 检测指标及方法
2.4.1 各组大鼠空腹血糖测定 采用血糖测试仪测定大鼠空腹血糖。前3周每周2次,高血糖模型建成后每周1次,共15次。
2.4.2 HE染色观察大鼠肝脏组织的病理学改变取肝组织:切片、烤片后二甲苯脱蜡;乙醇脱苯;染色:苏木精液染色5~10min,冲洗,1%盐酸乙醇分化,伊红染色;脱水;透明。封片:中性树胶封片后观察,拍照。
2.4.3 MASSON染色观察大鼠肝脏组织纤维化 切片、脱蜡。铁苏木素染色,流水冲洗,丽春红酸性品红液染5~10min,蒸馏水稍冲洗,1%磷钼酸水溶液处理约5min,苯胺蓝液复染;脱水、透明;封片:中性树胶封片;观察,拍照。
2.4.4 免疫组化法检测大鼠肝组织 α-SMA和Desmin的表达 制作切片石蜡切片经脱蜡、脱水,3%H2O2处理后置0.01M的枸橼酸缓冲液(pH6.0)中微波修复。羊血清工作液封闭后滴加依次滴加一抗和二抗。DAB反应染色,苏木素复染,干燥封片;观察、拍照。每张免疫组化切片观察3个不同的视野(× 400),统计阳性表达强度和阳性率。染色结果采用半定量分析方法:以染色强度结合阳性细胞数百分比进行乘积。染色强度以多数细胞呈现的染色强度并减去背景着色计分:0分:无明显着色;1分:淡黄色或轻微黄色;2分:深黄或棕黄色;3分棕褐色或黑褐色。阳性细胞百分比选择观察5个不同的视野(× 400),每个视野计数100个细胞中阳性细胞数,并统计平均数:0~5%为0分,6%~25%1分,26%~50%2分,51%~75%3分,>75%则为4分。然后用每个视野染色强度计分与阳性细胞百分比的乘积作为评分:0分为阴性(-),弱阳性为1~6分,7~12则算强阳性。
2.4.5 TIMP1检测 设置标准品孔、样本孔及空白孔。在标准孔中加入100μL梯度标准品,样本孔中加等量样本;将100μL的标记的检测抗体加入各孔,洗涤,甩干;每孔再加入100μL的HRP-链霉亲和素,加入TMB显色液100μL及50μL终止液,即刻检测在450nm波长下的OD值。
2.4.6 TGF-β1、AGE检测 具体操作依据试剂盒说明书进行,方法同上。
2.4.7 TUENL检测大鼠肝组织细胞凋亡率 制作切片石蜡切片脱蜡脱苯、漂洗后封闭;浸入1×PBS三次;滴加100μL Proteinase K工作液。制阳性片:滴加100μL DNaseⅠ反应液,浸入1×PBS三次(注:样本片和阴性片不加DNaseⅠ反应液);加50μL TdT酶,漂洗;标记、显色、复染后脱水;透明;封片;观察、拍照。根据阳性细胞分布情况,各个组别每张切片400倍镜下选择3个阳性视野,计数200个细胞中阳性细胞数作为凋亡指数。
2.5 统计学方法 应用SPSS15.0统计软件,计量资料以(±s) 表示,各组间比较采用单因素方差分析,两两比较采用LSD-t检验。
3 实验结果
实验结束,正常对照组10只存活8只,高血糖组12只,存活8只,NASH组14只存活7只,氨基胍组12只存活8只,虎杖组12只存活8只。
3.1 五组大鼠空腹血糖比较 与正常对照组比较,高血糖组和NASH组大鼠血糖均显著升高(P<0.01),与NASH组比较,两个用药组大鼠血糖值(P<0.05,P<0.01)。虎杖组与正常对照组血糖比较,差异无统计学意义(P>0.05)。见表1。
表1 五组大鼠血糖比较(mmol/L±s)

表1 五组大鼠血糖比较(mmol/L±s)
注:与正常对照组比较,**P<0.01;与NASH组比较,△P<0.05,△△P<0.01
3.2 五组大鼠血浆TIMP-1、TGF-β1、AGEs含量比较 与正常对照组比较,高血糖组和NASH组大鼠血浆AGEs含量、TGF-β1含量、TIMP1含量明显升高(P<0.05,P<0.01)。虎杖浸膏组大鼠血浆TGF-β1含量较NASH组显著降低(P<0.01),各治疗组大鼠血浆TIMP1、AGE含量比NASH组显著降低(P<0.05,P<0.01)。而氨基胍组与NASH组比较,TGF-β1含量虽有减低,但差异无统计学意义(P>0.05)。见表2。
表2 五组大鼠血浆TIMP-1、TGF-β1、AGEs含量比较(±s)
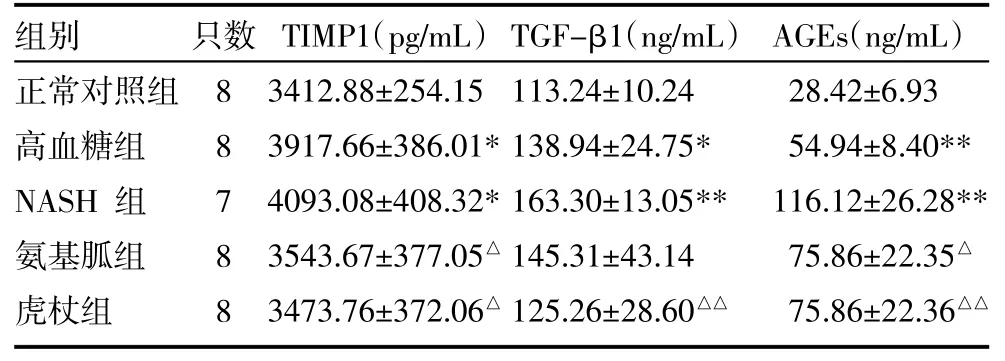
表2 五组大鼠血浆TIMP-1、TGF-β1、AGEs含量比较(±s)
注:与正常对照组比较,*P<0.05,**P<0.01;与NASH组比较,△P<0.05,△△P<0.01;TIMP1:基质金属蛋白酶组织抑制因子;TGF-β1:转化生长因子-β1;AGEs:糖基化终产物
3.3 肝细胞形态 显微镜下观察,正常对照组大鼠肝脏组织结构完整,肝小叶结构正常;NASH组大鼠肝细胞排列紊乱,肝组织结构破坏,肝细胞内库普弗细胞增多,汇管区及细胞间质内可见纤维组织增生,肝小叶周边和汇管区肝细胞可见明显的细胞坏死、水样变性、脂肪变性及炎细胞浸润;高血糖组大鼠部分肝细胞排列紊乱,无脂肪病变,局部可见较明显的细胞水样变性及炎细胞浸润,血管壁周围纤维组织增生较NASH组少;氨基胍组大鼠较NASH组肝组织形态未有明显改善,可见明显肝细胞坏死及炎细胞浸润,但细胞变性和纤维化程度有所减轻;虎杖组大鼠肝细胞形态较NASH组正常,只有轻度水肿、脂肪变性及炎细胞浸润,无明显细胞坏死,纤维化程度明显降低。见图1(封四)。
3.4 MASSON染色结果 显微镜下观察,胶原纤维呈蓝色,正常组肝脏纤维组织较少,主要分布在血管壁;高血糖组和NASH组纤维化严重(后者纤维化程度更重),血管壁周围和细胞间质内均可见纤维化,各给药组纤维化程度较高血糖组和NASH组明显减轻。见图2(封四)。
3.5 TUENL检测大鼠肝组织细胞凋亡率 见表3、图3(封四)。
表3 五组大鼠肝细胞凋亡指数比较(±s)
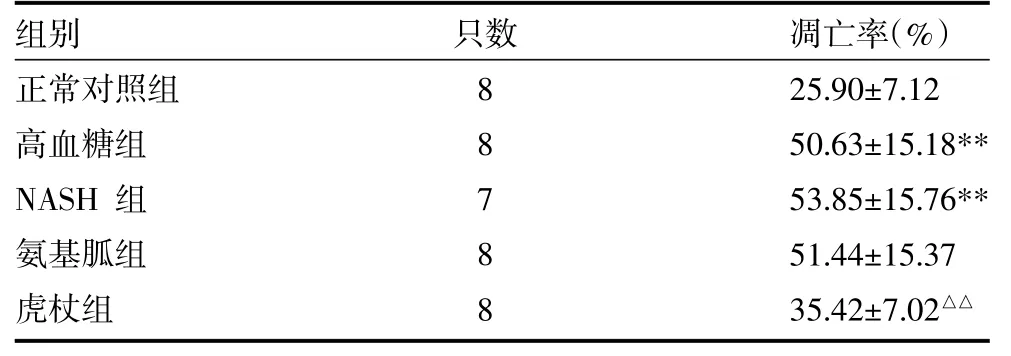
表3 五组大鼠肝细胞凋亡指数比较(±s)
注:与正常对照组比较,**P<0.001;与NASH组比较,△△P<0.01
只数组别正常对照组高血糖组NASH组氨基胍组虎杖组8 8 7 8 8凋亡率(%)25.90±7.12 50.63±15.18** 53.85±15.76** 51.44±15.37 35.42±7.02△△
3.6 六组大鼠肝组织α-SMA和Desmin表达比较阳性表达呈棕黄色或棕褐色,α-SMA主要表达于门静脉、汇管区血管壁、肝小叶中央静脉的平滑肌细胞及纤维间隔;Desmin主要表达于肝动脉、门脉周围及中央静脉边缘区的平滑肌细胞。NASH组α-SMA和Desmin表达显强阳性,氨基胍组α-SMA表达有所增高,但虎杖组α-SMA和Desmin表达有明显下降,且差异有统计学意义(P<0.01),见表4,图4~5(封四)。
表4 五组大鼠肝组织α-SMA和Desmin阳性表达比较(分,±s)

表4 五组大鼠肝组织α-SMA和Desmin阳性表达比较(分,±s)
注:与正常对照组比较,**P<0.01;与NASH组比较,△P<0.05,△△P<0.01。α-SMA:α-平滑肌动蛋白;Desmin:结蛋白
组别正常对照组高血糖组NASH组氨基胍组虎杖组例数8 8 7 8 8 α-SMA 3.17±0.82 6.33±1.83** 7.92±1.10** 9.00±2.04△4.92±1.69△△Desmin 3.50±1.56 7.67±2.10** 8.04±2.49** 8.08±1.82 4.75±1.75△△
4 讨论
肝脏是人体最容易发生纤维化病变的器官。肝纤维化的本质是肝组织ECM的沉积过多或降解减少的结果。ECM主要由肝星状细胞(HSC)合成,它的活化和增殖是肝纤维化发生的中心环节。当肝脏受到炎症等损伤时,HSC可由静止状态激活并分泌大量的基质金属蛋白酶抑制因子-1(TIMP-1),并分化为具有分泌性作用的“肌成纤维细胞”(MFC)[8],该细胞可以表达α-平滑肌动蛋白(α-SMA)、波形蛋白(vimentin)及结蛋白(desmin)。其中Desmin,α-SMA的含量是肝实质细胞和门脉区域HSC活化和门脉纤维母细胞活化的重要标志[9-10]。同时TIMP1合成及分泌使细胞外基质成分降解功能下降,加速肝纤维化。
实验结果显示,NASH组病理检测肝纤维化改变、细胞凋亡严重,提示过度的高脂饮食促进肝纤维化。高血糖模型组部分肝细胞结构排列紊乱,虽无脂肪变性,局部可见较明显的炎性反应及纤维组织增生、细胞凋亡率升高,但较NASH组少,可见在高血糖环境下大鼠肝脏组织已部分变性并出现纤维化,ECM表达及TIMP-1、α-SMA、TGF-β1、AGEs等相关细胞因子含量等均较正常对照组有升高。结果可能与蛋白质非酶糖化形成AGEs有关,AGEs与细胞膜表面受体RAGE发生交联,激活TGF-β1、IL-6等细胞因子,促使肝组织发生纤维化有关,同时时血糖增高时导致机体代谢功能障碍,活性氧物质(ROS)增加以及抗氧化机制受损,发生氧化应激反应,也可加重肝组织的损伤[11],导致肝脏纤维化的发生。
本研究采用的两种药物均有明显降低血糖的作用。虎杖可显著改善肝细胞脂肪变和纤维化程度,抑制肝细胞凋亡。在其干预后,α-SMA及Desmin表达下降。TGF-β1是肝纤维化过程中关键的细胞因子,在ECM堆积和肝纤维化的形成中起着关键作用,且其升高程度与肝纤维化呈正相关[12]。有报道[13]指出,肝星状细胞在受到刺激时合成的TGF-β1从基因水平可调控结缔组织生长因子(CTGF)诱导肝星状细胞激活、增殖与细胞外基质合成与沉积,还能抑制胶原降解。因此肝脏TGF-β1可反应HSC活化及肝纤维化的程度,降低血糖水平可能与此相关。本研究显示,虎杖组TGF-β1及TIMP-1表达较NASH组下降明显,且具有统计学意义(P<0.01)。已有研究显示,激活过氧化物酶体增殖物激活受体(PPAR-γ)配体-格列酮类增敏剂在降低血糖及减少AGEs时可以抑制HSC活化及预防实验性肝硬化,其机制与降低血糖水平减少AGEs产生有关[14],虎杖的相关作用可能也与此类似。虎杖还可减少TIMP-1的产生,改善ECM代谢平衡而抑制肝硬化。但是否有其他途径减轻肝纤维化的发生尚待进一步研究。
氨基胍组血糖降低的同时,虽然肝细胞坏死及炎细胞浸润、脂肪变性、水样变性和纤维化程度有所减轻,但组织在病理学结构上无明显改善。与NASH组相比,氨基胍可以明显降低血浆中AGEs的含量,但TGF-β1、及对细胞凋亡的抑制无统计学差异(P>0.05)。这与过氧化物酶体增殖物激活受体(PPAR-γ)增敏剂可早期抑制HSC活化,但纤维化发生后伴随着活化HSC的PPAR-γ表达能力下降,这类药物抗纤维化作用逐渐减少的报告结果一致[15]。体外研究证实糖基化修饰的牛血清白蛋白(AGE-BSA)含量增加,可促进基质金属蛋白酶(MMP1)表达的上调,从而下调TIMP-1表达[16]。本实验也证实氨基胍干预后,TIMP-1含量减少,与报道相符,可见氨基胍还可通过增强对胶原的降解能力,达到抗肝纤维化的目的。
综上所述,高血糖在大鼠肝纤维化发生、发展过程中起到一定的促进作用,经过降糖药物干预,实验大鼠血糖下降,AGEs形成减少,可改善肝纤维化程度。其中虎杖的作用比氨基胍更强,对高血糖合并NASH的治疗作用更为显著。
[1]夏菁,孙涛.非酒精性脂肪肝发病机制及治疗研究进展[J].海军总医院学报,2010,23(2):100-103.
[2] Hyogo H,Yamagishi S.Advanced glycation end products (AGEs)and their involvement in liver disease[J].Curr Pharm Des,2008,14(10):969-972.
[3]Alp H,Varol S,Celik MM,et al.Protective Effects of Beta Glucan and Gliclazide on Brain Tissue and Sciatic Nerve of Diabetic Rats Induced by Streptozosin[J].Exp Diabetes Res,2012,112(3):230-237.
[4]林玉桓,李晶.虎杖对α-葡萄糖苷酶的抑制作用[J].安徽农业科学,2010,38(17):8986-8988.
[5]Xia YL,Luo XF,Song K,et al.Study on the effects of Polygonum Cuspidate on TNF-αand PDGF in BALF of Pulmonary Fibrosis Rats[J].Chinese archives of traditional Chinese medicine,2010,28(1):43-47.
[6]谢灵璞.虎杖提取物对ConA诱导肝损伤小鼠保护作用的研究[J].海峡药学,2011,23(11):26-27.
[7]李聪然,游雪甫,蒋建东.糖尿病动物模型及研究进展[J].中国比较医学杂志,2005,15(1):59-63.
[8]Kornélia B,Renato VI,Ilona K,et al.Decorin-TGFβ Axis in Hepatic Fibrosis and Cirrhosis[J].J Histochem Cytochem,2012,60(4):262-268.
[9]张辉,张春斌,刘月霞.α-SMA和Desmin在大鼠肝纤维化中纤维母细胞的表达[J].黑龙江医药科学,2008,31 (2):1-2.
[10]Ping L,Liu H,Hang Y,et al.Expression of angiotensinogen during hepatic fibrogenesis and its effect on hepatic stellate cells[J].Med Sci Monit,2011,17(9):248-256.
[11]Daffu G,Del pozo CH,O'shea KM,et al.Radical Roles for RAGE in the Pathogenesis of Oxidative Stress in Cardiovascular Diseases and Beyond[J].Int J Mol Sci,2013,14 (10):19891-19910.
[12]张愚,屈文东,黄华.bFGF及TGF-β1在实验性肝硬化中的免疫组化研究[J].胃肠病学和肝病学杂志,2005,14 (1):40-44.
[13]Zhang C,Zhu Y,Wan J,et al.Effects of Ginkgo biloba extract on cell proliferation,cytokines and extracellular matrix of hepatic stellatecells[J].Liver Int,2006,26(10):1283-1290.
[14]Andrea G,Crabb DW,Elisabetta E,et al.Antibiabetic thiazolidinediones inhibit collagen synthesis and hepatic stellate cell activation in vivo and in vitro[J].Gastroenterology,2002,122(7):1924-1940.
[15]Farrell GC,George J,Hall PM,et al.Fatty liver disease;NASH and related disorders[M].Blackwell publishing,2004:89-302.
[16]Zhu P,Yang C,Chen LH,et al.Impairment of human keratinocyte mobility and proliferation by advanced glycation end products-modified BSA[J].Arch Dermatol Res,2011,303(5):339-350.
(收稿:2015-10-26 修回:2015-12-12)
Effects of Hyperglycemia on the Hepatic Fibrogenesis in Non-Alcoholic Steatohepatitis Rats
XIANG Biao,DU Weidong,XIA Chao,CHEN Shiming.Department of Hepatobilliary Surgery,Zhejiang Chinese Medical University,Hangzhou(310006),China
ObjectiveTo investigate the effects of hyperglycemia on hepatic fibrogenesis in nonalcoholic steatohepatitis(NASH)mice and theunderlying mechanism.MethodsSixty SD rats were randomly divided into normal control group(n=10),hyperglycemia group(n=12),NASH group(n=14),aminoguanidine group(n=12)and giant knotweed group(n=12).Rats were induced by streptozotocin(STZ)to establish copied hyperglycemiamodel,then were treated with the corresponding drugs for glucose-loweringintervention.Rats were sacrificed to observe the degree of hepatic steatosis,inflammation,necrosis and fibrosis of liver tissue with HE staining.The expression of α-SMA and desmin in liver tissues was determined by immunohistochemistry,The fibrosis-relevant factorslike tissue inhibitor of metalloproteinase-1(TIMP-1),transform growth factor β1(TGF-β1),advanced glycation end products (AGEs)were assayed.ResultsThe blood glucose in aminoguanidine and giant knotweed groups(14.20±11.74/ 5.25±0.92,mmol/L)was lower than that in hyperglycemia group(22.20±1.70mmol/L)and NASH group(22.21± 5.49mmol/L)(all P<0.05).Lives tissue from hyperglycemia group and NASH group showed cell degeneration and fibrogenesis,while the hepatic tissue in giant knotweed groupdisplayed a normal form,mild edema and fatty degeneration and inflammatory cell infiltration and markedly alleviatedhepatic fibrosis,and reduced α-SMA(4.92±1.69), desmin(4.75±1.75),TIMP-1(3473.76±372.06pg/mL),TGF-β1(125.26±28.60ng/mL),and AGEs(75.86±22.36pg/mL)(all P<0.01).The pathology of hepatic tissue in aminoguanidine group was not improved significantly,but the fatty degeneration,hydropic degeneration,and hepatic fibrosis were slightly alleviated,and TIMP-1(3543.67±377.05pg/ mL)and AGEs(75.86±22.35pg/mL)declined in content(P<0.01),α-SMA(9.00±2.04)increased(P<0.05),and TGF-β1(145.3±43.14ng/mL)reduced without statistical difference(P>0.05).ConclusionHigh blood sugar can promote the activation of hepatic stellate cells of nonalcoholic fatty liver disease and thereby accelerate liver-fibrogenesis in rats.To lower glucose and reduce AGEs may alleviate or inhibit the development of fibrogenesis.Giant knotweed has better effect on alleviation of hepatic fibrosis.
Rats;Hyperglycemia;Nonalcoholic steatohepatitis;Liver fibrosis;Giant knotweed;Aminoguanidine
浙江省自然科学基金(No.Y2100826)
浙江中医药大学附属第一医院肝胆外科(杭州 310006)
杜卫东,Tel:18658168571;E-mail:doctordu@sina.cn
