顺铂与XAV939联合应用对人肺癌细胞A549增殖、迁移能力的影响及机制
2016-02-07李翀韩燕燕郑旭吕艳兰福赵杰
李翀,韩燕燕,郑旭,吕艳,兰福,赵杰
(1天津中医药大学第一附属医院,天津300000;2天津中医药大学)
·论著·
顺铂与XAV939联合应用对人肺癌细胞A549增殖、迁移能力的影响及机制
李翀1,2,韩燕燕1,郑旭1,吕艳1,兰福1,赵杰1
(1天津中医药大学第一附属医院,天津300000;2天津中医药大学)
目的 观察顺铂联合端锚聚合酶抑制剂XAV939对人肺癌细胞增殖和迁移能力的影响,并探讨其机制。方法 将体外培养的人肺癌A549细胞分为空白对照组、顺铂组、XAV939组、顺铂+XAV939组,分别用1 μmol/L NaCl、0.002 g/L顺铂、1 μmol/L XAV939、0.002 g/L顺铂+1 μmol/L XAV939培养。用MTT法观察各组细胞增殖情况并计算细胞增殖抑制率;用细胞划痕实验和Transwell小室实验观察各组细胞迁移能力;用Western blotting法检测各组细胞中的WNT通路转录因子端锚聚合酶、β-连接素蛋白。结果 与对照组相比,顺铂组、XAV939组、顺铂+XAV939组细胞增殖抑制率高(P均<0.05),细胞迁移距离短(P均<0.05),穿膜细胞数少(P均<0.05),细胞中端锚聚合酶、β-连接素蛋白相对表达量低(P均<0.05);与顺铂组和XAV939组相比,顺铂+XAV939组细胞增殖抑制率高(P均<0.05),细胞迁移距离短(P均<0.05),穿膜细胞数少(P均<0.05),细胞中端锚聚合酶、β-连接素蛋白相对表达量低(P均<0.05)。结论 顺铂联合XAV939可以抑制人肺癌A549的增殖和迁移,且效果强于单用XAV939或顺铂。这可能与二者抑制WNT通路转录因子端锚聚合酶、β-连接素蛋白表达有关。
XAV939;顺铂;肺癌;细胞增殖;细胞迁移;WNT通路;端锚聚合酶;β-连接素
铂类为主的化疗是治疗晚期非小细胞肺癌的主要手段,但是耐药较多。端锚聚合酶在多数肿瘤中活性升高,是一种癌基因[1~5],也是是WNT信号通路的转录因子。XAV939是端锚聚合酶小分子选择性抑制剂,已用于治疗乳腺癌、大肠癌等多种肿瘤,疗效明显[6,7],但目前关于XAV939治疗非小细胞肺癌的报道较少,其机制亦不明确[8]。本研究观察了顺铂联合XAV939对人肺癌A549细胞增殖、迁移能力及WNT信号通路转录因子端锚聚合酶、β-连接素表达的影响,现报告如下。
1 材料与方法
1.1 材料 人肺癌A549细胞株由天津市人民医院张诗武主任馈赠。注射用顺铂冻干粉剂购自天津市中医药大学第一附属医院。XAV939购自美国Selleck公司(S1180)。RPMI1640培养基、胎牛血清购自美国HyClone公司。端锚聚合酶抗体购自美国Abcam公司,β-连接素抗体、β-actin抗体购自北京中杉金桥公司。 MTT购自美国Sigma公司。
1.2 A549细胞分组及用药方法 A549细胞加入含有10%胎牛血清的RPMI1640完全培养基中,置于37 ℃、5% CO2、饱和湿度培养箱内常规传代培养,取对数生长期细胞分为对照组、顺铂组、XAV939组和顺铂+XAV939组,分别用1 μmol/L NaCl、0.002 g/L顺铂、1 μmol/L XAV939、0.002 g/L顺铂+1 μmol/L XAV939培养。
1.3 各组A549细胞增殖情况观察 采用MTT法。各组细胞接种到96孔板,用药方法按照1.2进行,每孔200 μL,细胞密度2×104/mL,每组6个复孔,置于37 ℃培养箱内培养24、48 h时,加入10 μL MTT孵育4 h,离心弃上清,再加入150 μL DMSO。在酶联免疫检测仪上测定各孔490 nm波长处吸光度,计算各组A549细胞增殖抑制率。细胞增殖抑制率=(1-待测孔OD值/对照孔OD值)×100%。
1.4 各组A549细胞迁移能力观察 ①细胞划痕实验:将细胞按1×105/孔接种于6孔板,分组及用药方法按照1.2进行。待细胞长满单层后,用100 μL移液枪头在中间划一划痕, PBS洗去漂浮细胞,显微镜观察、拍照。各组加入含有相应药物的无血清RPMI1640培养基处理24 h,同一观察点处显微镜下再次观察、拍照。用Image-Pro Plus6.0软件测量划痕间距,两次划痕间距的差值为细胞迁移距离。②Transwell小室实验:Transwell小室不含有基质,胶纤维孔径为8 μm,下室中加入600 μL含10%胎牛血清的RPMI1640培养液,上室加入100 μL不含胎牛血清的各组培养基,然后在上室加入1×108/L的各组细胞悬液30 μL,置于37 ℃、5% CO2培养箱中培养72 h,取出滤膜,甲醇固定,Gimsa染色,显微镜下每张滤膜随机取5个视野(200×)计数穿膜细胞数,取平均数。
1.5 各组A549细胞中端锚聚合酶、β-连接素蛋白检测 采用Western blotting法。培养瓶内各组细胞PBS充分洗涤,吸干。于冰上加入细胞裂解液 (1 ml RIPA+10 μL PMSF混合液) 80 μL。刮刀挂下液体至1.5 mL EP管,4 ℃下12 000 r/min离心10 min。取上清1 μL用于测蛋白浓度。取等量蛋白样品,经10%、12.5%的SDS聚丙烯酰胺凝胶电泳转至PVDF膜,5%TBST的脱脂奶粉封闭非特异结合位点,加入一抗anti-端锚聚合酶(1∶400)、 anti-β-连接素(1∶1 000) 、anti-β-actin(1∶2 000),4 ℃孵育过夜。TBST充分洗膜,发光混合溶液A和B各1 mL浸泡PVDF膜1 min,洗尽残液,放入暗室,上附X线胶片,根据发光情况曝光胶片数秒到数分钟,冲洗胶片,拍照。

2 结果
2.1 各组细胞增殖抑制率比较 培养24、48 h各组细胞增殖抑制率见表1。由表1可见,与对照组相比,顺铂组、XAV939组、顺铂+XAV939组细胞增殖抑制率均增高(P均<0.05);与顺铂组和XAV939组相比,顺铂+XAV939组细胞增殖抑制率增高(P均<0.05)。
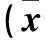
表1 不同时点各组细胞增殖抑制率比较±s)
注:与对照组相比,*P<0.05;与顺铂组相比,△P<0.05;与XAV939组相比,#P<0.05。
2.2 各组细胞迁移能力比较 各组细胞迁移距离和穿膜细胞数见表2。由表2可见,与对照组相比,顺铂组、XAV939组、顺铂+XAV939组细胞迁移距离短,穿膜细胞数少(P均<0.05);与顺铂组和XAV939组相比,顺铂+XAV939组细胞迁移距离短,穿膜细胞数少(P均<0.05)。
2.3 各组A549细胞中端锚聚合酶和β-连接素蛋白表达比较 各组A549细胞中端锚聚合酶和β-连接素蛋白相对表达量见表3。由表3可见,与对照组相比,顺铂组、XAV939组、顺铂+XAV939组端锚聚合酶和β-连接素蛋白相对表达量低(P均<0.05);与顺铂组和XAV939组相比,顺铂+XAV939组细胞端锚聚合酶和β-连接素蛋白相对表达量低(P均<0.05)。
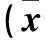
表2 各组细胞迁移距离和穿膜细胞数比较±s)
注:与对照组相比,*P<0.05;与顺铂组相比,△P<0.05;与XAV939组相比,#P<0.05。
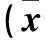
表3 各组A549细胞中端锚聚合酶和β-连接素蛋白相对表达量比较±s)
注:与对照组相比,P<0.05;与顺铂组相比,△P<0.05;与XAV939组相比,#P<0.05。
3 讨论
XAV939是端锚聚合酶的小分子选择性抑制剂和特异有效的Wnt/β-连接素信号通路阻滞剂[9,10]。XAV939可抑制端锚聚合酶1和端锚聚合酶2的聚腺苷二磷酸-核糖多聚酶(PARP)活性,上调轴蛋白活性,维持细胞内的动态稳定,加速β-连接素被磷酸化降解,从而阻滞Wnt/β-连接素信号通路,阻滞c-myc、cyclin D1、fra-1、c-jun等一系列癌基因的激活,最终抑制肿瘤的发生、发展。XAV939不同于端粒酶抑制剂,其除了对Wnt/β-连接素信号通路有较强抑制作用外,对核转录因子-κB、转化因子 或其他信号通路没有影响。因此其对肿瘤细胞具有选择性杀伤,对正常体细胞作用不大。近期实验已证实XAV939对A549细胞的抑制作用有明显的浓度依赖性和时间依赖性[8]。本研究结果显示,单独使用顺铂和XAV939均可抑制A549细胞增殖,但两种药物联合使用时对A549细胞的增殖抑制作用效果更明显。
肿瘤细胞的迁移是肿瘤转移的重要步骤,抑制肿瘤细胞迁移可以有效的控制肿瘤转移。本研究细胞划痕实验及Transwell小室实验结果均显示,顺铂和XAV939均可以减少A549细胞的迁移距离和穿膜细胞数,从而降低其迁移能力;两药联合应用对A549细胞迁移能力的抑制更加明显。这一结果与增殖实验结果相一致。
β-连接素作为Wnt/β-连接素通路的中心因子,对肿瘤的增殖、分化、凋亡等起重要作用[11,12]。其中一个重要功能就是参与E-钙黏蛋白介导的细胞与细胞间的黏附作用,而β-连接素的异常积蓄使E-钙黏蛋白失活,失去细胞黏附作用,使癌细胞呈浸润性、分散性生长[13]。本研究结果验证了XAV939不仅可以抑制A549细胞的增殖和迁移,还可以直接降低A549细胞中端锚聚合酶和β-连接素的表达。在此基础上,取顺铂和XAV939联合作用于A549细胞,结果显示,两种药物联合应用,A549细胞中端锚聚合酶和β-连接素表达下降更明显,提示顺铂、XAV939可能通过与端锚聚合酶 RARP结构域的结合,加速β-连接素被磷酸化降解,从而减少了β-连接素在细胞核/质的累积,进而抑制经典Wnt信号途径的激活,抑制肿瘤的发生、发展。
[1] Sun J, Huang H. Study on the expression of tankyrase in malignant hematopoietic cells and its relation with telomerase activity[J]. J Exp Hematol, 2004,12(1):11-15.
[2] Lu H, Lei Z, Lu Z, et al. Silencing tankyrase and telomerase promotes A549 human lung adenocarcinoma cell apoptosis and inhibits proliferation.[J]. Oncol Rep, 2013,30(4):1745-1752.
[3] Zhan ZL, Chong LI. Preliminary research on the effect of antisense oligodeoxynucleotides of tankyrase 1 on tumor growth following intratumoral injection in mice[J]. Chin J Tuber Resp Dis, 2004,27(9):604-607.
[4] Li M, Wang X, Jia T, et al. Tankyrase inhibitors attenuate WNT/β-catenin signaling and inhibit growth of hepatocellular carcinoma cells[J]. Oncotarget, 2015, 6(28):25390-25401.
[5] Busch AM, Johnson KC, Stan RV, et al. Evidence for tankyrases as antineoplastic targets in lung cancer[J]. Bmc Cancer, 2013, 13(1):122-129.
[6] Bao R. Inhibition of tankyrases induces axin stabilization and blocks wnt signalling in breast cancer cells[J]. PloS One, 2012, 7(11):3725-3744.
[7] Wu DW, Lin PL, Cheng YW, et al. DDX3 enhances oncogenic KRAS induced tumor invasion in colorectal cancer via the β catenin/ZEB1 axis[J]. Oncotarget, 2016,34(5):203-207.
[8] 李翀, 郑旭, 韩燕燕,等. 不同浓度XAV939对肺腺癌细胞增殖和迁移能力的影响[J].山东医药,2016,56(22):15-17.
[9] 李翀, 李谈, 战忠利. Tankyrase1反义核酸干预肺癌移植瘤生长的实验研究[J]. 中国肿瘤临床, 2010, 37(19):1089-1093.
[10] Huang SMA, Mishina YM, Shanming L, et al. Tankyrase inhibition stabilizes axin and antagonizes Wnt signaling[J]. Nature, 2009, 461(7264):614-620.
[11] Si W, Li Y, Shao H, et al. MiR-34a inhibits breast cancer proliferation and progression by targeting wnt1 in wnt/β-catenin signaling pathway[J]. Am J Med Sci, 2016,352(2):191-199.
[12] Liu XP, Liu SC,Chen J, et al. Baicalein suppresses the proliferation of acute T-lymphoblastic leukemia Jurkat cells by inhibiting the Wnt/β-catenin signaling[J]. An Hematol, 2016,95(11):1787-1793.
[13] 武健, 吴莺, 孟凡鲁,等. miR-200c通过wnt/β-catenin信号途径抑制SW480结肠癌细胞的侵袭和转移[J]. 江苏医药, 2014, 40(11):1260-1262.
Effects of cisplatin combined with XAV939 on proliferation, migration and transcription factor expression in WNT pathway of human lung cancer A549 cells
LIChong1,HANYanyan,ZHENGXu,LYUYan,LANFu,ZHAOJie
(1FirstTeachingHospitalofTianjinUniversityofTraditionalChineseMedicine,Tianjin300000,China)
Objective To observe the effects of cisplatin combined with tankyrase small molecule inhibitor XAV939 on the proliferation and migration of human lung cancer A549 cells and to investigate the mechanism. Methods The human lung cancer A549 cells were divided into the blank control group (treated with 1 μ mol/L NaCl), cisplatin group (treated with 0.002 g/L), XAV939 group (treated with 1 μ mol/L), and cisplatin+XAV939 group (treated with 0.002 g/L cisplatin+1 μ mol/L XAV939). The cell proliferation and proliferation inhibitory rates in each group were assessed by MTT assay. The cell migration ability was detected by Scratch test and Transwell chamber assay. Then, the protein expression of tankyrase and β-catenin was detected by Western blotting, respectively. Results Compared with the control group, the proliferation inhibitory rates of cells was higher, the cell migration distance was shorter, the number of transmembrane cells was less, and the protein expression of β-catenin and tankyrase was lower in the cisplatin group, XAV939 group, and cisplatin+XAV939 group (allP<0.05). Compared with the cisplatin and XAV939 group, the proliferation inhibitory rate of the cisplatin +XAV939 group was higher, the cell migration distance was shorter, the number of transmembrane cells was less, and the protein expression of β-catenin and tankyrase was lower (allP<0.05). Conclusions Cisplatin combined with XAV939 may inhibit the proliferation and migration abilities of A549 cells and the combined effect is more powerful that of XAV939 or cisplatin alone. This effect may be correlated with the inhibition of β-catenin expression and tankyrase expression.
XAV939; cisplatin; lung carcinoma; cell proliferation; cell migration; WNT pathway; tankyrase; β-catenin
天津市卫生局科技基金资助项目(2014KZ130)。
李翀(1974-),女,硕士,副主任医师,主要研究方向为肿瘤病理学。E-mail: lc740922@163.com
10.3969/j.issn.1002-266X.2016.47.001
R323.2
A
1002-266X(2016)47-0001-03
2016-08-11)
