农药多菌灵的迁移转化规律研究
2016-02-06任小慧王帅杰杨红侠邢丽飞
贺 君,任小慧,王帅杰,杨红侠,邢丽飞,李 飞
(1.燕山大学 环境化学工程学院,河北 秦皇岛 066004; 2.燕山大学 机械工程学院,河北 秦皇岛 066004)
农药多菌灵的迁移转化规律研究
贺 君1,任小慧1,王帅杰1,杨红侠1,邢丽飞1,李 飞2
(1.燕山大学 环境化学工程学院,河北 秦皇岛 066004; 2.燕山大学 机械工程学院,河北 秦皇岛 066004)
通过高效液相色谱法测定多菌灵的含量,初步探讨其挥发、水解、光解、分配这几种迁移转化途径,为合理利用农药、治理及控制农药对土壤等生态环境的污染提供指导。结果表明:多菌灵挥发作用不明显;pH值对多菌灵水解作用有影响,pH值为12时其水解率最大,达到0.16%,但总体上降解也不明显。采用太阳光、紫外灯、高压汞灯3种光源对多菌灵进行光降解,其中无氧化基团的情况下,太阳光基本不促进多菌灵降解,紫外灯下光解率达到3.73%,高压汞灯下达到4.96%;在有氧化基团时,无光照条件下降解率达到11.65%,太阳光下达到23.15%,紫外灯下达到61.61%,高压汞灯下达到94.97%,降解速率大小表现为高压汞灯>紫外灯>太阳光>无光照,高于无氧化基团情况下的光降解。多菌灵的吸附率与土壤及腐植酸的含量呈正相关,在设置试验条件下分别可达到10.11%和90.89%。因此,光降解和土壤分配作用是多菌灵迁移转化的2种主要途径。
多菌灵; 挥发; 水解; 光解; 分配
粮食是国家生存和发展的根本,为了提高各种粮食的产量和农产品的质量,我国自20世纪40年代以来,开始大量使用各种类型的农药。由于缺乏安全使用农药的知识和意识,造成农药的超剂量和超范围使用,不仅导致农药在各种农作物上的残留严重超标,而且直接污染了土壤,并通过地表径流进一步污染地表水与地下水[1]。多菌灵属于氨基甲酸酯类农药,是工农业上常用的杀菌剂品种,与其他高毒高残留的农药相比是一种比较有前途的农药[2],近年来其用量和产量均呈上升的趋势,并且已经在国内外被广泛应用[3]。
多菌灵,又名棉萎丹、棉萎灵、苯并咪唑44号等,英文通用名为carbendazim,化学名称为N-(2-苯并咪唑基)氨基甲酸甲酯,分子式为C9H9N3O2。多菌灵是一种广谱内吸性杀菌剂,高效低毒,持效期较长,广泛用于果树、花卉、蔬菜及大田农作物病害的防治。然而多菌灵不易降解,在环境中残留期较长,会对大气、土壤、水体等造成污染。残留于土壤中的多菌灵可被植物吸收,通过食物链威胁到动物和人体健康[4-7]。
本研究通过高效液相色谱法[8-9]测定多菌灵的含量,初步探讨了挥发[10]、水解[11]、光解[12-13]、分配[14-15]这几种迁移转化途径,对于合理利用农药,治理及控制农药对土壤等生态环境的污染,发展可持续农业具有重要的指导意义。
1 材料和方法
1.1 材料和仪器
材料:多菌灵标准品;甲醇、乙腈(色谱纯);氢氧化钠、磷酸、盐酸、磷酸二氢钠、磷酸氢二钠、过氧化氢(分析纯);土壤样品(室外采集,风干,过0.150 mm筛);腐植酸(化学纯)。
仪器:Agilent 1200液相色谱仪(美国安捷伦公司);JJ-4六联数显电动搅拌器(常州未来仪器制造有限公司);HJ-5多功能搅拌器(江苏金坛市环宇科学仪器厂);50 W紫外灯(北京亚明电光源发展公司);250 W高压汞灯(佛山电器照明股份有限公司);PHS-4型智能酸度计(江苏江分电分析仪器有限公司);JJ124BC型精密电子天平(常熟市双杰测试仪器厂);TDL-50B低速离心机(上海安亭科学仪器厂)。
1.2 试验方法
1.2.1 多菌灵的高效液相色谱法检测 选用二极管列阵检测器(DAD)进行多菌灵的检测,方法参照GB/T23380—2009《水果、蔬菜中多菌灵残留的测定高效液相色谱法》。
1.2.1.1 色谱条件 色谱柱:C18柱(4.6 mm×250 mm,5 μm);流动相:磷酸盐缓冲溶液(0.02 mol/L,pH值6.8)+乙腈(80%),使用前经0.45 μm滤膜过滤;流速:1.0 mL/min;检测波长:286 nm;进样量:40 μL。
1.2.1.2 多菌灵的定量 配制质量浓度为0.15 g/L的标准工作溶液,稀释成5、10、15、20、25、30 mg/L的系列溶液,分别取40 μL进样分析,以保留时间为依据进行定性,以峰面积对标准溶液的质量浓度制作标准曲线,对样品进行定量。
1.2.2 多菌灵挥发特性研究
1.2.2.1 时间变量 取0.15 g/L的工作溶液于烧杯中,稀释到30 mg/L,100 r/min条件下搅拌3 h,分别在10、20、30、40、50、60、80、100、120、150、180 min时取样,分析多菌灵含量的变化。
1.2.2.2 转速变量 取0.15 g/L的工作溶液于烧杯中,稀释到30 mg/L,分别在100、150、200、250、300、350、400 r/min条件下搅拌1 h后取样,分析多菌灵含量的变化。
1.2.3 多菌灵水解特性研究 取0.15 g/L的工作溶液于烧杯中,稀释到30 mg/L,调节pH值分别为4~12,于100 r/min条件下搅拌1 h后取样,分析多菌灵含量的变化。
1.2.4 多菌灵光解特性研究
1.2.4.1 无氧化基团情况下 取100 mL 0.15 g/L的工作溶液于烧杯中,稀释到30 mg/L,分别在太阳光、紫外灯、高压汞灯条件下以100 r/min搅拌3 h,在10、20、30、40、50、60、80、100、120、150、180 min时取样,分析多菌灵含量的变化。
1.2.4.2 有氧化基团情况下 取100 mL 0.15 g/L的工作溶液于烧杯中,稀释到30 mg/L,加入15 mL 0.36%的H2O2溶液模拟水中的氧化基团,混匀。分别于无光照、太阳光、紫外灯、高压汞灯条件下以100 r/min搅拌3 h,在10、20、30、40、50、60、80、100、120、150、180 min时取样,分析多菌灵含量的变化。
1.2.5 多菌灵分配作用研究
1.2.5.1 不同的土壤含量 取100 mL 0.15 g/L的工作溶液于5个烧杯中,稀释到30 mg/L,分别加入0.2、0.4、0.6、0.8、1.0 g的土壤样品,于100 r/min条件下搅拌1 h,低速离心机离心后取上清液,分析多菌灵含量的变化。
1.2.5.2 不同的腐殖质含量 取100 mL 0.15 g/L的工作溶液于5个烧杯中,稀释到30 mg/L,均加入0.1 g的土壤样品,然后分别加入0.2、0.4、0.6、0.8、1.0 g的腐植酸,于100 r/min条件下搅拌1 h,低速离心机离心后取上清液,分析多菌灵含量的变化。
1.2.6 计算方法
1.2.6.1 降解率 降解率用来表示降解程度的大小,其计算公式如下:
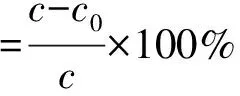
(1)
式中:c—有机物浓度,c0—有机物初始浓度。
1.2.6.2 降解速率常数 有机物的降解符合一级反应动力学,公式为:
(2)
式中:c—有机物浓度,t—降解时间,K—降解速率常数。
式(2)积分得:
(3)
式中:c0—有机物初始浓度,c—时间为t时测得的有机物浓度,K—降解速率常数。
2 结果与分析
2.1 多菌灵标准曲线的绘制
多菌灵的保留时间为6.568 s,标准曲线如图1所示,方程为:y=4.431 94x+19.001 67(其中x表示多菌灵质量浓度,y表示峰面积),相关系数为0.997 69。
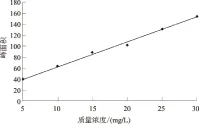
图1 多菌灵标准曲线
2.2 多菌灵挥发特性
2.2.1 时间变量 由图2可以看出,随时间的延长,多菌灵挥发率逐渐增大,但是总体变化很小,180 min仅为0.004%。
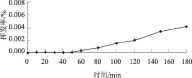
图2 时间对多菌灵挥发率的影响
2.2.2 转速变量 由图3可以看出,随转速的增加,多菌灵挥发率逐渐增大,但是总体变化很小,最高转速时仅为0.004%。由此可见,挥发作用不是多菌灵迁移转化的主要途径。
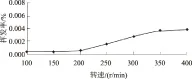
图3 转速对多菌灵挥发率的影响
2.3 多菌灵水解特性
多菌灵含量在酸性和碱性条件下有所降低,中性条件下基本没有变化,其中pH值为12时水解率最大,达到0.16%(图4)。
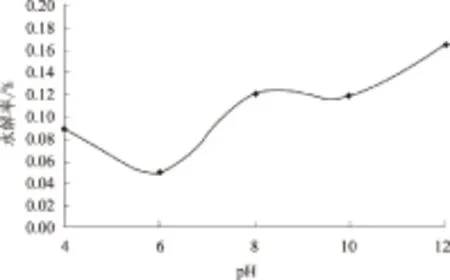
图4 pH值对多菌灵水解率的影响
2.4 多菌灵光解特性
2.4.1 无氧化基团情况下 由图5、6可以看出,太阳光条件下,多菌灵含量随时间的延长基本稳定,说明在无氧化基团情况下,太阳光对多菌灵含量的变化基本没有影响。
紫外灯条件下,多菌灵含量随时间的延长逐渐降低,光解率逐渐增大,1 h左右基本稳定,达到3.73%。在其含量降低的范围内,多菌灵光解速率方程为:y=0.000 6x+0.001 8,光解速率常数为0.000 6 min-1。
高压汞灯条件下,多菌灵含量随时间的延长逐渐降低,光解率逐渐增大,同样1 h左右基本稳定,达到4.96%。在其含量降低的范围内,多菌灵光解速率方程为:y=0.000 9x+0.000 05,光解速率常数为0.000 9 min-1。
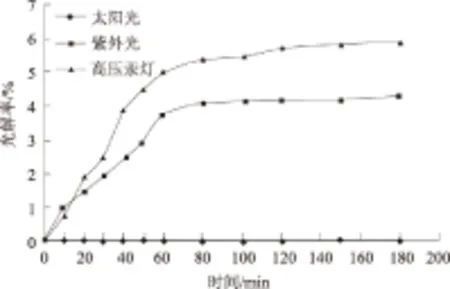
图5 无氧化基团情况下多菌灵的光解效果
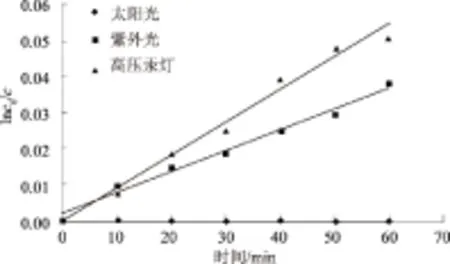
图6 无氧化基团情况下多菌灵光解速率常数拟合
2.4.2 有氧化基团情况下 由图7、8可以看出,无光照条件下,多菌灵含量随时间的延长逐渐降低,光解率逐渐增大,1 h左右基本稳定,达到11.65%。说明天然水体中的氧化基团有利于多菌灵的光解。在其含量降低的范围内,多菌灵光解速率方程为:y=0.001 8x+0.030 9,光解速率常数为0.001 8 min-1。
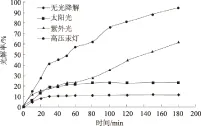
图7 有氧化基团情况下多菌灵的光解效果
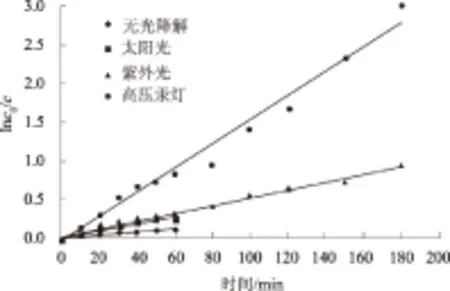
图8 有氧化基团情况下多菌灵光解速率常数拟合
太阳光条件下,多菌灵含量随时间的延长逐渐降低,光解率逐渐增大,1 h左右达到23.15%,然后基本保持稳定。在其含量降低的范围内,多菌灵光解速率方程为:y=0.004 2x+0.031 9,光解速率常数为0.004 2 min-1。
紫外灯条件下,多菌灵含量随时间的延长逐渐降低,光解率逐渐增大,180 min达到61.61%,且有继续增长的态势。多菌灵光解速率方程为:y=0.005 0x+0.039 7,光解速率常数为0.005 0 min-1。
高压汞灯条件下,多菌灵含量随时间的延长逐渐降低,光解率逐渐增大,180 min达到94.97%,且有继续增长的态势。多菌灵光解速率方程为:y=0.015 6x-0.033 2,光解速率常数为0.015 6 min-1。
2.5 多菌灵分配作用
2.5.1 不同的土壤含量 由图9可以看出,土壤含量的增加能增强多菌灵的迁移性,多菌灵的吸附率与土壤含量呈正相关,最高可达到10.11%。说明土壤分配作用是多菌灵迁移转化的途径之一。
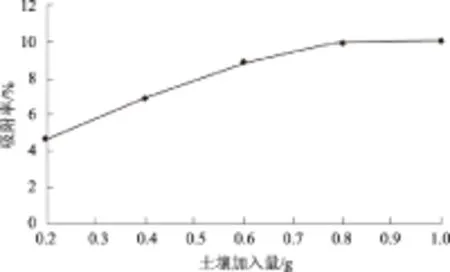
图9 土壤含量对多菌灵土壤分配作用的影响
2.5.2 不同的腐殖质含量 由图10可以看出,腐植酸的含量对多菌灵在土壤中的分配作用有很大的影响。多菌灵含量随腐植酸含量的增大逐渐降低,吸附率逐渐增大,最高可达到90.89%。腐植酸是天然土壤的主要成分之一,说明多菌灵在土壤中的分配作用和土壤组成有密切关系。
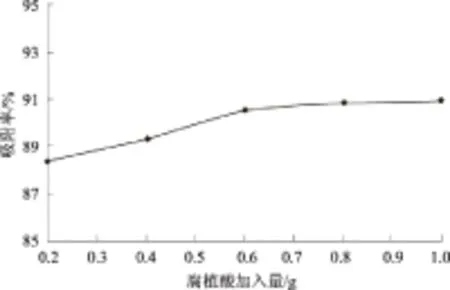
图10 腐植酸含量对多菌灵土壤分配作用的影响
3 结论与讨论
挥发试验结果表明,多菌灵挥发率随时间的延长和转速的增大而增加,最终可达到0.004%,变化较小。说明挥发作用不是多菌灵迁移转化的主要途径。
水解试验结果表明,多菌灵含量在酸性和碱性条件下有所降低,中性条件下基本没有变化,其中pH值为12时,水解率最大,可达到0.16%。说明水解作用是多菌灵迁移转化的途径之一。
光解试验结果表明,在无氧化基团时,太阳光基本不促进多菌灵降解,紫外灯条件下多菌灵光解率可达到3.73%,高压汞灯条件下可达到4.96%;在有氧化基团时,无光照条件下多菌灵光解率可达到11.65%,太阳光条件下可达到23.15%,紫外灯条件下可达到61.61%,高压汞灯条件下可达到94.97%,光解速率大小表现为高压汞灯>紫外灯>太阳光>无光照,高于无氧化基团情况下的光解速率。说明光解作用是多菌灵迁移转化的主要途径之一,且水中存在的氧化基团有利于光降解的进行。
分配试验结果表明,多菌灵的吸附率与土壤含量呈正相关,本试验条件下最高可达到10.11%;土壤中的腐植酸能增加多菌灵的迁移性,使吸附率逐渐增大,可达到90.89%。说明土壤分配作用也是多菌灵迁移转化的主要途径之一。
[1] 鞠铭炜,仇建飞,王玉军.不同pH值的淋溶液对土壤中多菌灵的影响[J].科技信息,2012(5):44,38.
[2] 张辉,刘广民,姜桂兰,等.农药在土壤环境中迁移转化规律的研究现状与展望[J].世界地质,2000,19(6):199-208.
[3] 周立敏,杨桂朋,胡立阁,等.多菌灵在水体系中的光化学降解研究[J].海洋环境科学,2008,27(2):153-156.
[4] 朱良天.农药[M].北京:化学工业出版社,2004:293-295.
[5] 陈仪本,欧阳友生,黄小茉.工业杀菌剂[M].北京:化学工业出版社,2001:341-433.
[6] 赵静.毒死蜱、多菌灵在杭白菊及其土壤中的残留动态研究[D].杭州:浙江大学,2013.
[7] 王军玲.多菌灵高效降解菌的筛选及降解特性的研究[D].杨凌:西北农林科技大学,2010.
[8] 刘承兰,刘丰茂,李莉.高效液相色谱法测定芦笋中多菌灵和吡虫啉残留[J].农药学学报,2004,6(4):93-96.
[9] Crescenzi C,Corcia A D,Guerriero E,etal.Development of a multiresidue method for analyzing pesticide traces in water based on solid-phase extraction and electrospray liquid chromatography mass spectrometry[J].Environ Sci Technol,1997,31(2):479-488.
[10] 刘妙丽.水中苯和甲苯挥发速率的研究[J].四川师范大学学报(自然科学版),2007,30(5):660-662.
[11] 欧晓明.农药在环境中的水解机理及其影响因子研究进展[J].生态环境,2006,15(6):1352-1359.
[12] 徐宝才,岳永德,胡颍蕙,等.多菌灵的光化学降解研究[J].环境科学学报,2000,20(5):616-620.
[13] Jornet D,Castillo M A,Sabater M C,etal.Photodegradation of carbendazim sensitized by aromatic ketones[J].Journal of Photochemistry and Photobiology A(Chemistry),2013,256:36-41.
[14] Paszko T.Adsorption,degradation and mobility of carbendazim in profiles of Polish mineral soils[J].Geoderma,2014,226/227:160-169.
[15] 孙佳为.氟硅唑和多菌灵在橘园环境中持久性及对土壤微生态影响[D].长沙: 湖南农业大学,2010.
Research on Migration and Transformation Rule of Carbendazim
HE Jun1,REN Xiaohui1,WANG Shuaijie1,YANG Hongxia1,XING Lifei1,LI Fei2
(1.School of Environmental and Chemical Engineering,Yanshan University,Qinhuangdao 066004,China; 2.College of Mechanical Engineering,Yanshan University,Qinhuangdao 066004,China)
By high performance liquid chromatography(HPLC) method for determining the content of carbendazim,the migration transformation ways of carbendazim including volatilization,hydrolysis,photolysis and distribution were discussed.The results showed that carbendazim volatilization was not obvious.pH had an effect on hydrolysis,and when the pH was 12,the largest degradation rate of 0.16% was obtained,indicating that carbendazim hydrolysis was also not obvious.Sunlight,ultraviolet lamp,and high-pressure mercury lamp were used as light sources to photodegrade carbendazim,without oxidation groups in solution,sunlight basically did not promote carbendazim degradation,while ultraviolet lamp and high-pressure mercury lamp resulted in degradation rate of 3.73% and 4.96%,respectively.With oxidation groups in solution,the degradation rate reached 11.65% without light conditions,and reached 23.15%,61.61%, 94.97% under sunlight,ultraviolet lamp,high-pressure mercury lamp,respectively.The photodegradation rate showed high-pressure mercury lamp > ultraviolet lamp > sunlight > no light,all higher than that without oxidation groups.Carbendazim adsorption rate was positively correlated with the content of soil and humic acid,and could reach 10.11% and 90.89% respectively in this experiment.So photodegradation and distribution are two main transformation and migration ways of carbendazim.
carbendazim; volatilization; hydrolysis; photolysis; distribution
2016-04-13
河北省科技支撑计划项目(15273613)
贺 君(1978-),男,河北秦皇岛人,副教授,硕士,主要从事环境化学研究。E-mail:hejun@ysu.edu.cn
S482.2;X131
A
1004-3268(2016)10-0080-05
