三维计算机断层血管造影在诊断老年术后残余或复发性动脉瘤中的价值
2016-01-28卢桂花阮玉山廖兴胜肖绍文
严 峻 卢桂花 阮玉山 廖兴胜 罗 昱 肖绍文
(广西医科大学第一附属医院神经外科,广西 南宁 530021)
三维计算机断层血管造影在诊断老年术后残余或复发性动脉瘤中的价值
严峻卢桂花阮玉山廖兴胜罗昱肖绍文
(广西医科大学第一附属医院神经外科,广西南宁530021)
摘要〔〕目的比较三维计算机断层血管造影(3D-CTA)与当前的“金标准”数字减影造影术(DSA)在术后残余或复发性动脉瘤诊断中各自准确性。方法对56例行开颅动脉瘤夹闭术的老年患者进行3D-CTA检查,用ROC曲线来比较3D-CTA与DSA的诊断性能。 结果56例老年患者中有69个动脉瘤被发现, DSA检测到8个残余脑动脉瘤,3D-CTA检测到7个残余脑动脉瘤。3D-CTA的敏感性和特异性为81.25%和97.92%,准确度为95.54%。ROC曲线下面积(AUC)是0.928,ROC分析发现3D-CTA诊断性能好。 结论研究认为3D-CTA可作为老年病人术后残余动脉瘤检测的替代方式。3D-CTA的敏感性和特异性能够十分接近传统DSA检测方法。3D-CTA作为一种性价比高、非侵入性的方法,非常适用于老年病人,对初始和长期评估残余动脉瘤可以替代DSA的检出手段。
关键词〔〕残余脑动脉瘤(RA);三维计算机断层血管造影;数字减影血管造影
第一作者:严峻(1978-),男,在读博士,主治医师,主要从事脑血管病的解剖及临床应用研究。
传统的数字减影血管造影(DSA)一直被视为评价残余或复发性动脉瘤的“黄金标准”。然而,作为一种筛选方法DSA不但有创伤性而且耗时〔1〕。且给老年病人带来众多并发症。三维计算机断层血管造影(3D-CTA)已被广泛应用于老年脑动脉瘤术前评价当中〔2〕。研究指出,3D-CTA诊断精度可与DSA相比,尤其是在中型动脉瘤(> 3 mm)〔3〕诊断。在一些医疗中心,术前评估脑动脉瘤,3D-CTA已经取代DSA〔4〕。很少有文章报道用3D-CTA评价开颅术后的老年动脉瘤患者,在用钛夹夹闭动脉瘤的老年患者中,3D-CTA被认为是非常有价值的方案〔5,6〕。 本研究使用ROC来在检测残余或复发的脑动脉瘤,以确定3D-CTA诊断的准确性。
1资料与方法
1.1一般资料自 2009 年 3 月至 2013年 7月,广西医科大学第一附属医院神经外科收治的56例行开颅动脉瘤夹闭术的老年患者,男 24 例,女 32例,年龄 60~82 岁,平均 74.15 岁。所有老年患者都接受外科手术使用钛合金动脉瘤夹(目前钛动脉瘤夹;Aesculap AG,Tuttlingen、德国)。
1.2入选标准所有开颅动脉瘤夹闭术后的老年病人均行 3D-CTA、DSA病例。年龄≥60岁。排除标准:行 3D-CTA 或 DSA 检查失败者。
1.3检查时间31个患者在手术后1个月内进行DSA和3D-CTA检查,14例病人在手术后1年内进行该检查,11例患者在手术后5年以后进行该检查。3D-CTA及DSA检查,所有获得的3D-CTA后处理图像、DSA图像分别由两位放射科医生和两位神经外科医师用双盲法进行分析。
1.4检查方法
1.4.13D-CTA检查使用GE Light Speed 64 VCT机扫描机及GE AW4.3或4.4工作站。扫描参数:管电压120 kV,管电流300 mA,螺距1.375∶1,扫描层厚0.625 mm,扫描速度0. 4 s/周。扫描范围从颅顶至颅底下5 cm,先行颅脑平扫,然后用高压注射器经前臂静脉团注非离子型对比剂65 ml(优维显370 mg/ml),注射完后注入生理盐水20 ml,然后注射速率:4~5 ml/s,重建间隔0.625 mm,所得数据传AW4.3及AW4.4工作站,行多平面重建最大密度投影(MIP)、多平面重建(MPR)及容积再现(VR或VRT)等。
1.4.2DSA检查检查使用荷兰PHILIPS公司v5000型数字减影血管造影机。经股动脉,采用Seldinger技术穿刺、于股动脉置入5F导管鞘,造影管选用TEMPO 5F(CORDIS CORPORATION)造影管,常规行双侧颈内动脉及双侧椎动脉造影,采用非离子型造影剂碘普罗胺370注射液 (370 mg/ml),颈内动脉流率3 ml/s总量6~8 ml,椎动脉流率2~4 ml/s总量5 ml。摄正、侧位片及斜位片必要时加摄汤氏位片。
1.5图像分析
1.5.1图像评价图像分析3D-CTA所有原始图像后处理均采用容积重建、曲面重建和薄层块最大密度投影技术进行分析,所获得的3D-CTA图像及DSA影像均由两位神经外科医师和两位放射科医师按双盲原则分析。首先,判断3D-CTA辨别外科动脉瘤夹和血管主干的能力,根据“三点法”来评价(即:和血管主干完全分离为“好”,部分分离和(或)重叠一个血管主干为“一般”,动脉瘤夹和血管主干交织在一起并有金属伪影为“差”)。
1.5.2动脉瘤瘤颈宽度测量对动脉瘤瘤颈宽度分别在3D-CTA 和DSA图像上进行测量。测量方法为,同一动脉瘤以DSA所选图像为基础,在3D-CTA图像中选取同样投照(重建)位置,分别测量DSA、3D-CTA中瘤颈大小。3D-CTA、DSA图像的处理及分析由两组医师每组2位分别对3D-CTA、DSA图像独立判读。
1.6统计学方法应用Medcal 软件对影像资料进行ROC 曲线分析,用ROC 曲线下面积(AUC)的大小证明诊断试验准确度〔7〕。根据影像诊断评价的ROC 曲线原理,使用等级划分法,用一系列的信任等级表示图像的阴阳性,即医生对同一幅图像可给出不同级别的诊断。动脉瘤残余评估的依据是五点信誉标准,评分值1肯定有残留,2可能有残留,3待定,4可能无残留,5肯定无残留。以前4个诊断标准为诊断节点,对于剩余的作为阴性诊断,列出4个四格表并算出灵敏度和特异度,以特异度为横坐标,灵敏度为纵坐标画出ROC 曲线。ROC分析检测3D-CTA与DSA诊断性能。ROC曲线下的面积计算。计算了敏感性和特异性〔95%置信区间(CI)〕。5分被接受为阴性,判断为无残余动脉瘤。使用kappa统计来了解观察者间作出诊断的相互符合程度,以确保每个参加研究观察者的经验和专业水平接近,使每个观察者间的诊断达到相对较高的一致性。
2结果
2.1DSA与3D-CTA检测结果DSA在56个夹闭术后的动脉瘤中发现了共有8个残留及复发性动脉瘤(14%)。3个动脉瘤是位于前交通动脉,2个在基底动脉和3个在大脑中动脉。8个残留复发性动脉瘤中,1个直径7 mm,4个直径3~5 mm,3个直径不到3 mm。剩余的48个动脉瘤(84%)是完全闭合的。3D-CTA图像的质量“好”或者“一般”有53例病人(95%);3例患者(5%)图像质量较差。其中1例患者是有两个夹闭的动脉瘤彼此靠近对方是(其中1例是颈内动脉和后交通动脉之间)。其他2个是两个巨大的大脑中动脉动脉瘤治疗,每动脉瘤使用3个动脉瘤夹。在3D-CTA图像上有2个瘤颈被阅片者错过,1个是尺寸非常小的后交通动脉瘤,1个是靠近颅底的颈内动脉分叉处动脉瘤,3D-CTA显示1个残留囊的假阳性结果,被DSA所证实。3D-CTA在残余或复发性动脉瘤上确认的最小尺寸是2.5 mm。3D-CTA检测残留复发性动脉瘤的敏感性和特异性为81.25% (95%CI:52.9%~97.8%)和97.92%(95%CI:86.5%~99.5%),准确度为95.54%。ROC分析发现3D-CTA诊断性能好。AUC是0.928。
不同医师诊断结果具有较好的一致性(Kappa=0.874,P=0.000)。对双源CTA和CTA两种方法进行一致性Kappa检验显示,双源CTA在动脉瘤诊断方面与金标准DSA有较好的吻合性(Kappa=0.835,P=0.000);两种方法进行χ2检验显示,两种方法对动脉瘤的诊断差异无统计学意义(P=1.000)。
2.2ROC 曲线分析根据影像诊断评价的ROC 曲线原理,列出4 个四格表并算出灵敏度和特异度,以特异度为横坐标,灵敏度为纵坐标画出ROC 曲线。见图1。
应用5 等级法进行评估,DSA结果为8例作确诊残余动脉瘤,48例确诊阴性未发现动脉瘤,3D-CTA对动脉瘤术前评估AUC=0.928,DSA对动脉瘤术前评估AUC=1. 000,P=0.097,说明DSA在诊断残余动脉瘤方面和3D-CTA水平相当,差异无显著性,可以代替DSA。
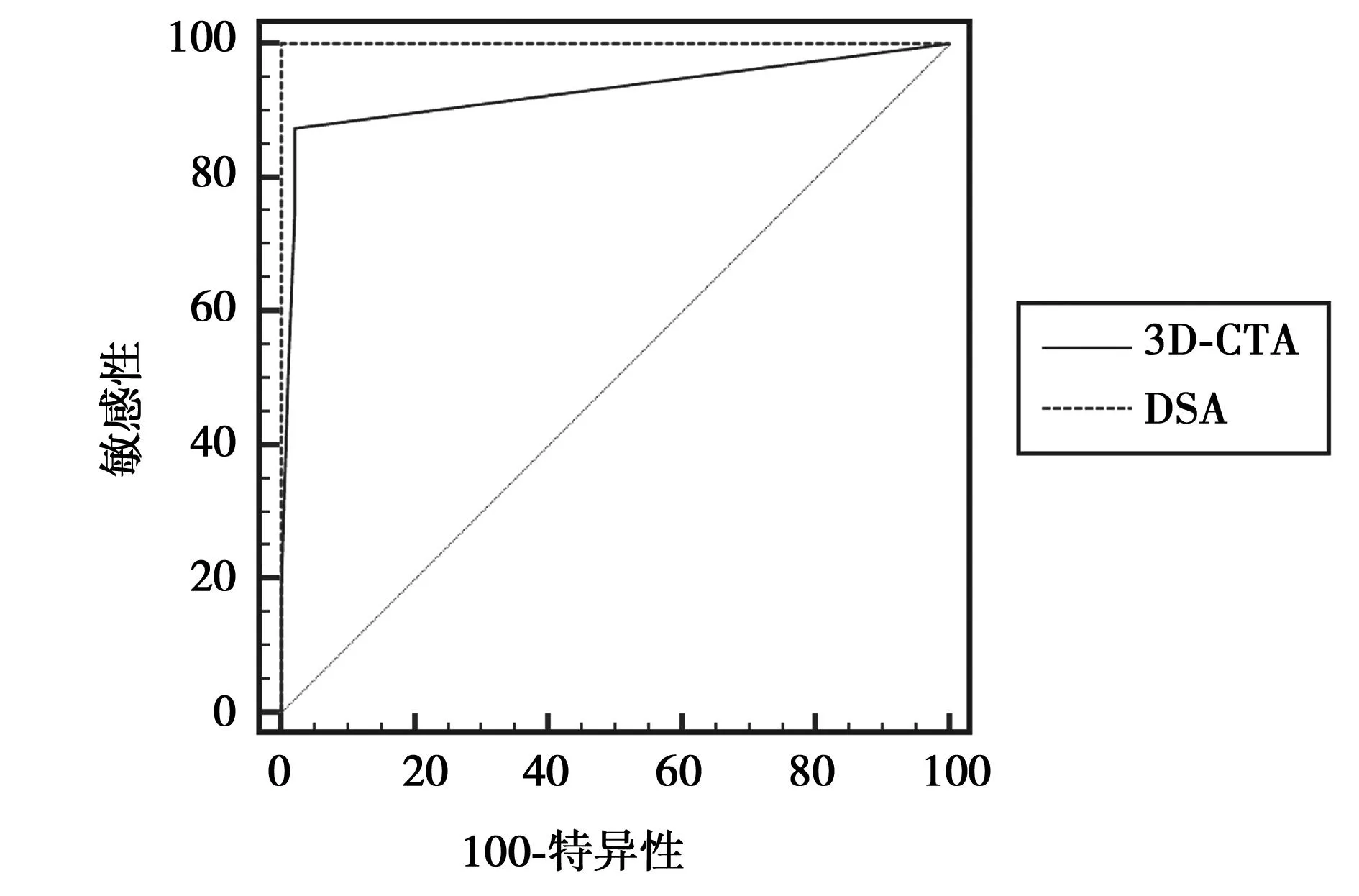
图1 3D-CTA与金标准DSA比较的ROC曲线图
3讨论
众所周知,对动脉瘤不完全的治疗可能引发动脉瘤新的再出血〔8〕。因此,发现动脉瘤残留在临床上是相当重要的;对术后成像的准确方法广受关注。
尽管DSA一直是黄金标准评价动脉瘤的方法。但它有几个缺点,包括侵袭性的过程及其相对更高的成本。这也带来了一个不可否认的风险的发病率〔9〕。特别是对于老年病人,老年人血管变异大,无形中增加了造影的风险度和难度。考虑到所有的这些,用非侵入性的筛选技术来评估脑动脉瘤夹闭术后的患者成为当今一个巨大需求。最近的报告表明,3D-CTA术前甚至可以检测出直径1 mm小动脉瘤〔3〕。然而评估其能力受到以下几个因素的影响:包括数量和使用血管瘤夹的类型。钛夹已被证明是安全有效的,而且它们现在常规用于动脉瘤手术中在CT和磁共振影像中,钛夹产生的反应远远少于其他合金〔10〕。Sakuma等〔5〕研究了57例病人(77动脉瘤),证实钛夹在3D-CTA只产生有限的伪影和影响图像质量。研究表明,使用VR成像方法检测瘤颈残余的平均敏感性和特异性分别为61.5%和82.8%。本研究中,发现3D-CTA检测残留复发性动脉瘤的敏感性和特异性的是87.5%和97.4%的,3D-CTA提供了更好的时间分辨率,金属伪影甚至小于在SDCT,3D-CTA具有更好的诊断性能。也有人报道使用3D-CTA可以有效提高CTA的诊断效能,减少漏诊率〔11〕。黄革等〔12〕认为CTA 的准确性为可以达到95. 34%,可作为颅内动脉瘤首选的检查方法。然而对于非动脉瘤性蛛网膜下腔出血,CTA有其局限性,临床上脑室出血、蛛网膜下腔出血以及反复的脑实质出血或TIA,王 硕等人建议均应常规行DSA检查〔13〕。
本研究中,3D-CTA观察中发现八个残余动脉瘤有3个< 2 mm残余的瘤颈不能检测到。主要原因是因为小动脉瘤颈部被动脉瘤夹模糊。2个假阳性结果被DSA证实是与血管主干重叠。在回顾检查中发现,这种误解的原因是由于窗口水平。van der Schaaf等〔14〕做了一个研究,以减少动脉瘤夹的伪影和他们建议扫描层厚0.6 mm,通过使用140 kV峰值和370 mg/ml对比材料。本研究中使用了相同的参数。然而,研究需要排除由于动脉瘤夹伪影而影响图像质量的病例。质量差的原因之一是使用两个动脉瘤夹同时治疗两个单独的动脉瘤时,由于互相之间过于接近而导致图像差。另外的一个原因是大尺寸的动脉瘤,需要使用三个动脉瘤夹进行外科治疗。存在多个动脉瘤位置靠近对方导致较差的图像质量。
考虑到DSA的侵袭性过程,本研究建议采用Lee等〔15〕的诊断方法,这将减少术后使用DSA的机会。如果手术后的3D-CTA图像没有被伪影所影响,显示没有残留囊的动脉瘤。DSA的诊断步骤可以省略。然而,如果图像质量是次优的或3D-CTA描绘了一个可能的或明确的残留囊、DSA应该执行。然而,由于目前的研究受限于相对较小的样本量,进一步的研究有赖于较大的患者群体,以确认这种算法的可靠性。其次,Dinesh等〔16〕发现术中CTA既有可行性又有潜在的实用性, 可以帮助识别动脉瘤夹闭手术后无法预计的残余动脉瘤和主干动脉闭塞。
本研究认为3D-CTA可作为老年病人术后残余动脉瘤检测的替代方式。通过3D-CTA技术,3D-CTA的敏感性和特异性能够十分接近传统DSA检测方法。3D-CTA在颅内动脉瘤诊断方面的地位相当于DSA,它在动脉瘤夹闭术后立即检查和长期随访一样,都有相当高的灵敏度和特异度 。3D-CTA作为一种性价比高、非侵入性的方法,对初始和长期评估残余动脉瘤可以替代DSA的检出手段。
参考文献4
1Cloft HJ,Lynn MJ,Feldmann E,etal. Risk of cerebral angiography in patients with symptomatic intracranial atherosclerotic stenosis〔J〕.Cerebrovasc Dis,2011;31(6):588-91.
2Korogi Y,Takahashi M,Katada K,etal. Intracranial aneurysms:detection with three-dimensional CT angiography with volume rendering-comparison with conventional angiographic and surgical findings〔J〕.Radiology,1999;211(2):497-506.
3Kato Y,Katada K,Hayakawa M,etal. Can 3D-CTA surpass DSA in diagnosis of cerebral aneurysm〔J〕.Acta Neurochir (Wien),2001;143(3):245-50.
4Caruso R,Colonnese C,Elefante A,etal. Use of spiral computerized tomography angiography in patients with cerebral aneurysm,our experience〔J〕.J Neurosurg Sci,2002;46(1):4-9.
5Sakuma I,Tomura N,Kinouchi H,etal. Postoperative three-dimensional CT angiography after cerebral aneurysm clipping with titanium clips:detection with single detector CT. Comparison with intra-arterial digital subtraction angiography〔J〕.Clin Radiol,2006;61(6):505-12.
6Teksam M,Mckinney A,Cakir B,etal. Multi-slice computed tomography angiography in the detection of residual or recurrent cerebral aneurysms after surgical clipping〔J〕.Acta Radiol,2004;45(5):571-6.
7宋花玲,贺佳,虞慧婷,等. 应用ROC曲线下面积对两相关诊断试验进行评价和比较〔J〕.第二军医大学学报,2006;26(5):562-63.
8David CA,Vishteh AG,Spetzler RF,etal. Late angiographic follow-up review of surgically treated aneurysms〔J〕.J Neurosurg,1999;91(3):396-401.
9Cloft HJ,Joseph GJ,Dion JE. Risk of cerebral angiography in patients with subarachnoid hemorrhage,cerebral aneurysm,and arteriovenous malformation:a meta-analysis〔J〕.Stroke,1999;30(2):317-20.
10Burtscher IM,Owman T,Romner B,etal. Aneurysm clip MR artifacts. Titanium versus stainless steel and influence of imaging parameters〔J〕.Acta Radiol,1998;39(1):70-6.
11赵军,陈健龙,张茂,等. 颅内动脉瘤介入诊疗中三维旋转造影成像技术分析〔J〕.中国老年学杂志,2012;32(2):241-3.
12黄革,黄桂玲,张鹏国,等. 多层螺旋CT血管造影在老年脑动脉瘤诊断中的应用〔J〕.中国老年学杂志,2012;32(8):1620-1.
13王硕. 中老年人烟雾病的临床表现与影像分析〔J〕.中国老年学杂志,2005;25(7):780-1.
14van der Schaaf I,van Leeuwen M,Vlassenbroek A,etal. Minimizing clip artifacts in multi CT angiography of clipped patients〔J〕.AJNR Am J Neuroradiol,2006;27(1):60-6.
15Lee JH,Kim SJ,Cha J,etal. Postoperative multidetector computed tomography angiography after aneurysm clipping:comparison with digital subtraction angiography〔J〕.J Comput Assist Tomogr,2005;29(1):20-5.
16Dinesh SK,Thomas J,Ng I. Intraoperative computed tomographic angiography in cerebral aneurysm surgery:a pilot feasibility study〔J〕.Neurosurgery,2010;66(2):349-53.
〔2014-05-09修回〕
(编辑安冉冉/曹梦园)
通讯作者:肖绍文(1957-),男,教授,主要从事脑血管病研究。
基金项目:广西医疗卫生重点科研课题(200828);广西医疗卫生重点科研课题(200926)
中图分类号〔〕R445. 2〔
文献标识码〕A〔
文章编号〕1005-9202(2015)21-6085-03;doi:10.3969/j.issn.1005-9202.2015.21.036
