丝氨酸/精氨酸蛋白特异激酶SRPK2在小鼠睾丸组织中的表达及意义
2016-01-28杨红李晓宾李婷贾三三王海龙宋国华郭睿
杨红,李晓宾,李婷,贾三三,王海龙,宋国华,郭睿*
(1. 山西医科大学生物化学与分子生物学教研室, 太原 030001;
2. 山西医科大学寄生虫学教研室, 太原 030001;
3. 山西医科大学实验动物中心,太原 030001.)
丝氨酸/精氨酸蛋白特异激酶SRPK2在小鼠睾丸组织中的表达及意义
杨红1, 李晓宾1, 李婷1, 贾三三1, 王海龙2, 宋国华3,郭睿1*
(1. 山西医科大学生物化学与分子生物学教研室, 太原030001;
2. 山西医科大学寄生虫学教研室, 太原030001;
3. 山西医科大学实验动物中心,太原030001.)
【摘要】目的通过研究丝氨酸/精氨酸蛋白特异激酶2(serine/arginine-rich protein specific kinase 2,SRPK2) 基因mRNA及其编码蛋白产物在小鼠睾丸组织中的表达特征,探讨该基因在精子发生过程中的作用及意义。 方法分别采用半定量逆转录聚合酶链反应(RT-PCR)和蛋白免疫印迹杂交(Western blotting)分析该基因mRNA及蛋白产物在小鼠多种组织中的表达;利用实时定量PCR(real-time quantitative PCR)分析SRPK2 mRNA在不同发育阶段小鼠睾丸组织中的差异表达;应用免疫组织化学染色和间接免疫荧光技术观察SRPK2蛋白在小鼠曲精小管中的细胞定位和生精细胞内的亚细胞定位。 结果半定量RT-PCR和Western blotting分析显示SRPK2 mRNA和蛋白在小鼠睾丸组织中均大量表达;实时定量PCR分析发现SRPK2 mRNA在5周及8周龄雄性小鼠睾丸组织中显著表达,具有明显的阶段特异性表达特征。免疫组织化学染色结果表明SRPK2蛋白阳性着色主要位于曲精小管中的长形精子细胞核;间接免疫荧光分析显示SRPK2蛋白定位于长形精子细胞核表面。 结论SRPK2基因在小鼠睾丸组织中大量表达,并且具有显著的阶段特异性表达特征和明确的细胞核定位,极有可能在小鼠精子发生的变态成形期参与mRNA前体分子的剪接过程,其作用机制值得进一步深入研究。
【关键词】SRPK2;精子发生;小鼠
Expression and significance of SR-protein-specific
哺乳动物的精子发生是一个极其复杂而特异的细胞分化过程,分为有丝分裂期、减数分裂期和变态成形期。其中,精子细胞的变态成形是一个关键环节,也是体内其他任何细胞不具备的独特现象。在变态成形阶段,单倍体圆形精子细胞需要经过复杂的变态分化,才能发育为具有头、颈、尾结构的特异精子。主要的形态学改变包括:核染色体紧密包装,细胞核浓缩变长,高尔基体衍变成为顶体,以微管和肌动蛋白为主的精尾形成。精子细胞这一特殊的分化方式必定受到多种因素的精确调控,探讨其内在过程及参与分子的功能将有助于进一步认识精子发生的生物学机制。
精子发生相关蛋白3(spermatogenesis-associated protein 3,SPATA3)基因是近年发现的睾丸组织特异高表达基因,国外学者应用基因芯片技术证实该基因在人类非梗阻性无精子症患者睾丸组织中的表达显著降低,可作为该类男性不育症的潜在分子标志用于临床诊断[1]。前期研究发现小鼠spata3基因在5周和8周龄小鼠睾丸组织中高度表达,可能参与精子发生后期精子细胞的变态成形过程[2]。以小鼠spata3基因cDNA全长构建诱饵质粒,从蛋白水平出发采用酵母双杂交技术筛选小鼠睾丸cDNA文库,获得了与spata3存在相互作用的丝氨酸/精氨酸蛋白特异激酶2(serine/arginine-rich protein specific kinase 2,SRPK2)。SRPK2蛋白属于SRPK激酶家族,能够磷酸化富含丝氨酸和精氨酸的剪接因子蛋白,从而参与调节细胞核内mRNA前体的剪接加工[3]。有实验表明SRPK2主要在脑组织和睾丸组织大量表达[4],但目前绝大多数关于SRPK2的研究集中在脑组织,在睾丸组织中的表达研究鲜有报道。为了深入探讨SRPK2在精子发生过程中的作用,分别从mRNA和蛋白水平分析SRPK2在小鼠睾丸组织中的表达特性,为后续研究奠定基础。
1材料与方法
1.1实验动物
SPF级BALB/c雄性小鼠,1周龄10只,体重2~4 g;2周龄6只,体重4~8 g;3周龄2只,体重8~12 g;5周龄1只,体重17~20 g;8周龄2只,体重20~25 g,均由山西医科大学实验动物中心提供【SCXK(晋)2009-0001】,组织取材于山西医科大学实验动物中心实验室完成【SYXK(晋)2003-0003】,并按照实验动物使用的3R原则给予人道关怀。
1.2引物序列
根据SRPK2编码基因(基因登录号:NM_009274.2)序列设计引物,上游引物为5′-GCTACAGCACACCTGCAGACA-3′,下游引物为5′-CAGAATGCGGTTCGAACAAATAG-3′,扩增产物大小为87 bp。实验以β-actin为内参照,上游引物为5′-CTATTGGCAACGAGCGGT-3′,下游引物为5′-GGTCTTTACGGATGTCAACG-3′,扩增产物大小为132 bp。上述引物均由TaKaRa公司合成。
1.3主要试剂
RNA提取Trizol试剂和抗淬灭封片剂由Invitrogen公司提供,HiFi-MMLV反转录试剂盒、PCR试剂盒、RIPA裂解液、BCA蛋白定量试剂盒、ECL发光液均为北京康为世纪生物科技有限公司产品,SYBR® Premix Ex TaqTMⅡ购自宝生物工程(大连)有限公司,BSA、封闭用正常山羊血清为Solarbio公司产品,小鼠抗β-actin单克隆抗体、SRPK2兔抗多克隆抗体购自Biorbyt公司,辣根过氧化物酶标记的山羊抗小鼠IgG及山羊抗兔IgG由北京中杉金桥有限公司提供,Cy3标记驴抗兔荧光二抗由Jackson公司提供,通用型免疫组化试剂盒为武汉博士德生物公司产品。
1.4半定量RT-PCR分析SRPK2 mRNA的组织特异性表达
颈椎脱臼处死8周龄雄性小鼠,迅速取出其心、肝、脑、肾、脾、肺和睾丸组织置于液氮中,加入适量Trizol试剂提取小鼠各组织总RNA,经紫外分光光度法和琼脂糖凝胶电泳检测后,取2 μg进行RT-PCR分析,扩增条件为:94℃预变性5 min;94℃变性30 s,53℃退火30 s,72℃延伸45 s,共30个循环。同时以管家基因β-actin作为内参照,反应结束后,经2.0 %琼脂糖凝胶电泳分析检测扩增产物。
1.5Western blotting分析SRPK2蛋白在各组织中的表达水平
颈椎脱臼处死8周龄雄性小鼠,提取心、肝、脑、肾、脾、肺和睾丸组织总蛋白,并采用BCA法进行蛋白定量。各取50 μg总蛋白进行SDS-PAGE电泳分离后,经转膜、封闭,分别以小鼠抗β-actin单克隆抗体(1∶1000)及兔抗SRPK2多克隆抗体(1∶100)为一抗4℃杂交过夜,次日以山羊抗小鼠HRP-IgG(1∶5000)、山羊抗兔HRP-IgG(1∶5000)为二抗,室温杂交1 h,采用ECL发光法检测,通过BIO-RAD凝聚成像仪分析结果。
1.6实时定量PCR检测SRPK2 mRNA的阶段特异性表达
分别提取1、2、3、5和8周龄雄性小鼠睾丸组织总RNA,反转录合成cDNA,使用SYBR® Premix Ex TaqTMII试剂盒进行实时定量PCR检测。反应采取两步法,每个样品均设立三个平行管,具体扩增条件为:95℃预变性10 min;95℃ 15 s,57℃ 1 min,共进行40个循环。每次反应均设置熔解曲线分析,以证实无非特异性扩增,同时以管家基因β-actin作为内参照。SRPK2基因的相对表达量计算采用ΔΔCT法,以3周龄睾丸组织中该基因的表达量为参照,取值为1。
1.7免疫组织化学染色显示SRPK2蛋白在曲精小管中的细胞定位
取8周龄雄性小鼠睾丸组织,经4 %多聚甲醛固定、常规石蜡包埋,连续切片(厚5 μm),裱片于经多聚赖氨酸处理的载玻片上,温箱烘干。免疫组织化学检测采用ABC法,滴加兔抗SRPK2多克隆抗体(1∶100)4℃湿盒内孵育过夜,次日滴加生物素标记的山羊抗兔二抗(1∶200)室温孵育1 h,滴加ABC复合液后37℃湿盒内温育30 min,常规DAB显色,苏木素复染(同时选取数张不进行复染)、脱水、透明、封片,镜下观察结果,结果判定以出现棕黄色着色为阳性染色。实验同时以PBS代替一抗作为阴性对照,所有实验均重复3次。
1.8间接免疫荧光染色分析SRPK2蛋白在生精细胞中的亚细胞定位
取8周龄雄性小鼠睾丸组织置于预冷的PBS中,快速分离曲精小管,并使用胶原酶消化成为散在的单细胞,取50 μL涂片,室温晾干。封闭后滴加兔抗SRPK2多克隆抗体(1∶100),4℃湿盒内孵育过夜,次日滴加Cy3标记的驴抗兔二抗(1∶400)37℃孵育2 h,充分洗涤后滴加20 μL含DAPI的抗淬灭封片剂,避光,立即在共聚焦激光显微镜下观察并摄片。上述实验均重复3次,同时以1% BSA/PBS代替一抗作为阴性对照。
2结果
2.1SRPK2 mRNA在小鼠多种组织中的半定量RT-PCR分析
以雄性小鼠7种组织(心、肝、脑、肾、脾、肺、睾丸)总RNA为模板进行半定量RT-PCR扩增,所得产物经2%琼脂糖凝胶电泳分离,结果见图1。可见SRPK2基因mRNA在小鼠睾丸组织中的扩增条带尤为明显,经过灰度扫描,以β-actin基因的表达量作为参照,计算该基因在不同组织中的相对表达量(见图2),结果表明SRPK2基因mRNA在小鼠睾丸组织中的表达量最高,其次在肾脏和脑组织中也有一定强度表达,而其他组织的表达则相对较弱甚至缺如。
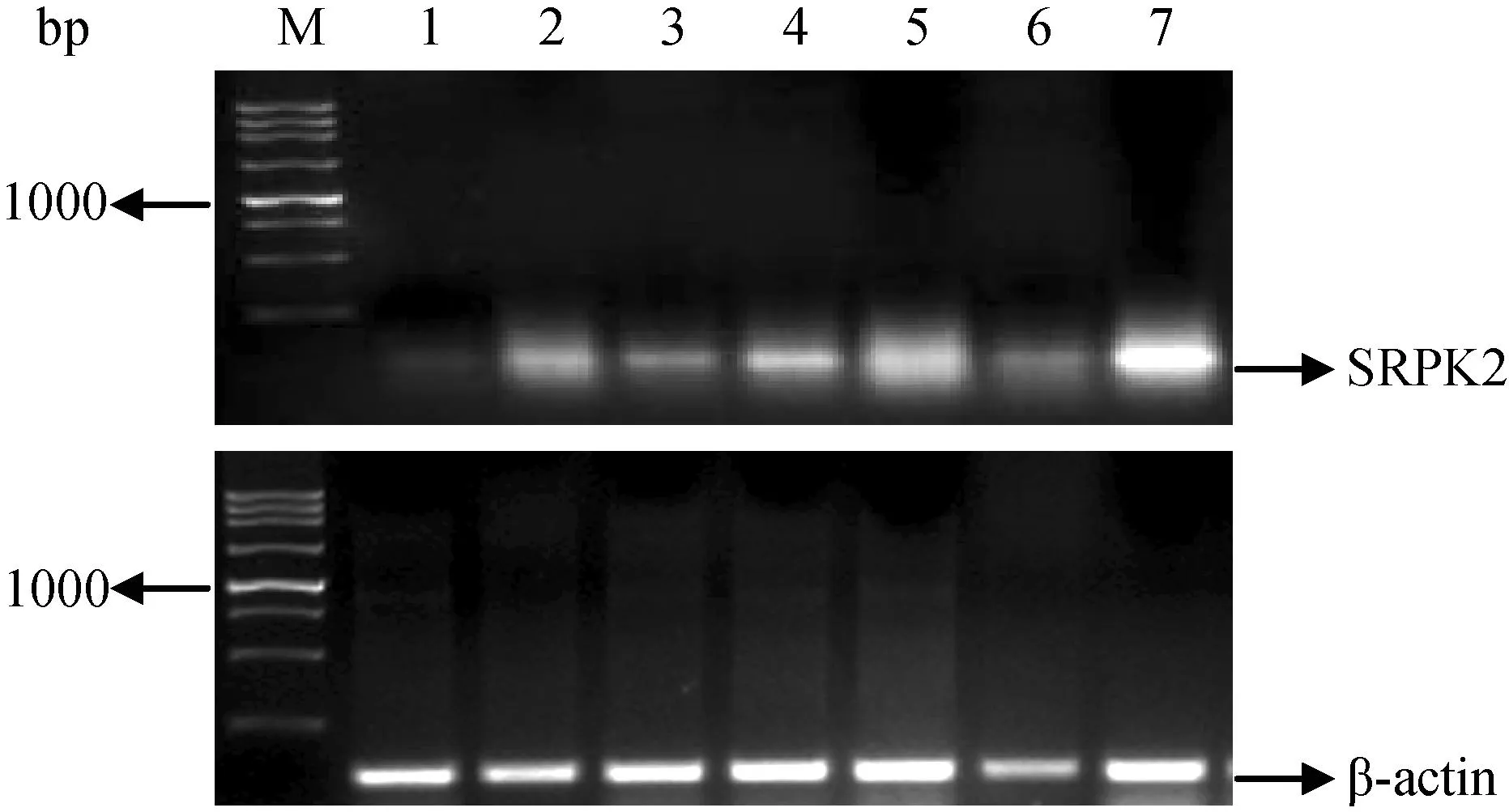
注:M. Marker; 1.心; 2.肝; 3.脾; 4.脑; 5.肾; 6.肺; 7.睾丸。 图1 SRPK2基因在小鼠不同组织中RT-PCR结果Note.M. Marker; 1. Hheart; 2. Lliver; 3. Sspleen; 4. Bbrain; 5. Kkidney; 6. Llung; 7. Ttestis. Fig.1 The RT-PCR analysis of SRPK2 in several organ-tissues of BALB/c mice
注:1.心; 2.肝; 3.脾; 4.脑; 5.肾; 6.肺; 7.睾丸。 图2 SRPK2 mRNA在不同组织中的相对表达Note.1. Heart; 2. Liver; 3. Spleen; 4. Brain; 5. Kidney; 6. Lung; 7. Testis. Fig.2 Relative expression of SRPK2 mRNA in different tissues of the mice
2.2Western blotting分析SRPK2蛋白在小鼠不同组织中的表达
Western blotting结果(图3)显示目的条带约55 ×103,与预期大小基本一致。睾丸组织对应的阳性条带最为显著,脑组织和肾脏中SRPK2蛋白阳性条带也比较明显,而其他组织未检测到该基因产物的表达。以β-actin蛋白表达量作为参照,利用凝胶分析软件进行扫描,计算SRPK2/β-actin灰度比值,用来表示SRPK2蛋白在各组织中的相对表达量。计算结果表明睾丸组织中SRPK2蛋白的表达量为2.613,肾脏和脑组织中该蛋白的表达量分别为1.235和1.038。
2.3实时定量PCR检测SRPK2 mRNA在小鼠不同发育阶段睾丸组织中的表达
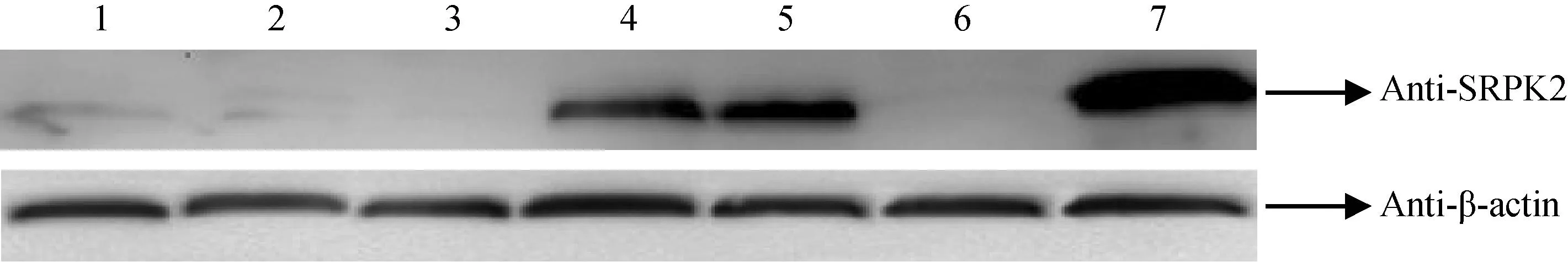
注: 1.心; 2.肝; 3.脾; 4.脑; 5.肾; 6.肺; 7.睾丸。 图3 Western blotting 检测SRPK2蛋白在小鼠不同组织中的表达Note.1. Heart; 2. Liver; 3. Spleen; 4. Brain; 5. Kidney; 6. Lung; 7. Testis. Fig.3 Expression of SRPK2 protein in different tissues by Western blotting

图4 实时定量PCR分析SRPK2 mRNA的阶段特异性表达 Fig.4 Stage-specific expression of SRPK2 mRNA detected by real-time quantitative PCR
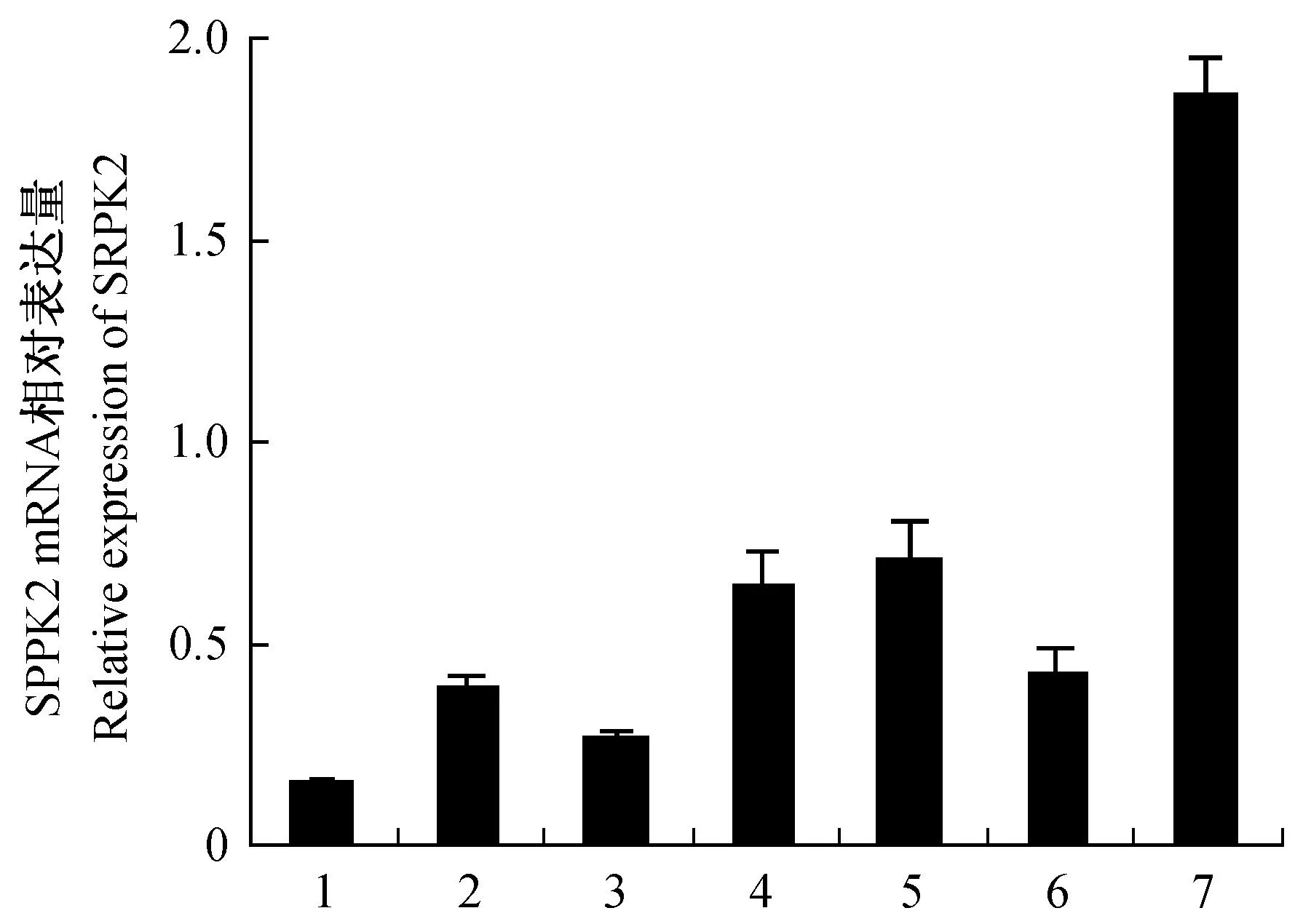
通过实时定量PCR分析SRPK2 mRNA在不同发育阶段小鼠睾丸组织中的相对表达量(见图4),结果显示SRPK2 mRNA的表达趋势呈规律性增强。设定该基因在3周龄小鼠睾丸组织中的表达量为1,可见在1周和2周龄小鼠睾丸中的表达很弱,后逐渐增强,5周龄和8周龄时SRPK2的表达水平分别约为3周龄的2.6 和2.7倍。2.4免疫组化染色检测SRPK2蛋白在曲精小管中的细胞定位图5为免疫组化染色结果,可以看到SRPK2蛋白阳性信号呈棕黄色颗粒,主要分布在曲精小管内长形精子细胞的细胞核区域,精原细胞、精母细胞以及圆形精子细胞中未见明显的阳性信号存在。
2.5间接免疫荧光染色检测SRPK2蛋白在生精细胞中的亚细胞定位
利用间接免疫荧光染色技术检测SRPK2蛋白的亚细胞定位,结果见图6所示。在多种类型细胞混杂存在的视野中,可以看到红色荧光标记的SRPK2蛋白只在长形精子细胞核附近的位置表现出强烈的阳性信号,其他细胞未见明显的阳性着色(B、D)。从F能够明显看到SRPK2蛋白红色荧光信号呈“弯月状”紧密附着在长形精子细胞核凸起侧,并靠近精子头部。
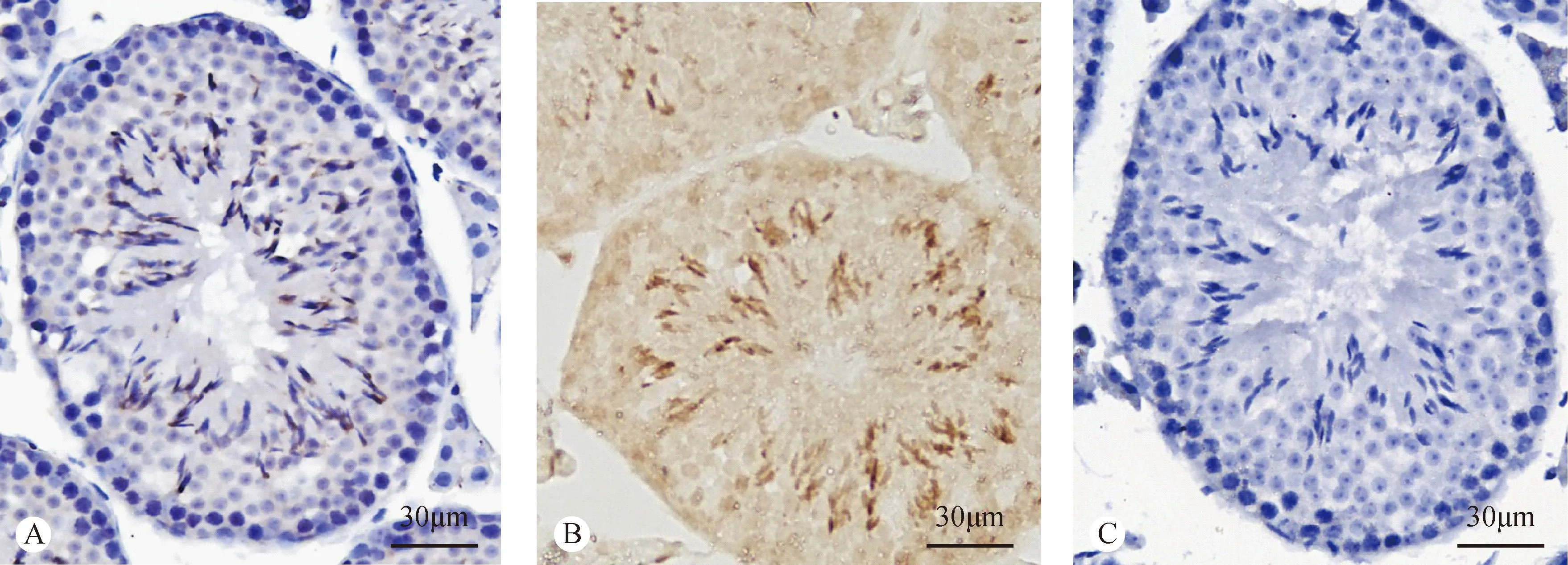
注:A. SRPK2蛋白的细胞定位,苏木素复染;B. SRPK2蛋白的细胞定位,未复染;C. 阴性对照。 图5 SRPK2蛋白在小鼠睾丸曲精小管中的免疫组化染色Note. A. Ccellular localization of SRPK2 protein, hematoxylin staining; B. Ccellular localization of SRPK2 protein, No restained with hematoxylin; C. Negative control. Fig.5 Immunohistochemical staining of SRPK2 protein in seminiferous tubules of the mouse testis

注:A, C, E. DAPI染色;B, D, F. 组合图。 图6 间接免疫荧光染色显示SRPK2蛋白在生精细胞中的定位Note.:A, C, E. DAPI staining; B, D, F. The merge of DAPI and Cy3 staining. Fig.6 Localization of SRPK2 protein in spermatic cells by indirect immunofluorescence staining
3讨论
哺乳动物的精子发生受到一系列因素的协同调节,只有在特定基因精密而严格的调控下,才能产生具有头、颈、尾结构的特异精子,输出到附睾获得授精能力。如果这一过程相关的关键基因缺陷、突变或表达异常,都有可能使精子细胞不能完成正常的分化过程,从而导致精子生成障碍,引起雄性动物不育。近年来,许多研究人员借助基因敲除小鼠模型已经证实,与精子细胞变态成形相关的重要基因缺失将直接导致精子发生停滞在变态成形期,致使成熟精子数目减少。这类基因主要包括 selenium、Atg7、Iqcg、RNASE9、PA-PLA1、CHD5、Taf7l、Trf2、KIF3A等[5~12]。纵观这些基因在小鼠睾丸组织中的表达特征,可以发现它们都具有严格的阶段特异性表达,大多在减数分裂完成后的圆形精子细胞阶段含量丰富。这也间接说明这类基因在圆形精子细胞分化成为长形精子细胞,以及成熟精子的过程中发挥了积极作用。因此,发现和鉴定类似基因对深入研究精子细胞变态成形的分子机制及由于精子发生异常引起的男性不育症具有深远的现实意义。
SPATA3在精子发生过程中具有与上述基因相似的阶段特异表达特征,推测该基因可能参与了精子细胞的变态成形。以SPATA3为诱饵,通过酵母双杂交技术筛选获得了SRPK2。据文献报道,SRPK2激酶能够催化靶蛋白特异部位的丝氨酸发生磷酸化,从而调节富含丝氨酸/精氨酸蛋白(常被称为SR蛋白)的活性。SR蛋白属于RNA结合蛋白,能够作为剪接因子参与形成剪接体,协助完成细胞核内mRNA前体的剪接加工,转变成为成熟mRNA,进入胞浆发挥翻译模板的作用[3]。因此,活化的SR蛋白能够促进mRNA成熟,继而加速新蛋白的合成。但SR蛋白本身并无活性,需要SRPK磷酸化其特异位点的丝氨酸才能将之激活。
SRPK家族包括SRPK1和SRPK2,Northern blotting结果显示二者在睾丸组织均有大量表达[4, 13, 14],并且研究者通过原位杂交实验表明SRPK1蛋白存在于小鼠睾丸曲精小管多种生精细胞内,但关于SRPK2蛋白的细胞定位至今未见有研究论文发表。实验利用半定量RT-PCR证实SRPK2 mRNA在睾丸组织大量表达,Western blotting结果也显示SRPK2蛋白在睾丸组织含量丰富,分别从mRNA和蛋白水平验证了其他研究者的结论。另外,还利用不同周龄小鼠睾丸组织为实验材料,通过实时定量PCR检测了SRPK2 mRNA的阶段特异性表达。结果表明SRPK2 mRNA在5周龄和8周龄小鼠睾丸中的表达水平远远高于其他阶段,提示该基因主要在精子发生的中、后期大量表达。5周龄小鼠睾丸曲精小管中已出现较多数量的圆形精子细胞;8周龄中有40%的生精细胞是长形精子细胞[15]。为了确定SRPK2蛋白在各类生精细胞中的定位,进一步应用免疫组化和免疫荧光染色观察了该蛋白的表达情况。从最终的染色结果可以清楚地看到SRPK2蛋白定位在曲精小管内部靠近管腔的长形精子细胞核部位,并且在长形精子核头部凸起侧有大量分布。结合上述实验所得,能够判断SRPK2 mRNA在小鼠精子发生过程中具有明显的阶段特异性表达特征, SRPK2蛋白在小鼠精子发生后期高度表达,主要存在于长形精子细胞内。
生物信息学分析是目前预测基因及蛋白功能非常有效的手段之一。经过比对分析发现,小鼠SRPK2激酶的多肽链序列与SRPK1非常相似,其激酶区域的氨基酸种类与SRPK1有77%是完全相同的[14]。因此,这两种激酶拥有相同的催化功能,都能使SR蛋白特异位点的丝氨酸磷酸化。但SRPK2还具有SRPK1不存在的两个独特区域:氨基末端第21~43位氨基酸之间有脯氨酸富集区,肽链中部第287~405位氨基酸序列中有丰富的酸性氨基酸大量存在[4, 13]。由此决定了二者的部分理化性质和催化底物的种类有所差别[16],在细胞内参与的生物学过程和存在的意义可能不尽相同。或许,这正是SRPK1与SRPK2同时在睾丸组织大量表达,但SRPK1存在于多种生精细胞,而SRPK2主要存在于长形精子细胞的根本原因。在圆形精子细胞分化为成熟精子的过程中,需要大量mRNA与蛋白质不断合成,因此,这一阶段mRNA前体的剪接加工活动非常活跃,而各种剪接因子正确组装形成剪接体是必不可少的前提条件。课题组曾采用质谱技术在变态成形期的精子细胞中检测到60多种蛋白均参与了剪接体的组装过程[17],其中的SR蛋白必须首先被SRPK磷酸化激活才能参与形成剪接体,这可能就是SRPK2蛋白在长形精子细胞大量存在的意义所在。但关于SRPK2在精子细胞变态成形过程中的具体作用及其作用机制仍需进一步深入研究。
参考文献
[1]Malcher A, Rozwadowska N, Stokowy T, et al. Potential biomarkers of nonobstructive azoospermia identified in microarray gene expression analysis [J]. Fertil Steril, 2013, 100(6):1686-1694.
[2]李喜霞, 张栋, 郭睿, 等. 小鼠生精细胞发育特异基因spata3的表达分析和克隆纯化 [J].中国组织工程研究与临床康复, 2009, 13(11): 2024-2029.
[3]Hong Y, Jang SW, Ye K. The N-terminal fragment from caspase-cleaved serine/arginine protein-specific kinase2 (SRPK2) translocates into the nucleus and promotes apoptosis [J]. J Biol Chem. 2011, 286(1): 777-786.
[4]Kuroyanagi N, Onogi H, Wakabayashi T, et al. Novel SR-protein-specific kinase, SRPK2, disassembles nuclear speckles [J]. Biochem Biophys Res Commun, 1998, 242(2): 357-364.
[5]Ahsan U, Kamran Z, Raza I, et al. Role of selenium in male reproduction [J]. Anim Reprod Sci, 2014, 146(1-2): 55-62.
[6]Wang H, Wan H, Li X, et al. Atg7 is required for acrosome biogenesis during spermatogenesis in mice [J]. Cell Res. 2014, 24(7): 852-869.
[7]Li RK, Tan JL, Chen LT, et al. Iqcg is essential for sperm flagellum formation in mice [J]. PLoS ONE. 2014, 9(5): e98053.
[8]Westmuckett AD, Nguyen EB, Herlea-Pana OM, et al. Impaired sperm maturation in RNASE9 knockout mice [J]. Biol Reprod. 2014, 90(6): 1-10.
[9]Baba T, Kashiwagi Y, Arimitsu N, et al. Phosphatidic acid (PA)-preferring phospholipase A1 regulates mitochondrial dynamics [J]. J Biol Chem, 2014, 289(16): 11497-11511.
[10]Zhuang T, Hess RA, Kolla V, et al. CHD5 is required for spermiogenesis and chromatin condensation [J]. Mech Dev, 2014, 131: 35-46.
[11]Zhou H, Grubisic I, Zheng K, et al. Taf7l cooperates with Trf2 to regulate spermiogenesis [J]. Proc Natl Acad Sci U S A. 2013, 110(42): 16886-16891.
[12]Lehti MS, Kotaja N, Sironen A. KIF3A is essential for sperm tail formation and manchette function [J]. Mol Cell Endocrinol. 2013, 377(1-2): 44-55.
[13]Wang HY, Lin W, Dyck JA, et al. SRPK2: a differentially expressed SR protein-specific kinase involved in mediating the interaction and localization of pre-mRNA splicing factors in mammalian cells [J]. J Cell Biol, 1998, 140(4): 737-750.
[14]Papoutsopoulou S, Nikolakaki E, Chalepakis G, et al. SR protein-specific kinase 1 is highly expressed in testis and phosphorylates protamine 1 [J]. Nucleic Acids Res. 1999, 27(14): 2972-2980.
[15]Yu ZR, Guo R, Ge YH, et al. Gene expression profiles in different stages of mouse spermatogenic cells during spermatogenesis [J]. Biol Reprod, 2003, 69: 37-47.
[16]Liang N, Zeng C, Tao KP, et al. Primary structural features of SR-like protein acinus S govern the phosphorylation mechanism by SRPK2 [J]. Biochem J. 2014, 459(1): 181-191.
[17]Wang H, Li Y, Yang L, et al. Mass spectrometry-based, label-free quantitative proteomics of round spermatids in mice [J]. Mol Med Rep. 2014, 10(4): 2009-2024.

·会讯·
中英第二届实验动物福利伦理国际论坛隆重召开
由中国实验动物学会实验动物福利伦理专业委员会和英国内政部共同主办的"中英第二届实验动物福利伦理国际论坛"于2015年3月17日至19日在北京裕龙国际酒店隆重召开。
3月18日上午,论坛举行了开幕式。开幕式由论坛执行主席、中国实验动物学会实验动物福利伦理专业委员会主任委员孙德明教授主持。科技部中国农村技术开发中心贾敬敦主任、英国使馆科技创新处凯伦处长等领导出席论坛并发表了热情洋溢的讲话。中国实验动物学会理事长秦川教授委托出席会议的学会常务副秘书长宋晶女士发表致辞。来自国内外近200名专家学者参加了论坛。
本次论坛以“提升实验动物福利伦理管理规范和科技水平”为宗旨,从实验动物福利伦理管理法规与技术标准及进展、善待实验动物、动物保护和3R理念如何实践、实验动物的疼痛管理、麻醉镇痛、福利伦理审查中的利弊分析、仁慈终点、替代技术、环境丰富、福利伦理认证等相关的国际合作议题进行广泛而深入的探讨,通过借鉴国际公认的管理经验和先进的科技成果,以期推动中国实验动物福利伦理管理和科技水平的快速提升。
论坛将于今日结束,更多详情请关注后续报道及中国实验动物学会网站发布的信息。
中国实验动物学会秘书处供稿
研究报告
kinase SRPK2 in mouse testis
YANG Hong1, LI Xiao-bin1, LI Ting1, JIA San-san1, WANG Hai-long2,
SONG Guo-hua3, GUO Rui1
(1. Department of Biochemistry and Molecular Biology, 2. Department of Parasitology,
3. Laboratory Animal Center, Shanxi Medical University, Taiyuan 030001, China)
【Abstract】ObjectiveTo analyze the expression characteristics of SRPK2 (serine / arginine-rich protein specific kinase 2 mRNA and its encoded protein products in mouse testis, and to reveal its molecular role during spermatogenesis. Methods Using semi-quantitative reverse transcription polymerase chain reaction (RT-PCR) and Western blotting to analyze the expression of SRPK2 mRNA and its protein products in several mouse tissues. The stage-specific expression pattern of SRPK2 mRNA in mouse testis was examined by real-time quantitative PCR. Immunohistochemical staining was applied to identify the SRPK2 protein distribution in mouse testicular seminiferous tubules and indirect immunofluorescence staining was used to detect the subcellular localization of SRPK2 protein in spermatic cells. ResultsSemi-quantitative RT-PCR and Western blotting analysis revealed that SRPK2 was highly expressed in mice testis. Real-time quantitative PCR analysis showed that SRPK2 mRNA was expressed abundantly at the stage of 5-and 8-week old mouse testes, suggesting that SRPK2 gene has stage-specific expression patterns during mouse spermatogenesis. Immunohistochemical and indirect immunofluorescence staining demonstrated that SRPK2 protein was located around the surface of elongated sperm nucleus. ConclusionsSRPK2 is highly expressed in mouse testis and has significant stage-specific expression characteristics with distinct nuclear localization. These results indicate that SRPK2 may participate in precursor mRNA splicing during mouse spermiogenesis. The molecular mechanism of SRPK2 is yet to be further studied.
【Key words】SRPK2; Spermatogenesis; Mouse; Testis
[收稿日期]2014-09-17
Doi:10.3969/j.issn.1005-4847.2015.02.013
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2015) 02-0171-07
[通讯作者]郭睿,女,硕士研究生导师,主要研究方向:发育生物学。E-mail: guoruipumc@aliyun.com
[作者简介]杨红(1990年-),硕士研究生在读,主要研究方向:生殖细胞基因表达调控。E-mail: qianxiasx@126.com
[基金项目]山西省回国留学人员科研资助项目(NO.2011-043)。
