AG490对HEL细胞VEGF和HIF-1α表达的影响*
2016-01-28赵亚玲付建珠刘贵敏梁文同成志勇
徐 倩, 赵亚玲, 付建珠, 谷 蕾, 刘贵敏, 梁文同△, 成志勇△
(1承德医学院,河北 承德 067000; 2保定市第一医院血液内科,河北 保定 071000)
AG490对HEL细胞VEGF和HIF-1α表达的影响*
徐倩1, 2,赵亚玲1, 2,付建珠1, 2,谷蕾2,刘贵敏1, 2,梁文同2△,成志勇2△
(1承德医学院,河北 承德 067000;2保定市第一医院血液内科,河北 保定 071000)
[摘要]目的: 探讨JAK2抑制剂AG490对人红白血病(HEL)细胞迁移及对VEGF和HIF-1α表达的影响。方法: 用不同浓度的AG490处理HEL细胞,CCK-8法检测细胞活力,Hoechst 33342荧光染色检测细胞凋亡,流式细胞术检测细胞凋亡及周期,Transwell小室检测细胞迁移能力,RT-PCR检测JAK2的mRNA水平,Western blot检测p-JAK2、VEGF和HIF-1α的蛋白水平。结果: AG490能够抑制HEL细胞的活力,不同浓度(20、40、60、80和100 μmol/L)AG490作用HEL细胞48 h后,细胞活力分别为88%、75%、48%、10%和0.12%(P<0.05);Hoechst 33342凋亡细胞染色显示80 μmol/L AG490处理细胞48 h后,亮蓝色凋亡细胞较对照组明显增多(P<0.05);流式结果显示80 μmol/L AG490作用细胞48 h后,凋亡率上升;细胞迁移实验结果显示20 μmol/L AG490处理细胞24 h后漏出细胞明显低于对照组(P<0.05);RT-PCR结果显示不同浓度AG490处理HEL细胞48 h后JAK2 mRNA呈剂量依赖性减低;Western blot结果显示实验组细胞的p-JAK2、VEGF和HIF-1α蛋白水平较对照组明显减低(P<0.05)。结论: AG490可通过抑制JAK2信号通路,抑制HEL细胞血管新生因子VEGF和HIF-1α的表达。
[关键词]骨髓增殖性肿瘤; 血管生成; VEGF; HIF-1α
血管生成是涉及新生血管从预先存在的血管网发展的一个严格调节的过程。在实体肿瘤中,血管生成是肿瘤生长、进展和转移至关重要的因素。有证据表明,在血液系统恶性肿瘤如白血病、多发性骨髓瘤、淋巴瘤、骨髓增殖性肿瘤等与实体瘤相似的肿瘤中具有高骨髓微血管密度(microvessel density,MVD),因而考虑血管生成在血液系统恶性肿瘤的发展中起重要作用[1]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是促肿瘤血管新生的重要因子,以其对血管内皮细胞有丝分裂活性而得名,通过其受体VEGFR与相应刺激信号结合,能够刺激有丝分裂活性和内皮细胞增殖,增加血管通透性,并诱导血管扩张及产生促血管活性因子,参与新生血管的形成[2]。缺氧诱导因子1α(hypoxia-indu-cible factor-1α,HIF-1α)是存在于肿瘤中的缺氧应答调控因子,在维持细胞能量代谢、肿瘤血管生成及转移中发挥重要作用[3]。VEGF和HIF-1α在多种恶性肿瘤中高表达,是目前已知的参与血管新生及肿瘤转移的重要因子。国外研究报道,在JAK2V617F骨髓增殖性肿瘤患者中的MVD明显高于正常人,同时VEGF和HIF-1α存在高表达,提出JAK2突变可能与VEGF和HIF-1α表达存在重要关系。本研究通过JAK2抑制剂AG490作用于JAK2V617F阳性人红白血病(human erythroleukemia, HEL)细胞,观察AG490对HEL细胞活力、迁移能力及对p-JAK2、VEGF和HIF-1α蛋白水平的变化,初步探讨JAK2抑制剂对JAK2V617F阳性细胞VEGF和HIF-1α表达水平的作用机制,为抗血管新生治疗骨髓增殖性肿瘤提供理论依据。
材料和方法
1主要试剂
RPMI-1640培养液(Gibco);新生牛血清(杭州四季青公司);荧光染料Hoechst 33342和AG490(Sigma);CCK-8(Dojindo);引物(北京赛百胜);抗体(Santa Cruz)。
2细胞系及细胞培养
HEL细胞为JAK2V617F阳性,具有JAK-STAT信号通路活化的特征,购自上海科学院细胞库。HEL细胞于37 ℃、5% CO2的培养箱中培养。细胞培养液为加入10%胎牛血清的RPMI-1640培养液。根据细胞生长状况,2~3 d换液1次,取对数生长期细胞进行实验。
3实验分组
将对数期细胞分为实验组和对照组,实验组根据加入AG490的不同浓度分为20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L和100 μmol/L组。对照组不加入AG490。
4实验方法

4.2HEL细胞凋亡形态的观察用Hoechst 33342染色检测细胞凋亡。分别取48 h后对照组及80 μmol/L AG490处理组的HEL细胞,取100 μL细胞悬液,加入终浓度为10 mg/L的Hoechst 33342,避光染色15~20 min, 取40 μL细胞悬液滴于载玻片,荧光显微镜下观察凋亡细胞形态。
4.3Transwell小室检测细胞迁移取对数生长期HEL细胞,调整细胞密度5×104/L,按照实验设计分组上室分别加入含不同浓度AG490的细胞悬液200 μL(不含血清),下室加入含10%小牛血清的1640培养基500 μL,每组3个复孔,孵育24 h后,取出Transwell小室,用下室培养液反复淋洗上室底面,在显微镜下观察脱落及洗下的细胞数量。
4.4流式细胞术检测细胞凋亡取对数生长期HEL细胞,在6孔板中接种3 mL细胞悬液,约含1×105个细胞,按照实验分组分别加入不同浓度AG490,分别孵育0 h、24 h、48 h和72 h,收取细胞,0.5 mL PBS洗2次,1 000 r/min离心、弃去上清液,75%冰乙醇固定过夜,离心,弃上清,0.5 mL PBS洗1次,加入RNase 1 mL,37 ℃恒温水浴30 min,1 000 r/min离心,弃上清,加入DNA抽提液1 mL,室温静置30 min,4 000 r/min离心5 min,弃上清。加入500 μL(0.1 g/L)的PI染液,置于4 ℃避光染色30 min,过滤网,上流式细胞仪检测。
4.5RT-PCR检测JAK2的mRNA表达收集对照组及实验组细胞,TRIzol提取各组细胞总RNA,电泳鉴定RNA纯度及定量。根据Vazyme Hiscript 合成试剂盒反转录合成cDNA,逆转录反应体系20 μL,包括:细胞RNA 2 μg,RNasin 0.5 μL(50 U/μL),随机物1 μL(50 mg/L),dNTP 2 μL(10 mol/L),5×逆转录反应缓冲液4 μL,M-MLV反转录酶200 U,余用DEPC水补足至20 μL。在37 ℃中反应60 min,95 ℃反应5 min 后终止反应。产物进行PCR扩增或分装稀释,放置于-20 ℃,保存时间不超过6 个月。
PCR反应体系为20 μL,JAK2的上游引物为5’-CAG CAA GTA TGA TGA GCA AGC TTT-3’,下游引物为5’-TGA ACC AGA ATA TTC TCG TCT CCA C-3’。内参照β-actin的上游引物为 5’-CTG GCA CCA CAC CTT CTA CAA T-3’,下游引物为5’-AAT GTC ACG CAC GAT TTC CCG C-3’。JAK2扩增片段产物长度101 bp,β-actin的扩增片段长度382 bp。取cDNA 2 μL作为模板,建立20 μL反应体系。反应条件为94 ℃预变性5 min,94 ℃变性45 s,60 ℃退火1 min,68 ℃延伸45 s,40 个循环。扩增后的产物进行琼脂糖凝胶电泳,全自动凝胶成像仪下分析。
4.6Western blot检测p-JAK2、VEGF和HIF-1α的蛋白水平收集各组细胞,提取蛋白,根据蛋白定量结果,分装蛋白,将分装好的蛋白置于沸水中煮沸变性5 min,配电泳分离胶、浓缩胶,蛋白上样,电泳使蛋白分离,转移至PVDF膜上,配5%脱脂奶粉,37 ℃烤箱中封闭2 h,使用抗体稀释液稀释I抗,4 ℃孵育过夜,TTBS洗膜6次(每次5 min),使用抗体稀释液稀释标记 II 抗,37 ℃烤箱中孵育2 h,TTBS洗3遍,TBS洗1遍,化学发光液混合,应用Alpha Innotech 系统对PVDF膜进行扫描及图像分析。
5统计学处理
数据均采用均数±标准差(mean±SD)表示。两样本均数比较采用t检验,多组均数比较采用方差分析,组间两两比较选用q检验,两变量的相关程度用Pearson 直线相关分析法分析。所有数据均用SPSS 19.00统计软件分析处理。
结果
1AG490对HEL细胞活力的影响
CCK-8结果显示,不同浓度的AG490作用HEL细胞后,随着时间推移,细胞活力逐渐下降,AG490作用48 h后,HEL细胞活力与对照组(95%)相比差异均有统计学意义(P<0.01);随着AG490药物浓度增大,HEL细胞活力明显下降,并呈时间依赖性,细胞活力明显受到抑制,见图1。
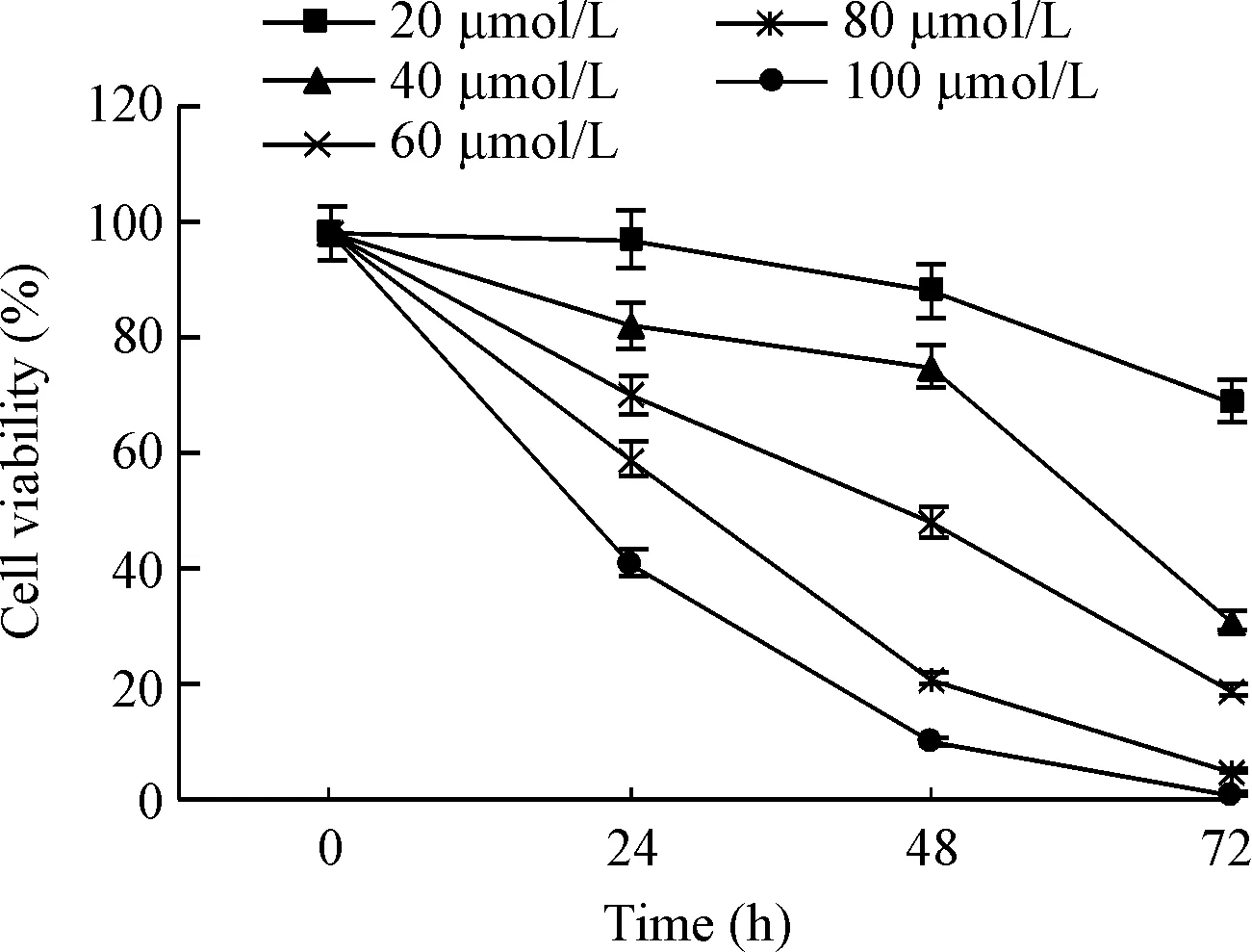
Figure 1.The HEL cell viability was detected by CCK-8 assay after treated with AG490 at different concentrations for different time. Mean±SD.n=5.
图1CCK-8法检测不同浓度AG490作用不同时间的细胞活力
2Hoechst 33342染色检测细胞凋亡
Hoechst 33342染色后的HEL细胞,对照组细胞为淡蓝色,细胞核内DNA分布均匀,核呈圆形或卵圆形,无固缩、变形。AG490处理细胞核由于浓集而呈亮蓝色,细胞出现凋亡,核固缩、变形。80 μmol/LAG490处理细胞48 h后,亮蓝色凋亡细胞较对照组明显增多(P<0.05),见图2。
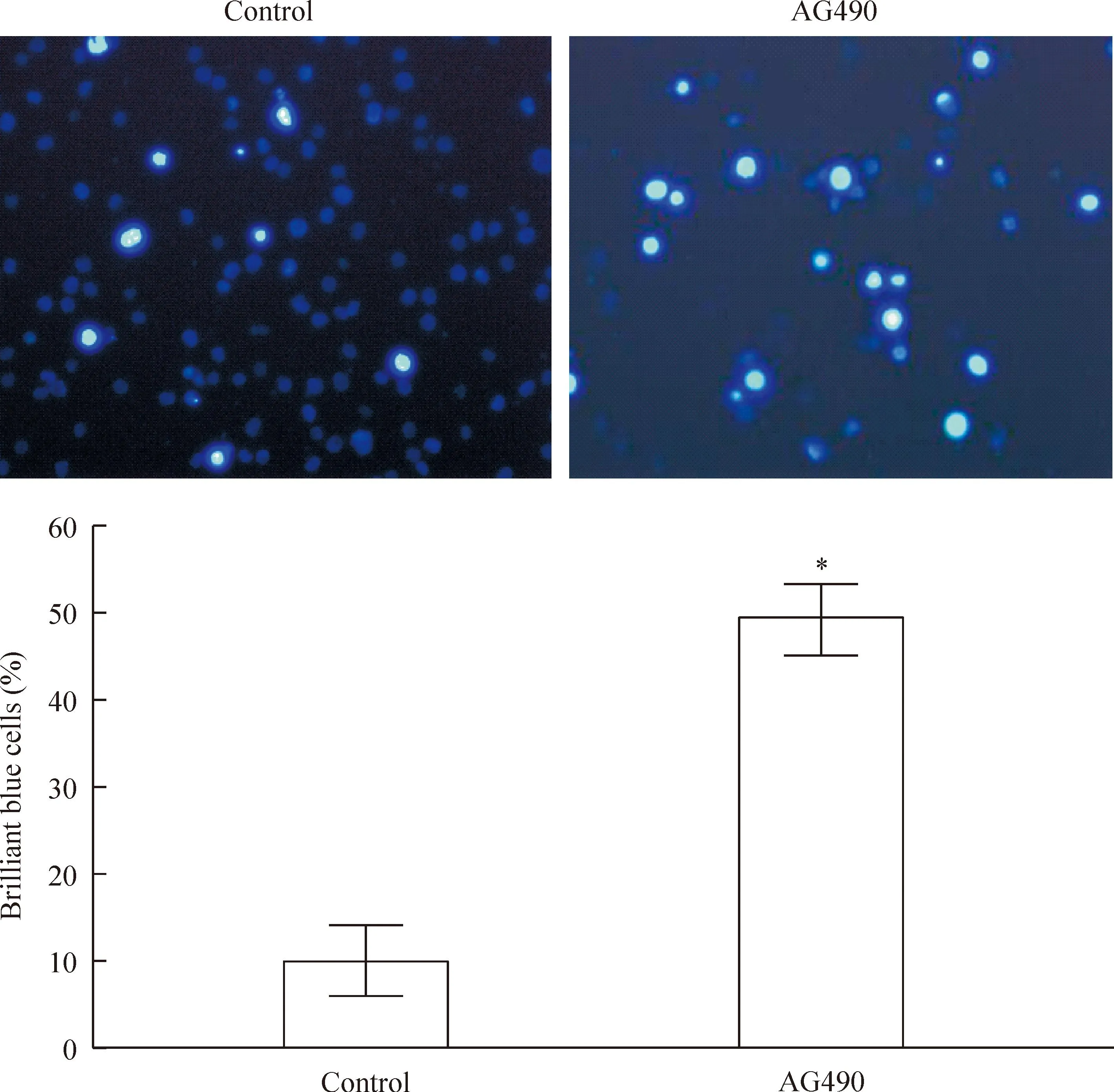
Figure 2.The apoptosis was detected by Hoechst 33342 staining after treated with AG490 (80 μmol/L) for 48 h. Mean±SD.n=3.*P<0.05vscontrol.
图2Hoechst 33342染色检测AG490作用48 h后HEL细胞的凋亡形态
3AG490对HEL细胞凋亡的影响
流式细胞术检测结果显示,与对照组相比,AG490处理的HEL细胞出现明显凋亡,随着AG490药物浓度的增加及作用时间的延长,凋亡细胞比率逐渐上升,G0/G1期前出现典型的亚二倍体凋亡峰。80 μmol/L AG490作用细胞48 h后,凋亡率上升,见图3。
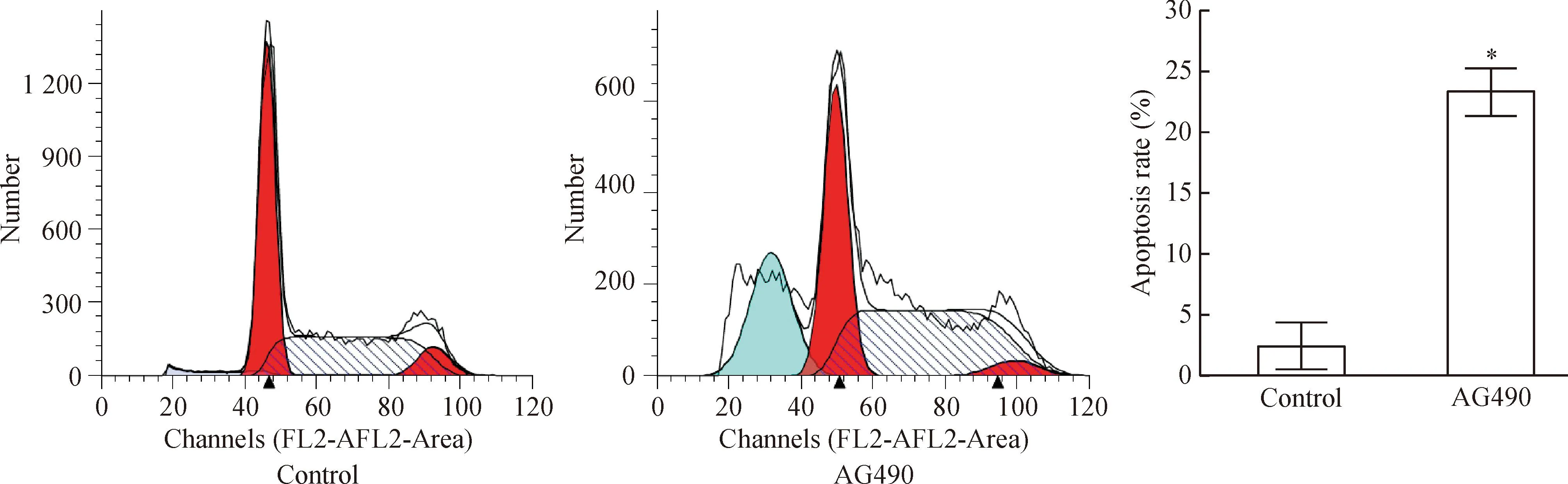
Figure 3.The cell apoptosis was detected by flow cytometry. Mean±SD.n=3.*P<0.05vscontrol.
图3流式细胞术检测细胞凋亡
4AG490对HEL细胞迁移的影响
因细胞活力在20 μmol/L AG490作用24 h后与对照组比较无显著差异,因此我们在20 μmol/L AG490实验组与对照组24 h后进行细胞迁移实验。结果显示与对照组相比,20 μmol/L AG490作用HEL 24 h后,漏入下室的细胞数明显减少(P<0.01)。
5JAK2 mRNA表达水平的变化
RT-PCR结果显示,不同浓度AG490作用48 h后,实验组JAK2的mRNA表达明显减低,并随着药物浓度的增加呈逐渐减低趋势,与对照组有统计学差异,见图4。
6AG490处理HEL细胞后p-JAK2、VEGF和HIF-1α蛋白水平的变化
Western blot结果显示,与对照组相比,随着AG490浓度的加大,48 h后 HEL细胞的p-JAK2蛋白水平呈逐渐减低的趋势,VEGF和HIF-1α的蛋白水平随着药物浓度的加大而逐渐下降,而对照组无明显变化,见图5。相关分析显示VEGF与p-JAK2二者呈正相关性(r=0.991,P<0.01);HIF-1α与p-JAK2亦呈正相关性(r=0.993,P<0.01)。
讨论
JAK-STAT传导通路在细胞生长、分化、免疫功能和造血中发挥重要生理、病理作用[4]。目前,越来越多的研究报道JAK2-STAT5在多种组织及细胞系中异常表达和活化,并与肿瘤的增殖、分化、凋亡、血管新生及肿瘤侵袭有密切关系。
骨髓增殖性肿瘤是一类起源于造血干细胞的血液系统恶性疾病,主要特点为骨髓中一系或多系细胞异常增殖[5]。研究报道,骨髓增殖性肿瘤患者大多存在JAK2V617F突变,此突变作为一种组成性激活酪氨酸激酶,在缺乏细胞因子的情况下自发性激活JAK2-STAT5信号通路[6-7]。
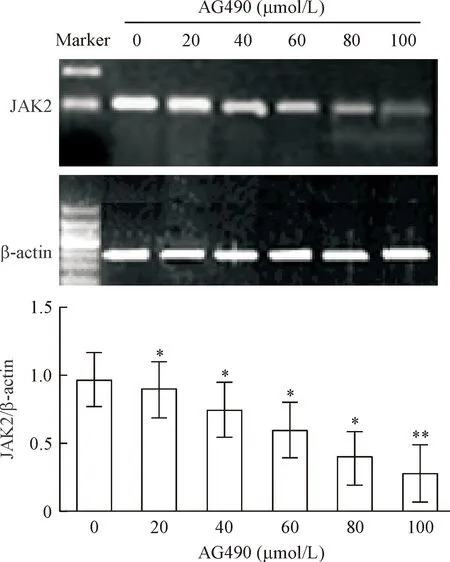
Figure 4.The mRNA expression level of JAK2 was measured by RT-PCR. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol.
图4RT-PCR检测细胞JAK2的mRNA水平
HEL细胞是JAIK2V617F突变阳性人红白血病细胞,其JAK2-STAT5信号通路活化,而AG490可通过阻断JAK2-STAT5通路抑制细胞增殖[8],因此本研究选用JAK2抑制剂AG490,抑制其JAK2信号通路。Oku等[9]通过siRNA阻断JAK2-STAT5,发现JAK2V617突变的骨髓增殖性肿瘤细胞增殖明显受到抑制,同时也认为JAK2V617F不仅磷酸化下游STAT5,可能同时激活Ras/MEK/ERK和PI3K/Akt通路,共同发挥促进HEL细胞增殖及抑制凋亡作用。本研究结果显示,不同浓度AG490作用于HEL细胞后,JAK2 的mRNA表达水平呈剂量及时间依赖性减低,同时p-JAK2的蛋白水平水平亦随着药物剂量的增大逐渐降低,表明JAK2信号通路受到抑制,AG490作用HEL细胞后,细胞活力明显降低,凋亡细胞较对照组明显增多,提示JAK2介导的信号通路有促进细胞增殖、抑制凋亡作用,考虑可能的机制为JAK2V617F自发性激活下游的JAK2-STAT5、Ras/MEK/ERK和PI3K/Akt等通路,导致参与细胞增殖、细胞凋亡的基因如Bcl-xL、Mcl-1、cyclin D1/D2和c-myc等表达上调有关。
Figure 5.The protein levels of p-JAK2, VEGF and HIF-1α were detected by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图5Western blot检测细胞p-JAK2、VEGF和HIF-1α的蛋白水平
研究表明血管新生在血液系统肿瘤如白血病、多发性骨髓瘤、淋巴瘤中发挥重要作用,血管新生的程度目前已成为预测肿瘤患者的预后指标。有研究显示:在初治AML患者骨髓中,其MVD是正常人骨髓的2倍,经治疗缓解后患者MVD较前明显下降[10]。Panteli等[11]和Boveri等[12]研究报道骨髓增殖性肿瘤患者骨髓中微血管密度明显高于正常人,同时存在VEGF及其受体VEGFR高表达,微血管密度随着VEGF表达增加逐渐增大[12],并提出可能与JAK2V617F突变负荷密切相关[13]。
有证据表明, VEGF相关的通路是新血管生成和招募内皮祖细胞的最相关的调节器。VEGF是目前认为促进血管新生最重要的因子,其表达受内在和外在因素的调控,其中组织缺氧是VEGF重要的刺激因素,HIF-1α可通过与VEGF mRNA结合诱导VEGF表达,目前已发现肿瘤内缺氧和HIF-1α是触发血管新生的关键因素[2]。通常情况下,血管生成是由内源性抗血管生成及促血管生成因子的平衡保持,在HIF-1α和VEGF受到异常刺激时,VEGF及其受体可通过自分泌或旁分泌途径刺激内皮细胞增殖,促进血管新生及肿瘤转移。本研究结果表明,HEL细胞中的p-JAK2呈高水平,同时存在促血管新生因子VEGF和HIF-1α表达增加。在应用JAK2抑制剂AG490后,JAK2 mRNA表达及p-JAK2蛋白水平明显减低,呈剂量和时间依赖性,随着JAK2表达的降低,VEGF和HIF-1α蛋白表达水平亦明显下降,与JAK2表达呈正相关性。结果表明抑制JAK2突变可抑制HEL细胞分泌VEGF和HIF-1α,下调VEGF和HIF-1α蛋白表达水平,与国外研究结果相一致。Transwell小室实验结果表明,AG490作用于HEL细胞24 h后,进入下室细胞明显减少,与对照组有明显差异,提示降低骨髓增生性肿瘤患者VEGF和HIF-1α蛋白表达水平可抑制肿瘤细胞转移,其作用机制可能为AG490通过抑制JAK2磷酸化,进一步导致STAT活化受抑,干扰下游靶基因与VEGF、HIF-1α启动基因结合,下调VEGF和HIF-1α蛋白表达,从而引起二者参与的血管生成受到抑制及细胞转移能力下降[14]。
综上所述,AG490通过抑制HEL细胞JAK2信号通路,抑制血管新生因子VEGF和HIF-1α的表达,进而参与抑制血管新生作用。
[参考文献]
[1]Medinger M, Passweg J. Angiogenesis in myeloproliferative neoplasms, new markers and future directions[J]. Memo, 2014, 7:206-210.
[2]Song G, Li Y, Jiang G. Role of VEGF/VEGFR in the pathogenesis of leukemias and as treatment targets[J]. Oncol Rep, 2012, 28(6):1935-1944.
[3]Amelio I, Inoue S, Markert EK, et al.TAp73 opposes tumor angiogenesis by promoting hypoxia-inducible factor 1α degradation[J]. Proc Natl Acad Sci U S A, 2015, 112(1):226-231.
[4]Quintás-Cardama A,Verstovsek S. Molecular pathways: Jak/STAT pathway: mutations, inhibitors, and resistance[J]. Clin Cancer Res, 2013, 19(8):1933-1940.
[5]成志勇,黄月华,梁文同,等.骨髓增殖性肿瘤中JAK2V617F 突变与Ⅰ型细胞因子受体相关性研究[J]. 中国全科杂志,2012, 15(9):1019-1022.
[6]郭慧梅,潘崚,贺建辉,等. 骨髓增殖性肿瘤患者血栓栓塞的相关因素[J]. 肿瘤防治研究, 2013, 40(10):958-960.
[7]成志勇,李士辉,杨琳,等. 干扰素α对JAK2V617F阳性的骨髓增殖性疾病的影响[J]. 实用肿瘤杂志, 2008, 23(4):318-321.
[8]任艳玲,佟红艳. 高三尖杉酯碱联合AG490 对HEL 细胞JAK2-STAT5相关信号通路的影响[J]. 中国实验血液学杂志, 2011, 19(5):1117-1120.
[9]Oku S, Takenaka K, Kuriyama T, et al. JAK2 V617F uses distinct signaling pathways to induce cell proliferation and neutrophil activation[J]. Br J Haematol, 2010, 150(3): 334-344.
[10]Negaard HF, Iversen N, Bowitz-Lothe IM, et al. Increased bone marrow microvascular density in haematological malignanciesis associated with differential regulation of angiogenic factors[J]. Leukemia, 2009, 23(1):162-169.
[11]Panteli K, Zagorianakou N, Bai M, et al.Angiogenesis in chronic myeloproliferative diseases detected by CD34 expression[J]. Eur J Haematol, 2004, 72(6):410-415.
[12]Boveri E, Passamonti F, Rumi E, et al. Bone marrow microvessel density in chronic myeloproliferative disorders: a study of 115 patients with clinicopathological and molecular correlations[J]. Br J Haematol, 2009, 140(2):162-168.
[13]Medinger M, Skoda R, Gratwol A, et al. Angiogenesis and vascular endothelial growth factor/receptor expression in myeloproliferative neoplasms: correlation with clinical parameters and JAK2-V617F mutational status[J]. Br J Haematol, 2009, 146(2):150-157.
[14]侯大乔,王海琳,靳亚妮. AG490对人宫颈癌Hela细胞增殖、凋亡及侵袭性的影响及机制[J]. 第四军医大学学报,2009,30(24):3022-3025.
(责任编辑: 林白霜, 罗森)

*[基金项目]广东省科技计划(No. 2014A020212126)
Effect of AG490 on expression of VEGF and HIF-1α in HEL cellsXU Qian1, 2, ZHAO Ya-ling1, 2, FU Jian-zhu1, 2, GU Lei2, LIU Gui-min1, 2, LIANG Wen-tong2, CHENG Zhi-yong2
(1ChengdeMedicalCollege,Chengde067000,China;2DepartmetofHematology,TheFirstHospitalofBaoding,Baoding071000,China.E-mail:liangwentong1967@sina.com;dzczy@sohu.com)
[ABSTRACT]AIM: To investigate the effect of AG490 on the expression of VEGF and HIF-1α, and the capacity of invasion in human erythroleukemia (HEL) cells. METHODS: The HEL cells were treated with AG490 at different concentrations. The cell viability was detected by CCK-8 assay. The apoptosis was detected by Hoechst staining. The apoptosis and the cell cycle were analyzed by flow cytometry. The capacity of migration was evaluated by Transwell assay. The mRNA expression level of JAK2 was measured by RT-PCR. The protein levels of p-JAK2, VEGF and HIF-1α were determined by Western blot. RESULTS: The HEL cell viabilities were 88%, 75%, 48%, 10% and 0.12% after treated with AG490 at 20, 40, 60, 80 and 100 μmol/L for 48 h, respectively. The results of Hoechst staining showed that brilliant blue cells in 80 μmol/L AG490 group was significantly increased compared with control group for 48 h. The apoptosis rate of 80 μmol/L AG490 group was significantly increased compared with control group at 48 h after AG490 treatment. The number of membrane-permeating HEL cells in 20 μmol/L AG490 group at 24 h after AG490 treatment was significantly lower than that in control group (P<0.05). The mRNA level of JAK2 decreased in a concentration-dependent manner after the HEL cells were treated with different concentrations of AG490 for 48 h. The protein levels of p-JAK2, VEGF and HIF-1α were lower in AG490 treatment groups than those in control group (P<0.05). CONCLUSION: AG490 inhibits the expression of VEGF and HIF-1α in HEL cells by inhibiting JAK2 pathway.
[KEY WORDS]Myeloproliferative neoplasms; Angiogenesis; VEGF; HIF-1α
通讯作者△Tel: 020-87334871; E-mail: ethanyu@sina.com
[收稿日期]2015- 08- 18[修回日期] 2015- 09- 11
[文章编号]1000- 4718(2015)12- 2164- 05
doi:10.3969/j.issn.1000- 4718.2015.12.008
[中图分类号]R730.23
[文献标志码]A
