抗结核固定剂量复合剂微生物限度检查方法的建立和验证
2016-01-27陈娟
陈 娟
抗结核固定剂量复合剂微生物限度检查方法的建立和验证
陈 娟
【摘要】目的 探讨抗结核固定剂量复合剂的微生物限度检查方法的建立。方法 按照《中国药典》2010年版附录X ⅢC进行验证实验。结果 抗结核固定剂量复合剂对金黄色葡萄球菌、枯草芽胞杆菌、大肠埃希菌有一定的抑制作用。结论 抗结核固定剂量复合剂对细菌的计数方法应为离心沉淀法-薄膜过滤法,常规法进行霉菌(酵母菌)计数检验,薄膜过滤法进行控制菌检验。
【关键词】验证试验;抗结核固定剂量复合剂;离心沉淀集菌-薄膜过滤法;常规法
【中图分类号】R978.3;R927.1
【文献标志码】A
【文章编号】1673-5846(2015)10-0023-04
【Abstract】Objective To set up a method for microbial limit of Rifampin and Isoniazid Tablets.Methods Validation of microbial limit tests according to Chinese Pharmacopoeia edition 2010.Results FDCs has very strong inhibiting effect on Staphylococcus aureus,Bacillus subtilis and Candida albicans.Conclusion Low speed centrifuge-filtration methods were used with take count of bacterium;General methods were used with take count of mold and yeasts of FDCs.Pathogenic bacteria can be tested when filtration methods were used.
贵州省毕节市食品药品检验所,贵州毕节 551700
Establishment and Validation of Microbial Limit Method for Anti-tuberculosis Fixed Dose Combinations
Chen Juan
【Key Words】Validation;FDCs;Filtration method;General method
世界卫生组织为遏制全球结核病的威胁,主张使用抗结核药物的固定剂量复合剂(FDCs)代替抗结核单药制剂来治疗结核病患者。使用FDCs可以提高单一化疗效果,减少耐药菌的产生,根据患者服药剂量,无需详细计算药物剂量,以简便处方和服用。因为FDCs中的利福平有一定程度的抑菌作用,所以在对有抗菌活性的药物进行微生物限度检查时,必须先消除其抗菌活性,通过试验验证抗菌活性去除是否彻底,保证检验结果的有效性。为了消除FDCs的抗菌活性,真实地反映该药物所污染微生物的程度,参考《中国药典》[1]和研究资料[2-4]对FDCs进行微生物限度检验方法验证。本试验采用2010年版中国药典规定的3株细菌(大肠埃希菌、金黄色葡萄球菌、枯草芽胞杆菌)、2株真菌(黑曲霉菌、白色念珠菌),采用常规法和低速离心-薄膜过滤法分别对3批利福平异烟肼片、乙胺利福异烟片、乙胺吡嗪利福异烟片进行细菌、霉菌及酵母菌计数和控制菌进行方法验证,建立适合于FDCs的微生物限度检查方法。
1 仪器与材料
1.1 试验仪器 GHP-9000型隔水式恒温培养箱(上海益恒实验仪器有限公司);HC-TP-12型架盘天平(天津市天平仪器有限公司);LMQ.C型立式压力蒸汽灭菌锅(山东新华医疗器械股份有限公司);TG16-WS型台式离心沉淀器(长沙湘仪离心机仪器有限公司);SHA-C型电热恒温振荡器(金坛市盛蓝仪器制造有限公司);DLM型鼓风干燥箱(常州创威实验仪器厂);薄膜过滤器(毕节市食品药品检验所)。
1.2 试验材料 异福片(沈阳红旗制药有限公司,批号:1009011、1009021、1009031);利福平异烟肼片(沈阳红旗制药有限公司,批号:1009011、1009021、1009031);乙胺吡嗪利福异烟片(沈阳红旗制药有限公司,批号:1009011、1009021、1009031);大肠埃希菌(Escherichiacoli)[CMCC (B)44102];金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003];枯草芽胞杆菌(Bacillus subtilis)[CMCC(B)63501];白色念珠菌(Candida albicans)[CMCC(F)98001];黑曲霉(Aspergillus niger)[CMCC(F)98003];菌种来源(中国药品生物制品检定所提供,各菌株均为第3代)。
1.3 培养基 营养琼脂(岛高科园海博生物技术有限公司,批号:20131121);改良马丁培养基(岛高科园海博生物技术有限公司,批号:20120907);胆盐乳糖培养基(北京陆桥技术有限责任公司,批号:111006);玫瑰红钠琼脂(北京陆桥技术有限责任公司,批号:110109);麦康凯琼脂培养基(北京陆桥技术有限责任公司,批号:121024);MUG培养基
(北京陆桥技术有限责任公司,批号:110212),按照《中国药典》2010年版规定配制及灭菌。
2 试验方法
2.1 供试品溶液的制备 取供试品10 g,加入200 ml 的pH7.0无菌氯化钠-蛋白胨缓冲液,置40 ℃水浴中溶化,振摇,制成1:10的供试品溶液。
2.2 菌液制备 ①取经35 ℃培养24 h的大肠埃希菌、金黄色葡萄球菌、枯草芽胞杆菌的肉汤培养物,用0.9%无菌氯化钠溶液制成每1 ml含细菌数为10~100 cfu的菌悬液,做活菌技术用。②取培养48 h的白色念珠菌至改良马丁琼脂斜面培养基中,用0.9%无菌氯化钠溶液制成1 ml含细菌数为10~100 cfu的菌悬液,做活菌技术用。③接种预先活化的黑曲霉菌种至改良马丁琼脂斜面培养基中,培养7 d,用0.9%无菌氯化钠溶液制成1 ml含细菌数为10~100 cfu的菌悬液,做活菌技术用。
2.3 验证步骤
2.3.1 细菌、霉菌及酵母菌计数方法
2.3.1.1 常规法 ①供试品对照组:取静置15 min 的1:10的供试液1 ml,测定供试品的本底菌数。②试验组:供试液放置15 min后,取1 ml注入一平皿中,然后再取含细菌数为10~100 cfu的试验菌液1 ml,立即倾注20 ml营养琼脂培养基,每株试验菌平行制备2个平皿,按平皿法测定菌落数。③稀释剂对照组:分别取10~100 cfu的试验菌和稀释剂各1 ml,按试验组菌数测定方法测定菌数。④菌液组:测定所加的试验菌数。
2.3.1.2 离心沉淀集菌+薄膜过滤法 取静置15 min 后1:20的供试液的上清液10 ml,经500转3 min离心后,吸取5 ml(菌种的回收率能达到70%以上),然后再加入100 ml的pH7.0无菌氯化钠-蛋白胨缓冲液混匀,通过滤膜,用500 ml的上述缓冲液分次冲洗,每次80 ml,最后在冲洗液中加入试验菌,过滤,将滤膜贴于营养琼脂培养基上培养,测定菌数。①供试品对照组:测定供试品本底菌数。②试验组:取离心后的上清液适量,按上述方法测定试验组菌数。③稀释剂对照组:取供试品对照组供试液等量的稀释剂和10~100 cfu试验菌,按试验组的菌数测定方法测定菌数。④菌液组:主要测定试验中所加入的菌数是否合适。
2.3.2 验证控制菌的检查方法 菌液的制备:将活化好的大肠埃希菌、金黄色葡萄球菌菌种接种至营养琼脂培养基中,24 h后将上述培养物用0.9%无菌氯化钠溶液制成1 ml含10~100 cfu的菌悬液。
2.3.2.1 常规法 ①阴性菌对照组:取静置15 min后供试液(1:20)10 ml,加入100 ml LBL增菌培养基中,然后再加入金黄色葡萄球菌试验菌,摇匀,按照控制菌检查法检查。②试验组:取静置15 min后供试液(1:20)10 ml及大肠埃希菌的试验菌入100 ml LBL增菌培养基中,混匀,依照控制菌法检查。
2.3.2.2 薄膜过滤法 ①阴性菌对照组:供试液静置15 min后,取上清液10 ml于50 ml pH7.0的无菌氯化钠-蛋白胨缓冲液中摇匀,过滤,用上述溶液500 ml分次冲洗滤膜,每次50 ml,最后在冲洗液中加入上述金黄色葡萄球菌,取出滤膜接入100 ml LBL增菌培养基中,按照大肠埃希菌法检查。②试验组:供试液静置15 min后,取上清液10 ml于100 ml pH7.0的无菌氯化钠-蛋白胨缓冲液中摇匀,过滤,用该溶液500 ml分次冲洗滤膜,每次50 ml,最后在冲洗液中加入上述大肠埃希菌,取出滤膜接入100 ml LBL增菌培养基中,按照大肠埃希菌法检查。
2.4 结果及回收率测定判断标准


3 结果
3.1 利福平异烟肼片试验结果 见表1~3。
3.2 乙胺利福异烟片试验结果 见表4~6。
3.3 乙胺吡嗪利福异烟片试验结果 见表7~9。

表1 利福平异烟肼片枯草芽胞杆菌、金黄色葡萄球菌、大肠埃希菌验证结果
4 结论
通过试验结果可以看出,利福平异烟肼片、乙胺利福异烟片、乙胺吡嗪利福异烟片微生物限度检查法,细菌计数可采用离心沉淀集菌+薄膜过滤法,且供试品的供试液终浓度为1:1000;霉菌(酵母菌)
计数可采用常规法;控制菌检查可采用薄膜过滤法进行检验。
由于抗结核固定剂量复合剂具有很强的抑菌作用,在检验时应排除其抑制作用,使其不干扰染菌限度检查,结果才有效。
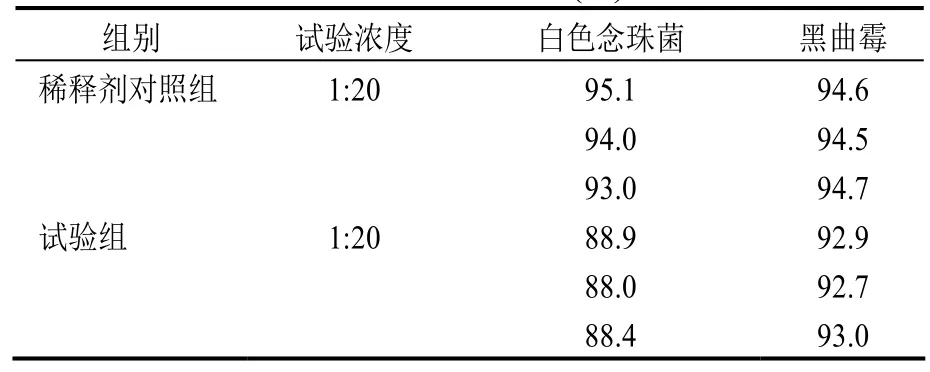
表2 常规法验证利福平异烟肼片白色念珠菌、黑曲霉的回收率(%)

表3 控制菌试验结果

表4 乙胺利福异烟片枯草芽胞杆菌、金黄色葡萄球菌、大肠埃希菌验证结果

表5 常规法验证乙胺利福异烟片白色念珠菌、黑曲霉的回收率(%)
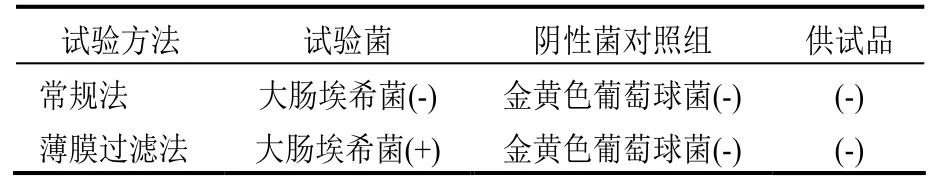
表6 控制菌常规法试验结果

表7 乙胺吡嗪利福异烟片枯草芽胞杆菌、金黄色葡萄球菌、大肠埃希菌验证结果

表8 常规法验证乙胺吡嗪利福异烟片白色念珠菌、黑曲霉的回收率(%)

表9 控制菌常规法试验结果
参考文献
[1] 中华人民共和国国家药典委员会.中国药典·二部(附录)2010
版[S].北京:中国医药科技出版社,2012:107-116.
[2] 中国药品生物制品检定所.中国药品检验标准操作规范[S].北京:中国医药科技出版社,2010:351-389.
[3] 刘鹏,马仕洪,戴翠,等.加替沙星微生物限度检查方法的建立[J].药物分析杂志,2007,27(6):881-881.
[4] 马绪荣.药品微生物学检验手册[M].北京:科学出版社,2000: 289-290.
