盐酸氯苯胍灌服后在兔尿液和粪便中的排泄规律
2016-01-25田苗苗郭春娜怀彬彬黄显会华南农业大学国家兽药残留基准实验室广东广州510642
田苗苗,郭春娜,怀彬彬,郜 进,黄显会(华南农业大学国家兽药残留基准实验室,广东广州510642)
盐酸氯苯胍灌服后在兔尿液和粪便中的排泄规律
田苗苗,郭春娜,怀彬彬,郜进,黄显会
(华南农业大学国家兽药残留基准实验室,广东广州510642)
摘要:【目的】建立氯苯胍在兔尿液和粪便中的高效液相色谱检测方法,以测定氯苯胍在兔排泄物中的排泄量.【方法】12只健康新西兰大白兔灌服盐酸氯苯胍15 mg·kg-1后,于不同时间间隔收集其所有粪便和尿液,粪便称质量、尿液定容后冻存.称取0.2 g粪便,用体积比为2∶1的三氯甲烷-甲醇混合液提取,氮气吹干;量取1 mL兔尿,用体积分数为0.2%乙酸酸化的乙酸乙酯提取,氮气吹干,残渣均用乙腈-水(体积比30∶70)溶液复溶,CNW HLB柱净化,浓缩后用甲醇定容,上机检测.【结果和结论】氯苯胍在兔尿中的检测限与定量限分别为0.005和0.01 μg·mL-1,通过尿液排泄的氯苯胍占给药总量的比例为0.56%;在兔粪便中的检测限与定量限分别为0.01和0.05 μg·g-1,通过粪便排泄的氯苯胍占给药总量的比例为87.17%.氯苯胍在兔尿和粪便中排出高峰期分别在给药后0~6和6~12 h,占给药后累积排泄总量的比例分别为28.37%和38.46%.结果显示,该检测方法满足测定氯苯胍在兔尿和粪便中排泄量的要求,内服盐酸氯苯胍后大部分氯苯胍随尿液和粪便排出体外.
关键词:兔;排泄物;氯苯胍;高效液相色谱法;残留检测
田苗苗,郭春娜,怀彬彬,等.盐酸氯苯胍灌服后在兔尿液和粪便中的排泄规律[J].华南农业大学学报,2015,36(3) : 8-12.
优先出版时间:2015-04-14
优先出版网址: http: / /www.cnki.net/kcms/detail/44.1110.s.20150414.0945.020.html
氯苯胍(Robenidine)又称双氯苄氨胍、罗苯嘧啶,是一种人工合成的抗球虫药,常用其盐酸盐,分子式为C15H13Cl2N5·HCl,相对分子质量为370.66,化学名: 1,3-双-对氯苯叉氨基胍盐酸盐.我国批准的制剂有盐酸氯苯胍片和预混剂,用于预防和治疗鸡、兔的急性、慢性球虫病.农业部第235号公告规定:氯苯胍在鸡体内的残留标示物为氯苯胍,皮与脂肪中的最大残留限量为200 μg·kg-1,其他可食组织为100 μg·kg-1[1],目前为止,大鼠和鸡体内氯苯胍代谢和排泄也已有文献报道[2-3].本研究参考国内外报道的氯苯胍的HPLC、HPLC-MS/MS检测方法[4-11],通过多次试验,最终建立了氯苯胍在兔尿液和粪便中的高效液相色谱分析方法,并探讨了兔内服盐酸氯苯胍后体内的排泄情况,并对排泄物中氯苯胍所占总给药量比例以及不同时间段的排泄率进行了分析,以期对制定氯苯胍在兔体内的残留标示物和最大残留限量提供基础性资料.
1 材料与方法
1.1药品与试剂
盐酸氯苯胍对照品(质量分数为99.8%,批号H0041110),购自中国兽医药品监察所;盐酸氯苯胍原料药(盐酸氯苯胍质量分数95.99%),由广州绿州生物技术有限公司提供.
乙酸、乙酸乙酯、三氯甲烷、三乙胺、磷酸二氢铵均为分析纯(广州化学试剂厂),甲醇、乙腈、甲酸均为色谱纯(Sigma公司)
1.2仪器与设备
高效液相色谱仪: ALLIANCE Waters e2695,配备四联泵、脱气泵、色谱工作站、紫外检测器、自动进样器,美国WATERS公司.高速冷冻离心机,美国Beckman-Coulter公司Avanti®J-26 XP型.台式冷冻离心机,ThermoFisher德国Sorvall公司,LEGEND Mach1.6R型.旋涡混合仪,上海青浦沪西仪器厂XW-80A.电子分析天平:日本/岛津AUW120型.
1.3药液配制
储备液的配制:称取适量的盐酸氯苯胍标准品于10 mL棕色容量瓶中,用甲醇溶解,制成含氯苯胍1 000 μg·mL-1的标准储备液.置4℃冰箱保存,使用期为1个月.
内服液配制:称取适量的盐酸氯苯胍原料药,用质量分数为0.5%羧甲基纤维素钠稀释成15 mg·mL-1的混悬液,现用现配.
1.4试验动物
14只健康的4月龄大的新西兰大白兔,体质量为(2.00±0.12) kg,购自南方医科大学实验动物中心(生产许可证号20110015).
1.5给药与采样
14只兔分为2组(每组公母各半),试验组12只,空白组2只.试验组按15 mg·kg-1体质量剂量单次灌胃给药,给药后分别于0~6、6~12、12~24、24~36、36~48、48~60、60~72、72~84、84~96、96~108、108~120、120~132、132~144 h时间段收集其全部粪便和尿液,记录粪便总质量和尿液总体积,取部分于-20℃冰箱保存,待测.空白组不给药,饲喂不含药的空白饲料,收集粪便和尿液用于氯苯胍检测的方法学研究.
1.6尿液和粪便中氯苯胍的测定
1.6.1样品前处理精密量取尿液(1.00±0.01) mL,加入体积分数为0.2%乙酸酸化的乙酸乙酯3 mL,涡旋1 min,280 r·min-1振荡10 min,10 000 r·min-1离心10 min,取上清液,重复提取2次,于45℃水浴N2流下吹干,加入6 mL乙腈-水[V(乙腈)∶V(水) = 30∶70]溶液复溶备用,过HLB小柱.HLB小柱用3 mL甲醇活化,3 mL水平衡,之后将备用液过柱,用5 mL水淋洗之后用5 mL甲醇洗脱,收集洗脱液并于45℃水浴N2流下吹干,残渣用1 mL甲醇复溶,过0.22 μm滤膜,进行HPLC分析.
精密称取粪便(0.200±0.001) g,加入3 mL三氯甲烷-甲醇混合液[V(三氯甲烷)∶V(甲醇) =2∶1]涡旋1 min,于280 r·min-1振荡10 min,10 000 r·min-1离心10 min,取上清液,重复提取2次,于45℃水浴N2流下吹干,加入6 mL乙腈-水[V(乙腈)∶V(水) = 30∶70]溶液复溶备用,过HLB小柱.HLB小柱用3 mL甲醇活化,3 mL水平衡,之后将备用液过柱,用5 mL水淋洗之后用5 mL甲醇洗脱,收集洗脱液并于45℃水浴N2流下吹干,残渣用1 mL甲醇复溶,过0.22 μm滤膜,进行HPLC分析.
1.6.2色谱条件色谱柱: Gemini C18100 A(250 mm×4.0 mm,5 μm),美国Penomenex公司;紫外检测波长: 317 nm;流动相: V(磷酸二氢铵溶液)∶V (乙腈) = 35∶65;柱温: 25℃;流速: 1 mL·min-1;进样量为20 μL.
1.6.3标准曲线与线性范围取(1.00±0.01) mL空白尿液和(0.20±0.001) g空白粪便若干,分别置于15 mL离心管中,依次加入100 μL系列质量浓度的氯苯胍标准液,涡旋混匀,使得尿液样品中的氯苯胍质量浓度分别为0.01、0.05、0.10、0.20、0.50、2.00 μg·mL-1;粪便样品中制得的氯苯胍质量分数分别为0.05、0.10、0.50、2.00、10.00、40.00 μg·g-1.按“1.6.1”方法处理并按“1.6.2”液相条件进行测定,将氯苯胍的色谱峰面积(A)与相对应的药物质量浓度(C)作直线回归,求得标准曲线方程和相关系数.
1.6.4回收率和变异系数准确称取(0.200± 0.001) g空白粪便和量取(1.00±0.01) mL空白尿液,分别加入氯苯胍标准工作液,使得粪便中药物质量分数分别为0.05、1.00、40.00 μg·g-1,尿液中药物质量浓度分别为0.01、0.10、2.00 μg·mL-1.按“1.6.1”方法处理,计算回收率和变异系数.
1.6.5检测限与定量限称取(0.200±0.001) g空白粪便和取空白尿液(1.00±0.01) mL,加入氯苯胍标准液,使尿液样品中的氯苯胍质量浓度为0.001、0.005、0.010、0.020、0.050、0.200 μg·mL-1,粪便样品中氯苯胍质量分数分别为0.005、0.010、0.050、0.200、1.000,2.000 μg·g-1,按“1.6.1”方法处理,并按“1.6.2”液相条件进行测定,每个浓度设3个平行,分3个批次,以S/N≥3计算检测限(LOD),以S/N≥10计算定量限(LOQ).
1.6.6尿液和粪便中氯苯胍浓度测定给药后不同时间段的样品,按“1.6.1“方法处理后作HPLC分析,记录氯苯胍峰面积,以标准曲线回归方程计算样品中氯苯胍的质量.
2 结果
2.1尿液和粪便中氯苯胍检测的方法学
2.1.1氯苯胍的色谱行为氯苯胍标准溶液,空白样品、空白添加样品色谱分析见图1.

图1 各样品的HPLC图Fig.1 The HPLC of samples
2.1.2标准曲线及精密度按“1.6.1”方法处理并按“1.6.2”液相条件进行测定,兔尿液中添加氯苯胍0.01~2.00 μg·mL-1线性关系良好,线性方程为C =8.5×10-3A–12.53,r2=0.999 8;兔粪便中添加氯苯胍0.05~40.00 μg·g-1线性关系良好,线性方程为C =9.7×10-3A +77.74,r2=0.999 9.
2.1.3回收率与变异系数在兔的尿液样品中,氯苯胍的质量浓度为0.01、0.10、2.00 μg·mL-1时平均回收率分别为79.8%、77.6%、79.1%;粪便中氯苯胍的质量分数为0.05、1.00、40.00 μg·g-1时,平均回收率分别为84.3%、82.6%、78.8%.批内和批间变异系数均小于10.0%.
2.1.4检测限与定量限兔尿液中氯苯胍的检测限为0.005 μg·mL-1,定量限为0.01 μg·mL-1;兔粪便中氯苯胍的检测限为0.01 μg·g-1,定量限为0.05 μg·g-1.
2.2兔尿液和粪便中氯苯胍的定量分析
兔内服盐酸氯苯胍15 mg·kg-1后,记录每只兔内服盐酸氯苯胍的总质量,计算氯苯胍的总物质的量.内服盐酸氯苯胍后,收集每只兔各时间段所有的粪便和尿液,用高效液相色谱法测出代谢物氯苯胍在各时间段的浓度,根据粪便和尿液的总质量(或体积)最终分别求出粪便和尿液中氯苯胍的量,然后与兔内服盐酸氯苯胍总的质量相比.从表1可以看出,兔内服盐酸氯苯胍后,兔尿中氯苯胍排出高峰在0~6 h,占排泄累积总量的28.371%;粪便中排出高峰在6~12 h,占排泄累积总量的38.462%.主要排泄时间在给药后的60 h之内,占总排泄量的90%以上,给药后72 h基本排泄完毕,累积排泄达99.25%.粪便和尿液中排泄出的氯苯胍所占兔内服总量的比例分别为87.17%和0.56%,合计为87.73%.通过粪便排泄的比例远远大于尿液排泄的比例.给药后120 h排泄完毕.
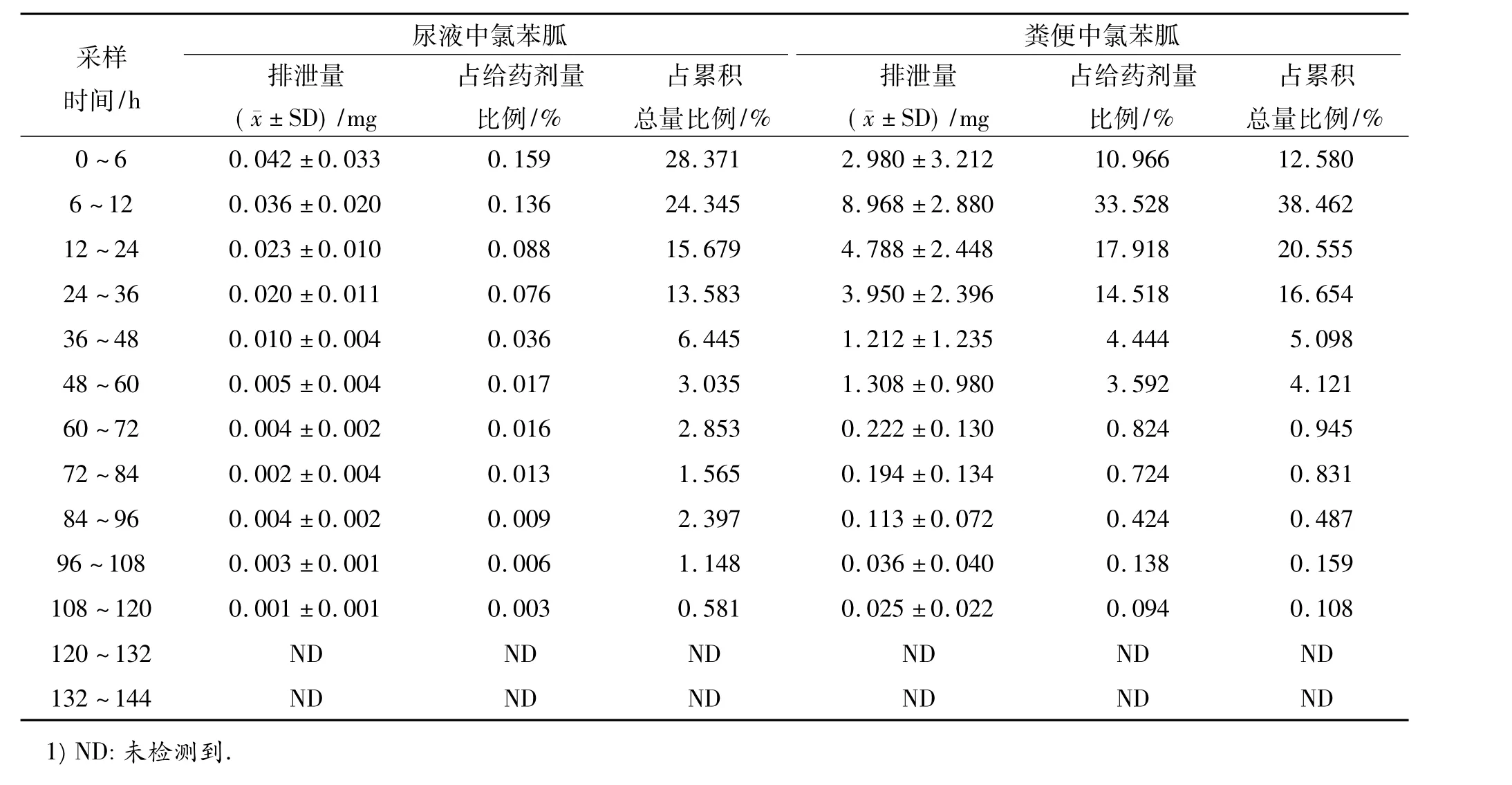
表1 不同时间段尿液和粪便中氯苯胍的排泄量1)Tab.1 Excretion of robenidine in urine and feces at different time intervals
3 讨论与结论
3.1处理方法的选择
参考相关文献[3-9],对甲醇、乙腈、乙酸乙酯作为提取溶剂进行考察,结果发现尿液中乙酸乙酯的提取效果比较好.盐酸氯苯胍属于弱酸性化合物,理论上讲,用酸化有机试剂提取效果优于有机试剂提取.考察了盐酸、乙酸等酸化乙酸乙酯的提取效果,两者提取回收率相当,考虑盐酸的挥发性,最终选择体积分数为0.2%乙酸酸化的乙酸乙酯作为尿液中氯苯胍提取溶剂.由于粪便和尿液中基质差异较大,同样的提取剂在粪便中满足不了检测要求,参考饲料中氯苯胍的提取方法[10-11],加以改进最终确定粪便的提取溶剂为三氯甲烷-甲醇[V(三氯甲烷)∶V(甲醇) =2∶1]混合液.
3.2氯苯胍在兔尿液和粪便中的排泄
药物的排泄回收试验是研究药物体内代谢过程的一个重要方面,通过对不同排泄物中药物及其代谢物含量测定,可以验证药物进入体循环及其主要的代谢途径.外源性药物通过内服给药后,一部分通过小肠等部位吸收进入体循环,其他在肠道随粪便排出体外.进入体循环的药物消除一般有2种方式,一是不经任何代谢转化而直接以原药的形式排出体外,另一种是在肝脏等组织中经代谢酶催化作用,代谢转化为其他代谢物的形式经胆汁或肾排出体外.
Zulalian等[2]以14C标记法对氯苯胍在大鼠体内代谢的研究结果显示,氯苯胍在大鼠体内最终以70.4%原形随粪便排出体外,随尿液排出的氯苯胍占给药总剂量的2.0%,以对氯苯甲酰氨基乙酸和对氯苯甲酸为主要代谢物形式随尿液排出体外,代谢物占总放射活性的12%,其中对氯苯甲酰氨基乙酸占该代谢物形式的98%.Zulalian等[3]以14C标记形式对氯苯胍在鸡体内的研究结果表明,粪便中存在有99%的放射活性物质,这些放射性物质中大部分是氯苯胍原药,部分以代谢物形式存在.
本研究表明,兔内服盐酸氯苯胍后,随粪便排泄出的氯苯胍占内服总量的87.17%,尿液中氯苯胍占内服总量的0.56%.尿液中氯苯胍排出峰值在0~6 h,粪便中氯苯胍排出峰值在6~12 h.兔内服氯苯胍后120~132 h,粪便和尿液中氯苯胍浓度已低于检测限.表明兔内服氯苯胍后主要以原药的形式排出体外,这与大鼠和鸡体内氯苯胍的排泄规律结果一致.根据相关研究[2-3]以及试验结果分析推测,兔内服氯苯胍后,大部分药物没有被吸收,随着粪便排出体外,而约12%的药物被吸收后,在体内经代谢后转化成结合物形式或其他小分子化合物随尿液排出体外,是否和鼠中一样,以对氯苯甲酰氨基乙酸和对氯苯甲酸为主要代谢物形式排出还需要进一步深入研究.
参考文献:
[1]中华人民共和国农业部.中华人民共和国农业部第235号公告:动物性食品中兽药残留最高限量[S].北京:中华人民共和国农业部,2002.
[2]ZULALIAN J,GATTERDAM P E.Absorption,excretion,and metabolism of robenz,robenidine hydrochloride[1,3-bis(p-chlorobenzylideneamino) guanidine hydrochloride],in the rat[J].Agric Food Chem,1973,21(5) : 794-797.
[3]ZULALIAN J,CHAMPAGNE D A,WAYNE R S,et al.Absorption,excretion,and metabolism of l,3-bis(p-chlorobenzy1ideneamino) guanidine hydrochloride (robenz robenidine hydrochloride) in the chicken[J].Agric Food Chem,1975,23(4) : 724-730.
[4]班付国,吴宁鹏,李慧素,等.氯苯胍在鸡组织中的残留消除规律研究[J].中国兽药杂志,2012,46(11) : 24-26.
[5]李慧素,吴宁鹏,班付国,等.超高效液相色谱-串联质谱法测定鸡组织中氯苯胍残留[J].中国兽药杂志,2012,47(9) : 26-29.
[6]周昭明,曾勇,金秀娥.鸡、兔组织中氯苯胍残留的检测方法研究[J].中国兽药杂志,2005,39(3) : 19-22.
[7]刘勇军,吴银良,姜艳彬.高效液相色谱法测定鸡组织与鸡蛋中氯苯胍的残留量[J].色谱,2010,28(9) : 905-907.
[8]吴仕辉,陈昆慈,戴晓欣,等.分散固相萃取/高效液相色谱法测定水产品中氯苯胍的残留量[J].分析测试学报,2011,30(12) : 1356-1361.
[9]MALGORZATA O,TERESA S J,PIOTR J.Multi-residue confirmatory method for the determination of twelve coccidiostats in chicken liver using liquid chromatogr tandem mass spectrometry[J].Chromatogra A,2009,1216(46) : 8141-8148.
[10]李俊玲,刘学江,徐强,等.饲料中盐酸氯苯胍的测定[J].饲料广角,2003(15) : 20-23.
[11]KOT-WASIK A,WASIK A.Determination of robenidine in animal feeds by liquid chromatography coupled with diodearray detection and mass spectrometry after accelerated solvent extraction[J].Analytica Chimica Acta,2005,543 (1/2) : 46-51.
【责任编辑柴焰】
Studies on the excretion of robenidine hydrochloride in rabbit urine and feces
TIAN Miaomiao,GUO Chunna,HUAI Binbin,GAO Jin,HUANG Xianhui
(National Reference Laboratory of Veterinary Drug Residues,South China Agricultural University,Guangzhou 510642,China)
Abstract:【Objective】In order to investigate the excretion quantitation of robenidine in rabbit urine and feces,a high performance liquid chromatography (HPLC) method was developed to detect the concentrations of robenidine hydrochloride.【Method】Twelve healthy rabbits were administered robenidine hydrochloride orally with a dose of 15 mg·kg-1.After administration,all of their urine and feces were collected at different time intervals and mass were achieved.Feces 0.2 g was extracted using chloroform-methanol[V(chloroform)∶V(methanol) =2∶1]; urine 1 mL was extracted with φ=0.2% acidified ethyl acetate,and the organic phase was separated and evaporated.The residue was redissolved with acetonitrilewater[V(acetonitrile)∶V(water) = 30∶70]solution,and cleaned up by solid-phase extraction using CNW HLB after being evaporated to dryness; the residue was redissolved in methanol,and then analyzed by HPLC.【Result and conclusion】The results showed that the limit of detection (LOD) and the limit of quantitation (LOQ) of robenidine in urine were 0.005 and 0.01 μg·mL-1respectively,with the proportion of the total administered robenidine being 0.56%; the LOD and the LOQ of robenidine in feces were 0.01 and 0.05 μg·g-1respectively,with the proportion of the total administered robenidine being 87.17%.The excretion peak time of robenidine in urine and feces was 0-6 and 6-12 h respectively,and the total amount of accumulated excretion was 28.37% and 38.46% respectively after administration.The results indicate that this method can be used to detect the concentration of robenidine in rabbitbook=9,ebook=13urine and feces,and most of the administered drug is excreted in the original form of urine and feces.
Key words:rabbit; excrement; robenidine; HPLC; residue determination
基金项目:农业行业标准制修订项目(201391194)
作者简介:田苗苗(1988—),女,硕士研究生,E-mail: 382802372@ qq.com;通信作者:黄显会(1969—),男,高级兽医师,博士,E-mail: xhhuang@ scau.edu.cn
收稿日期:2014-04-20
文章编号:1001-411X(2015) 03-0008-05
文献标志码:A
中图分类号:S859.795
