幼鱼和养成阶段斜带石斑鱼对饲料中脂肪的需要量
2016-01-19董晓慧杨俊江谭北平杨奇慧迟淑艳刘泓宇广东海洋大学水产学院水产动物营养与饲料实验室湛江524025
董晓慧 杨俊江 谭北平杨奇慧 迟淑艳 刘泓宇(广东海洋大学水产学院,水产动物营养与饲料实验室,湛江524025)
幼鱼和养成阶段斜带石斑鱼对饲料中脂肪的需要量
董晓慧 杨俊江 谭北平∗杨奇慧 迟淑艳 刘泓宇
(广东海洋大学水产学院,水产动物营养与饲料实验室,湛江524025)
摘 要:本试验旨在探讨2个生长阶段(幼鱼和养成阶段)斜带石斑鱼对饲料中脂肪的需要量。以鱼油调整饲料脂肪水平,配制5种脂肪水平(7.07%、9.92%、12.92%、15.95%和19.04%)的等氮饲料,分别投喂体重为9.1 g(幼鱼阶段)的斜带石斑鱼8周和体重为102.6 g(养成阶段)的斜带石斑鱼10周。同一生长阶段,每种饲料设3个重复,每个重复幼鱼阶段放养25尾鱼,养成阶段放养20尾鱼。结果表明:1)随着饲料脂肪水平的升高,幼鱼和养成阶段石斑鱼的增重率(WGR)、特定生长率(SGR)、蛋白质效率(PER)、肥满度(CF)和脏体比(VSI)均随着饲料脂肪水平的升高呈先上升后下降趋势,饲料系数(FCR)则呈相反的变化趋势,上述指标均在饲料脂肪水平为12.92%时获得极值。2)随着饲料脂肪水平的升高,幼鱼和养成阶段石斑鱼的全鱼粗蛋白质含量逐渐下降,全鱼和肌肉粗脂肪含量逐渐上升,全鱼和肌肉水分含量无显著变化(P>0.05),全鱼和肌肉其他常规营养成分含量无规律性变化。3)随着饲料脂肪水平的升高,幼鱼和养成阶段石斑鱼的血浆总蛋白(TP)和低密度脂蛋白(LDLC)含量呈逐渐下降趋势,血浆高密度脂蛋白(HDLC)含量呈逐渐升高趋势。幼鱼和养成阶段石斑鱼的血浆甘油三酯(TG)和总胆固醇(CHOL)含量与饲料脂肪水平呈线性或曲线关系。4)随着饲料脂肪水平的升高,幼鱼和养成阶段石斑鱼的肝脏肝脂酶(HL)、脂蛋白脂酶(LPL)、苹果酸脱氢酶(MDH)活性均逐渐下降,而肝脏乳酸脱氢酶(LDH)活性则逐渐上升。5)随着饲料脂肪水平的升高,幼鱼阶段肝脏酸性磷酸酶(ACP)活性无显著变化(P>0.05),养成阶段肝脏ACP活性逐渐下降,幼鱼和养成阶段肝脏超氧化物歧化酶(SOD)活性先升高后降低。幼鱼和养成阶段石斑鱼肝脏碱性磷酸酶(AKP)和溶菌酶(LZM)活性与饲料脂肪水平呈正相关关系。6)随饲料脂肪水平的升高,幼鱼和养成阶段石斑鱼的胃肠道胃蛋白酶和淀粉酶活性逐渐下降,胃肠道脂肪酶活性逐渐上升。综上,在本试验条件下,饲料中适宜水平的脂肪可以改善幼鱼和养成阶段斜带石斑鱼的生长性能,且对体成分、生化指标和消化代谢酶活性有一定影响;以SGR、FCR和PER为评价指标,幼鱼和养成阶段的斜带石斑鱼对饲料中脂肪的需要量均在11%~13%内。
关键词:斜带石斑鱼;脂肪;生长性能;生化指标;消化酶
斜带石斑鱼(Epinephelus coioides)属于鲈形目(Perciformes)科(Serranidae)石斑鱼属(Epi⁃ nephelus),分布于我国东南沿海的热带、亚热带暖水海域[1],具有生长快、肉质鲜美和经济价值高等优点[2],已成为我国广东、海南、福建沿海海水养殖的名贵种类之一。但目前石斑鱼养殖还主要以投喂冰鲜鱼为主,配合饲料普及率低下,其主要原因是石斑鱼营养需要研究基础薄弱。因此,开展斜带石斑鱼营养需要研究进而开发精准的人工配合饲料已成为斜带石斑鱼集约化养殖可持续健康发展的迫切需要。
海水鱼类对蛋白质需要量高,而在资源日益短缺的今天,鱼粉等优质蛋白质原料价格高昂,为节约养殖成本,养殖者希望饲料蛋白质能更有效地转化为鱼体蛋白质,而不是用于能量代谢;鱼类的生理特点决定了其对饲料碳水化合物的利用能力有限,但却能很好地利用脂肪,因此饲料脂肪常作为鱼类重要的能量来源[3]。若饲料中脂肪含量低,水产动物生长缓慢,添加适量的脂肪则可有效促进生长,还能起到节约蛋白质的作用[4-5];同时,脂肪对维持鱼类健康、繁殖和体色,改善饲料的适口性和外观性状,增加饲料的商品价值,提高饲料的利用效率等也具有重要的作用[6-7]。
石斑鱼因体重和种类的不同,对脂肪的需要量差异较大。前人的研究表明,以鱼油或混合油等为脂肪源,初重为4~40 g的石斑鱼幼鱼对饲料中脂肪的需要量在3%~15%[8-14]。
陆生动物生产普遍采用阶段饲养方式,其营养需要研究也是按不同养殖阶段进行的,但水产动物营养研究绝大多数是以幼鱼(虾)为主。研究动物不同生长阶段的营养需求可遵循其生长发育规律更科学精准的配制饲料,提高饲料效率。因此,本试验以初重分别为9.1(幼鱼阶段)和102.6 g(养成阶段,按上市体重的40%计,石斑鱼250 g左右即可上市)的斜带石斑鱼为对象,通过研究不同脂肪水平饲料对斜带石斑鱼生长性能、体成分、生化指标和消化代谢酶活性等的影响,确定幼鱼和养成阶段斜带石斑鱼对饲料中脂肪的需要量,为研制石斑鱼精准高效配合饲料提供基础数据。
1 材料与方法
1.1 试验设计与饲料制作
在基础饲料中分别添加0、3%、6%、9%、12%的鱼油,配制5种不同脂肪水平(7.07%、9.92%、12.92%、15.95%和19.04%)的等氮饲料,分别记为L1、L2、L3、L4和L5组,试验饲料组成及营养水平见表1。所有原料粉碎后过40目筛,按配方比例称取各种原料进行混合,少量组分采用逐级扩大法混合,然后加入鱼油和大豆卵磷脂,将油脂微粒搓散后,放入V型立式混合机中混合均匀,缓慢加入所配饲料重量30%~40%的水后再次混匀,用F-26型双螺杆挤条机(华南理工大学研制)加工成直径为3和4 mm的颗粒饲料,风干至水分含量10%左右,用封口袋分装后于-20℃冰箱保存备用。
1.2 试验鱼及饲养管理
1.2.1 试验鱼的来源及驯化
幼鱼阶段石斑鱼购自海南省文昌市烟墩区某石斑鱼苗场,养成阶段石斑鱼购自湛江雷州市覃斗镇某石斑鱼养殖场。试验鱼运回基地后,投喂商品料(中山统一企业有限公司产品,粗蛋白质含量46%)1周,再投喂L1组饲料1周,使之逐渐适应养殖环境和饲料。
1.2.2 饲养管理
养殖试验在广东海洋大学东海岛海洋生物研究基地室内海水养殖系统中进行。挑选规格一致(幼鱼阶段初重9.1 g,养成阶段初重102.6 g)、体格健壮的斜带石斑鱼随机分配。根据试验设计,共分为6个组,每组3个重复,以重复为单位放养于容积为1 000 L的玻璃钢养殖桶内。幼鱼阶段每桶放养25尾鱼,投喂直径为3 mm的饲料,试验期8周;养成阶段每桶放养20尾鱼,投喂直径为4 mm的饲料,试验期10周。每天08:30和16:30各投喂1次,投喂完1 h后用虹吸法吸取残饵。
试验期间每天观察摄食情况、记录死亡数。每2 d清洗养殖桶1次;试验期间不间断充气,水温28.5~31.5℃,pH 7.5~8.0,盐度26~30,氨氮和亚硝酸盐浓度≤0.5 mg/L,溶氧浓度≥6 mg/L。
1.3 样品采集及分析方法
1.3.1 样品采集
试验结束石斑鱼饥饿24 h后取样。各桶石斑鱼用丁香酚麻醉后称重、计数。每桶随机取5尾鱼测量体重、体长,计算肥满度,然后于-20℃冰箱保存,用于全鱼常规营养成分分析。幼鱼阶段每桶再随机取7尾鱼,养成阶段每桶再随机取5尾鱼,尾静脉采血,血样放入1.5 mL抗凝管中,室温下静置4 h后,4℃下3 500×g离心10 min,收集血浆放入-80℃冰箱保存,用于生化指标测定。将取血后的石斑鱼分离内脏,分别称每尾鱼的内脏团和肝脏重量,计算肝体比和脏体比;然后分离背部肌肉,于-80℃冰箱保存,用于肌肉常规营养成分分析。最后每桶再随机取3尾鱼,分离肝脏、胃、前肠,-80℃冰箱保存,备测代谢酶、免疫酶和消化酶活性。
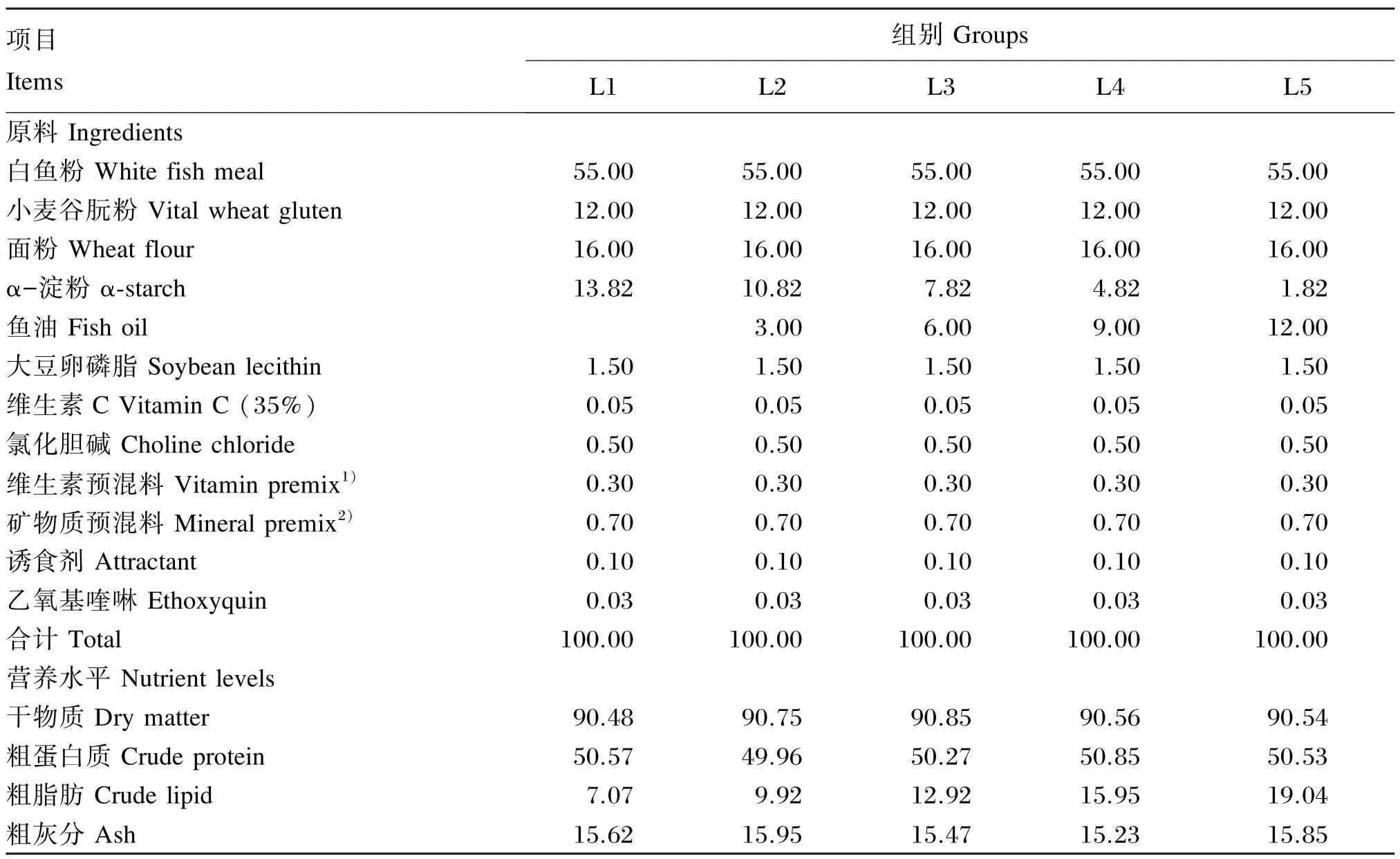
表1 试验饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis) %
1.3.2 分析方法
试验饲料、全鱼、肌肉的常规营养成分测定采用AOAC(1995)[15]方法进行。其中,水分含量的测定采用105℃烘干恒重法;粗蛋白质含量的测定采用凯氏定氮法;粗脂肪含量的测定采用索氏抽提法;粗灰分含量的测定采用箱式电阻炉550℃灼烧法。
血浆生化指标采用全自动生化分析仪(Hita⁃chi 7020型,日本)测定。
代谢酶[肝脂酶(HL)、脂蛋白脂酶(LPL)、苹果酸脱氢酶(MDH)、乳酸脱氢酶(LDH)]、消化酶(胃蛋白酶、脂肪酶、淀粉酶)以及免疫酶中的碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)活性采用南京建成生物工程研究所生产的试剂盒测定,相应操作参照说明书进行;免疫酶中的溶菌酶(LZM)活性测定方法参照Ellis等[16]的方法。
1.4 计算公式
存活率(SR,%)=100×终末尾数/初始尾数;
增重率(WGR,%)=100×[末均重(g)-初均重(g)]/初均重(g);
饲料系数(FCR)=摄食饲料总重(g)/[末总重(g)-初总重(g)];
特定生长率(SGR,%/d)=100×[ln末均重(g)-ln初均重(g)]/饲养天数(d);
蛋白质效率(PER,%)=100×增重(g/尾)/
蛋白质摄入量(g/尾);
肥满度(CF,%)=100×体重(g)体长(cm)3;
肝体比(HSI,%)=100×
肝脏重(g)/体重(g);
脏体比(VSI,%)=100×内脏团重(g)/体重(g)。
1.5 统计分析
数据以平均值±标准差(mean±SD)表示。用SPSS 17.0对所有数据进行单因素方差分析(one⁃way ANOVA),当有显著差异(P<0.05)时,进行Duncan氏法多重比较。
2 结 果
2.1 饲料脂肪水平对斜带石斑鱼生长性能和形态学指标的影响
由表2可知,幼鱼阶段,SR随着饲料脂肪水平的升高先上升后下降,以L3组最高,显著高于L4和L5组(P<0.05);养成阶段,SR不受饲料脂肪水平的影响(P>0.05)。随着饲料脂肪水平的升高,2个阶段斜带石斑鱼的WGR、SGR和PER均呈上升后下降的趋势,其中幼鱼阶段L3组的WGR、SGR显著高于L1、L4和L5组(P<0.05),PER显著高于L1、L2和L5组(P<0.05);养成阶段L3组的WGR、SGR显著高于其他各组(P<0.05),PER显著高于L1、L4和L5组(P<0.05)。2个阶段斜带石斑鱼的FCR变化趋势同PER相反,随着饲料脂肪水平的升高呈先下降后升高的趋势,具体表现为幼鱼阶段L3组显著低于L1、L2 和L5组(P<0.05),养成阶段L3组显著低于L1、L5组(P<0.05)。以SGR为评价指标,通过二次曲线模型拟合得出,幼鱼阶段、养成阶段斜带石斑鱼对饲料中脂肪的需要量分别为11.73%(图1)和12.57%(图2)。分别以FCR和PER为评价指标,则斜带石斑鱼对饲料中脂肪的需要量为:幼鱼阶段,11.84%(YFCR=0.005 7X2+0.135X+2.031,R2=0.842)、12.01%(YPER=0.006 7X2+0.161X+0.771,R2=0.813);养成阶段,11.98%(YFCR=0.003 3X2+0.079X+1.648,R2=0.881)、11.91%(YPER=0.005 7X2+0.136+0.931,R2=0.825)。
随着饲料脂肪水平的升高,2个阶段斜带石斑鱼的CF均逐渐上升,最高值出现在L3组,然后下降,幼鱼阶段表现为L3、L4组显著高于L1、L5组(P<0.05),养成阶段表现为L3组显著高于L1组(P<0.05);2个阶段斜带石斑鱼的HSI逐渐上升,L5组显著高于L1组(P<0.05);2个阶段斜带石斑鱼的VSI呈先上升后下降的趋势,幼鱼阶段最高值出现在L3组,养成阶段最高值出现在L4组。
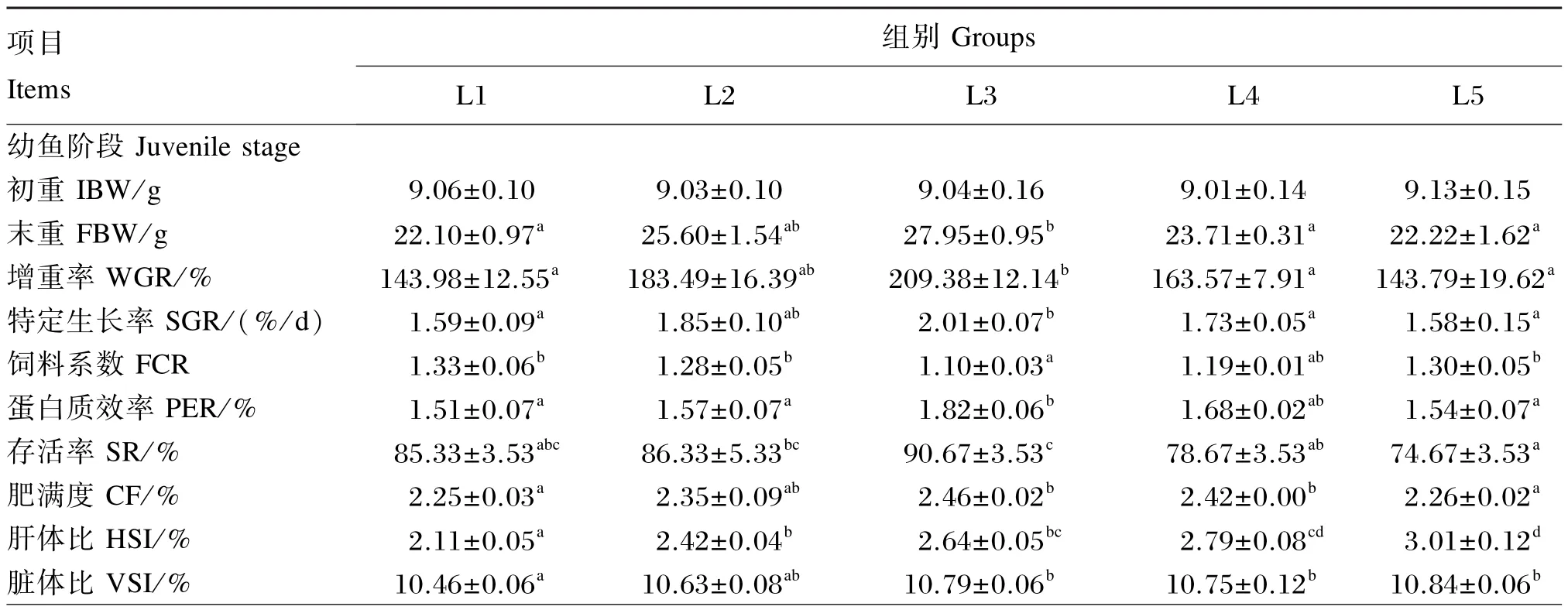
表2 饲料脂肪水平对斜带石斑鱼生长性能和形态学指标的影响Table 2 Effects of dietary lipid level on growth performance and morphological indexes of orange⁃spotted grouper

图1 饲料脂肪水平与幼鱼阶段斜带石斑鱼特定生长率的关系Fig.1 Relationship between dietary lipid level and SGR of orange⁃spotted grouper in juvenile stage

图2 饲料脂肪水平与养成阶段斜带石斑鱼特定生长率的关系Fig.2 Relationship between dietary lipid level and SGR of orange⁃spotted grouper in grow out stage
2.2 饲料脂肪水平对斜带石斑鱼全鱼及肌肉常规营养成分的影响
由表3可知,随着饲料脂肪水平的升高,2个阶段全鱼粗蛋白质含量均逐渐下降,幼鱼阶段表现为L1组显著高于其他各组(P<0.05),L2、L3组显著高于L4、L5组(P<0.05);养成阶段表现为L1组显著高于其他各组(P<0.05),L2、L3、L4组显著高于L5组(P<0.05)。随着饲料脂肪水平的升高,幼鱼阶段全鱼粗脂肪含量逐渐上升,表现为L5组显著高于其他各组(P<0.05),L2、L3、L4组显著高于L1组(P<0.05);养成阶段全鱼粗脂肪含量升高后稳定,表现为L3、L4、L5组显著高于L1、L2组(P<0.05),L2组显著高于L1组(P<0.05)。全鱼粗灰分含量,幼鱼阶段具体表现为L1组显著高于L2、L4、L5组(P<0.05),L3组显著高于L5组(P<0.05);养成阶段具体表现为L1组显著高于L3、L4、L5组(P<0.05)。2个阶段全鱼水分含量均不受饲料脂肪水平的显著影响(P>0.05)。
随着饲料脂肪水平的升高,幼鱼阶段肌肉粗蛋白质含量表现为L1组显著高于L2、L4、L5组(P<0.05),L5组显著高于L2、L3、L4组(P<0.05),L2、L3组显著高于L4组(P<0.05);养成阶段肌肉粗蛋白质含量表现为L5组显著高于L1、L2、L3组(P<0.05)。随着饲料脂肪水平的升高,2个阶段全鱼粗脂肪含量均逐渐上升,幼鱼阶段表现为L5组显著高于L1、L2、L3组(P<0.05),L3、L4组显著高于L1组(P<0.05);养成阶段表现为L5组显著高于L1、L2组(P<0.05)。幼鱼阶段肌肉粗灰分含量随着饲料脂肪水平的升高呈逐渐升高的趋势,L5组显著高于L1、L2组(P<0.05),但与L3、L4组差异不显著(P>0.05);养成阶段肌肉粗灰分含量随着饲料脂肪水平的升高呈逐渐下降的趋势,L1和L2组无显著差异(P>0.05),但均显著高于L4、L5组(P<0.05)。2个阶段肌肉水分含量不受饲料脂肪水平的显著影响(P>0.05)。

表3 饲料脂肪水平对斜带石斑鱼全鱼和肌肉常规营养成分的影响Table 3 Effects of dietary lipid level on common nutritional components in whole body and muscle of orange⁃spotted grouper
2.3 饲料脂肪水平对斜带石斑鱼血浆生化指标的影响
由表4可知,随着饲料脂肪水平的升高,2个阶段血浆总蛋白(TP)含量呈逐渐下降趋势,均表现为L1组显著高于L4、L5组(P<0.05)。幼鱼阶段血浆葡萄糖(GLU)含量表现为L5组显著高于其他4组(P<0.05);养成阶段血浆GLU含量随着饲料脂肪水平的升高先上升后稳定,L4、L5组显著高于L1组(P<0.05)。2个阶段血浆高密度脂蛋白(HDLC)含量随着饲料脂肪水平的升高均呈逐渐升高趋势,幼鱼阶段表现为L1、L2组显著低于L5组(P<0.05);养成阶段表现为L1、L2组显著低于其他3组(P<0.05),L3组显著低于L4、L5组(P<0.05)。2个阶段血浆低密度脂蛋白(LD⁃LC)含量随着饲料脂肪水平的升高均呈逐渐下降趋势,幼鱼阶段表现为L2组显著高于L4、L5组(P<0.05);养成阶段表现为L1组显著高于其他4组(P<0.05),L2、L3和L4组显著高于L5组(P<0.05)。
数学模型拟合分析表明,幼鱼和养成阶段斜带石斑鱼的血浆甘油三酯(TG)和总胆固醇(CHOL)含量与饲料脂肪水平呈线性或曲线关系(幼鱼阶段:YTG=0.065X+1.230,R2=0.850,YCHOL=0.046X+2.372,R2=0.801;养成阶段:YTG=0.025X2-0.470X+4.521,R2=0.990,YCHOL=0.132X+2.086,R2=0.916)。

表4 饲料脂肪水平对斜带石斑鱼血浆生化指标的影响Table 4 Effects of dietary lipid level on plasma biochemical indices of orange⁃spotted grouper
2.4 饲料脂肪水平对斜带石斑鱼肝脏代谢酶活性的影响
由表5可知,随着饲料脂肪水平的升高,2个阶段肝脏HL、LPL和MDH活性均逐渐下降,而肝脏LDH活性则逐渐上升。其中,幼鱼阶段肝脏HL活性表现为L1、L2组显著高于其他3组(P<0.05);养成阶段肝脏HL活性表现为L1、L2、L3组显著高于L4、L5组(P<0.05)。幼鱼阶段肝脏LPL活性表现为L1、L2组显著高于其他3组(P< 0.05);养成阶段肝脏LPL活性表现为L1组显著高于L3、L4、L5组(P<0.05)。幼鱼阶段L1组肝脏MDH活性显著高于L4、L5组(P<0.05);养成阶段L1组肝脏MDH活性显著高于其他4组(P<0.05),L2组显著高于L3、L4、L5组(P<0.05)。幼鱼阶段前4组肝脏LDH活性无显著差异(P>0.05),但显著低于L5组(P<0.05);养成阶段L1、L2组肝脏LDH活性与L3组无显著差异(P>0.05),但显著低于L4、L5组(P<0.05)。
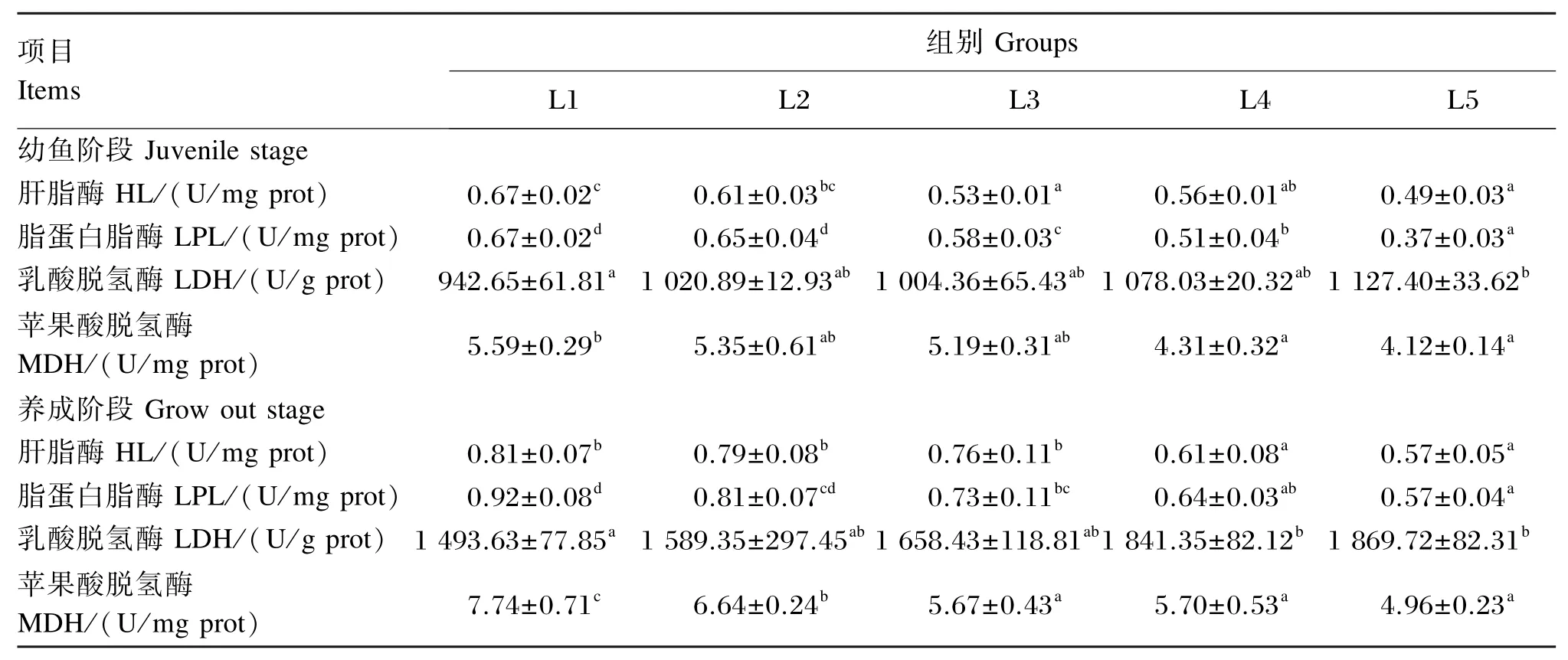
表5 饲料脂肪水平对斜带石斑鱼肝脏代谢酶活性的影响Table 5 Effects of dietary lipid level on metabolism enzyme activities in liver of orange⁃spotted grouper
2.5 饲料脂肪水平对斜带石斑鱼肝脏免疫酶活性的影响
由表6可知,幼鱼阶段肝脏ACP活性各组之间均无显著差异(P>0.05);养成阶段肝脏ACP活性随着饲料脂肪水平的升高逐渐下降,L1组显著高于L3、L4、L5组(P<0.05),L2、L3组显著高于L5组(P<0.05)。幼鱼阶段肝脏SOD活性表现为L1、L2组显著低于其他3组(P<0.05);养成阶段肝脏SOD活性表现为L1组显著低于L3、L4、L5组(P<0.05)。
数学模型拟合表明,幼鱼和养成阶段斜带石斑鱼肝脏AKP活性与饲料脂肪水平呈正相关关系(幼鱼阶段:YAKP=0.702X+5.364,R2=0.893;养成阶段:YAKP=0.183X+9.196,R2=0.882);幼鱼和养成阶段斜带石斑鱼肝脏LZM活性同样与饲料脂肪水平呈正相关关系(幼鱼阶段:YLZM=4.279X+83.453,R2=0.849;养成阶段:YLZM=5.497X+115.144,R2=0.837)。以肝脏SOD活性为评价指标,幼鱼和养成阶段斜带石斑鱼对饲料中脂肪的需要量分别为16.57%(幼鱼阶段:YSOD=0.101X2+3.346X+41.774,R2=0.975)、14.74%(养成阶段:YSOD=0.290X2+8.535X+17.012,R2=0.879)。
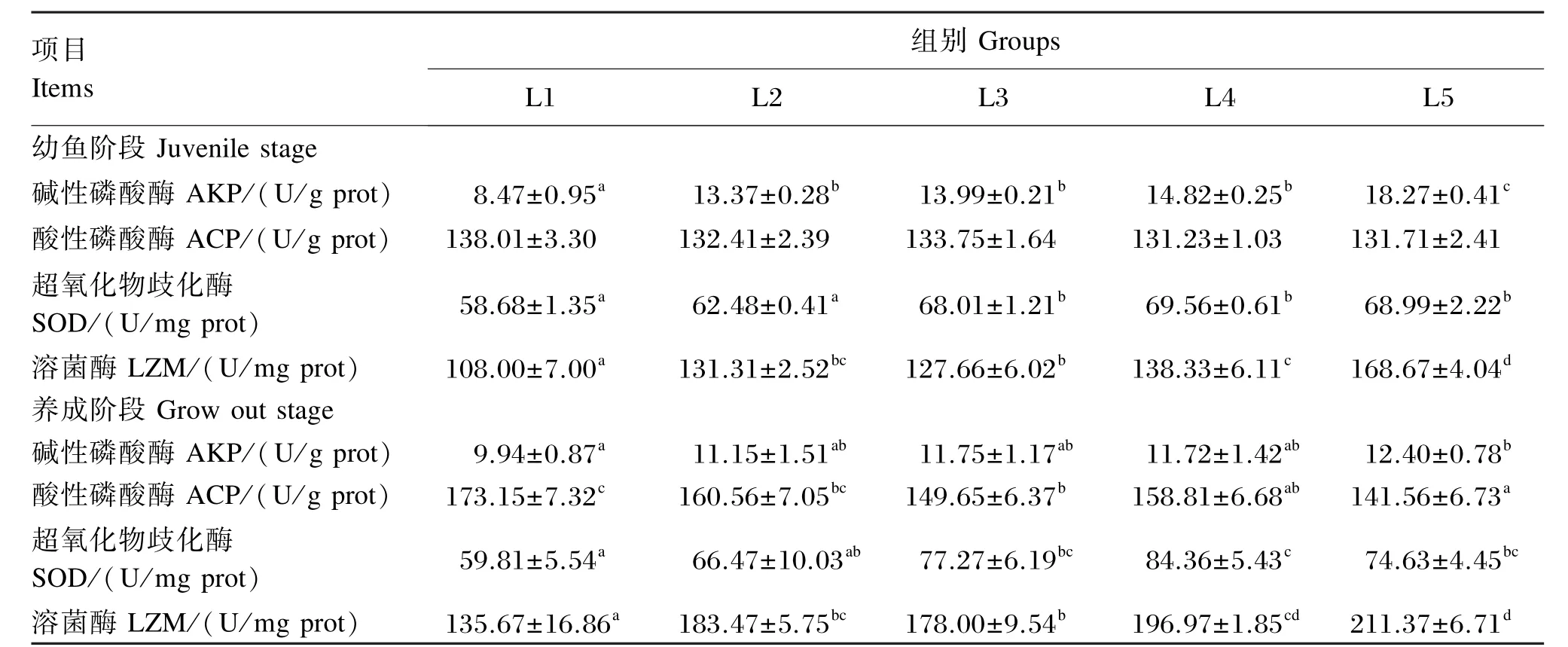
表6 饲料脂肪水平对斜带石斑鱼肝脏免疫酶活性的影响Table 6 Effects of dietary lipid level on immune enzyme activities in liver of orange⁃spotted grouper
2.6 饲料脂肪水平对斜带石斑鱼胃肠道消化酶活性的影响
由表7可知,随着饲料脂肪水平的升高,2个阶段斜带石斑鱼的胃肠道胃蛋白酶和淀粉酶活性逐渐下降,胃肠道脂肪酶活性逐渐上升。其中,幼鱼阶段L3、L4组胃蛋白酶活性显著低于L1、L2组(P<0.05),显著高于L5组(P<0.05);养成阶段L2、L3组胃蛋白酶活性显著低于L1组(P<0.05),显著高于L4、L5组(P<0.05)。幼鱼阶段L1组淀粉酶活性显著高于L4、L5组(P<0.05);养成阶段L1、L2组淀粉酶活性显著高于L3、L4、L5组(P<0.05),L1组还显著高于L2组(P<0.05)。幼鱼阶段脂肪酶活性表现为L3、L4组显著高于L1、L2组(P<0.05),显著低于L5组(P<0.05);养成阶段脂肪酶活性表现为L1、L2、L3组显著低于L4、L5组(P<0.05),L3组显著高于L1组(P<0.05),L5组显著高于L4组(P<0.05)。
3 讨 论
红姑鱼(Sciaenops ocellatus)幼鱼和吉富罗非鱼(Oreochromis niloticus)幼鱼SR随着饲料脂肪水平的升高而下降,作者认为饲料脂肪水平过高导致的肝功能损害是引起死亡的直接原因[17-18]。这与本试验中幼鱼阶段斜带石斑鱼得出的结果一致。有研究表明,饲料脂肪水平对1龄团头鲂(Megalobrama amblycephala)(初重50.37 g)的SR无显著影响[19],与本试验养成阶段斜带石斑鱼得出的结果类似,与上述幼鱼结果不同的原因可能是随着鱼体重量的增加,对脂肪的需要量增加,需要量与饲料中较高的脂肪水平接近,或大体重的鱼对脂肪的耐受力增强,因此饲料脂肪水平对SR的影响不显著。
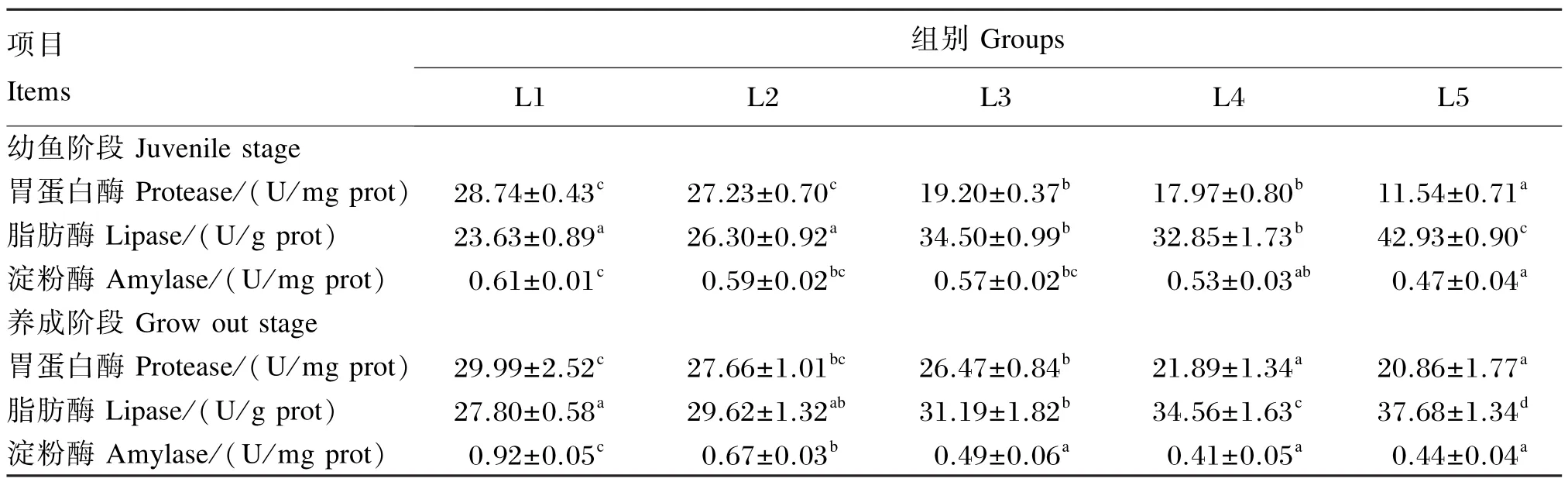
表7 饲料脂肪水平对斜带石斑鱼胃肠道消化酶活性的影响Table 7 Effects of dietary lipid level on gastrointestinal digestive enzyme activities of orange⁃spotted grouper
饲料蛋白质水平相同时,在鱼类饲料中适量添加脂肪可有更好的生长表现,这一现象称为“蛋白质节约效应”[20]。在本试验中,L2、L3组的WGR、SGR和PER均高于L1组,进一步证明了这一点。斑点叉尾(Ictalurus punctatus)[21]、虹鳟(Oncorhynchus mykiss)[22]、白姑鱼(Argyrosomus regius)[23]、石首鱼(Atractoscion nobilis)[24]和黑鲷(Hephaestus fuliginosu)[25]也获得了相同的试验结果。本试验中,随着饲料脂肪水平的升高,L4、L5组的生长性能开始下降,说明饲料中添加超过需要量的脂肪可导致鱼类生长性能的下降,在草鱼(Ctenopharyngodon idella)[4]、许氏平(Sebastes schlegeli)[26]、齿鲷(Dentex dentex)[27]、异育银鲫(Carassius auratus gibelio)和长尾(Leiocassis longirostris gunther)[28]的试验中也有相同的结果。本试验中,随着饲料脂肪水平的升高,PER呈先上升后降低的趋势,与牙鲆(Paralichthys oliva⁃ceus)[20]、白姑鱼[23]和红鳍东方鲀(Takifugu ru⁃bripes)[29]的研究结果一致,可能是适当提高饲料脂肪水平可增加饲料中可利用的能量,使蛋白质分解供能部分降低,进而提高了蛋白质的沉积率。但也有研究表明PER与饲料脂肪水平呈一定的正相关[30-31],出现该结果的原因可能是试验中选取的脂肪水平不高,未超过试验对象的脂肪需要量有关。以SGR、FCR和PER为评价指标,2个阶段斜带石斑鱼对饲料中脂肪的需要量均在11%~13%内,所得到的结果接近,说明这3个指标均可作为斜带石斑鱼脂肪需要量的判据;此外,从本试验看,幼鱼阶段斜带石斑鱼与养成阶段斜带石斑鱼对饲料中脂肪的需要量接近。如果再进行斜带石斑鱼不同养殖阶段营养需要研究时,可将养成阶段的体重提高,以进一步观察不同生长阶段营养需要参数的变化规律,以便更好的指导生产实践。
鱼类形态学指标与饲料脂肪水平密切相关。研究表明,团头鲂HSI随饲料脂肪水平的升高而显著升高[19];黑线鳕(Melanogrammus aeglefi⁃nus)[32]和异育银鲫[33]的VSI与饲料脂肪水平呈正相关;尖吻鲈(Lates calcarzfer)的HSI和VSI随饲料脂肪水平的升高而升高[34]。此外,在宝石鲈(Scortum barcoo)[3]、梭鱼(Chelon haematochei⁃lus)[30]、军曹鱼(Rachycentron canadum)[35]、蓝鳍金枪鱼(Thunnus orientalis)[36]、厚唇弱棘(Hep⁃ haestus fuliginosus)[37]的研究中也有类似结果。在本试验中,斜带石斑鱼的HSI和VSI与饲料脂肪水平呈正相关,与上述研究的结果基本一致。出现该结果的原因可能是鱼类缺乏皮下脂肪层,主要的脂肪蓄积部位是腹腔肠系膜和肝脏[38],因此,当饲料脂肪水平升高时,这2个组织中沉积大量的脂肪而导致HSI和VSI的上升。部分研究表明鱼类的CF随着饲料脂肪水平的升高呈先上升后下降的趋势[3,39-40],在本研究中2个阶段斜带石斑鱼的CF变化趋势与上述结果类似。然而,团头鲂[41]、(Elopichthys bambusa)[42]、黑鲷[43]和锦鲤(Cyprinus caypio)[44]的试验结果则表明CF不受饲料脂肪水平的影响。CF受鱼类体重和体长共同影响,脂肪可促进鱼类的生长,但是其体重和体长的增长速度不同;此外,鱼种不同,其蓄积脂肪能力的不同也是CF结果不同的重要影响因素[38]。
随着饲料脂肪水平的升高,斜带石斑鱼全鱼和肌肉粗脂肪含量逐渐上升。在长吻幼鱼的研究中,其全鱼粗脂肪含量随着饲料脂肪水平的升高而增加[45],这与本试验结果一致。异育银鲫全鱼粗脂肪含量与饲料脂肪水平呈正相关,水分含量则呈相反的趋势[33]。团头鲂[19]、军曹鱼[35]、黑线鳕[32]、尖吻鲈[34]、奥尼罗非鱼[39]、杂交条纹鲈(Morone chrysops×M.saxatilis)[46]的试验结果也表明鱼体脂肪含量与饲料脂肪水平呈正相关;本试验中饲料脂肪水平升高降低了鱼体和肌肉中蛋白质的比例,这与军曹鱼[35]、春鲤(Cyprinus longi⁃pectoralis)[47]和篮子鱼(Siganus rivulatus)[48]的研究结果类似;而石首鱼[24]、许氏平
[26]和大菱鲆(Psetta maxima)[49]的研究结果则表明没有显著影响。Shearer等[50]研究认为鱼类的体成分受内源因素(规格、性别等)和外源因素(饲料、环境等)的共同影响,鱼体粗蛋白质和粗灰分含量与鱼类的生长阶段(内源因素)有关,而鱼体粗脂肪含量主要受外源因素的影响。
准确掌握鱼类的血液生化指标的变化规律有利于了解鱼类健康状况及对饲料营养水平和营养价值进行评估[51]。镜鲤(Cyprinus specularis)血清TP、TG、CHOL和GLU含量随着饲料脂肪水平的升高而升高[52],与本试验结果一致;相似的研究还有吉富罗非鱼[53]、大西洋鳕(Gadus morhua)[54]和胭脂鱼(Myxocyprinus asiaticus)[55]。鱼类血浆脂蛋白在肝脏脂肪转运中发挥着重要作用。脂蛋白与肝脏脂肪结合后随血液运出肝脏,从而使肝脏和血液中脂肪代谢维持平衡状态[56]。在本试验中,随着饲料脂肪水平的升高,血浆HDLC含量逐渐升高,LDLC含量逐渐下降;与奥尼罗非鱼[39]研究结果相同,与厚唇弱棘
HL和LPL是鱼类肝脏中参与脂肪降解的2种关键酶,HL作为配体促进LDLC和乳糜微粒残粒进入肝细胞,并直接参与HDLC逆转运和HDLC残粒的分解[58]。LPL能够水解富含TG的脂蛋白,产生游离脂肪酸[59]。本试验中斜带石斑鱼肝脏HL和LPL活性随着饲料脂肪水平升高而下降,说明饲料中脂肪水平过高使得鱼体脂肪分解代谢减弱。肝脏MDH活性的高低影响体内脂肪的合成[60]。在本试验中,肝脏MDH活性逐渐下降,这与胭脂鱼[55]和塞内加尔鳎(Solea senega⁃lensis)[61]的研究结果一致,说明饲料脂肪水平的升高在一定程度上抑制了斜带石斑鱼体内脂肪的合成代谢。
脂肪所提供的必需脂肪酸对于维持机体免疫力有重要作用。对点带石斑鱼的研究结果表明,血浆LZM活性同饲料脂肪水平的升高呈正相关[9];奥尼罗非鱼[39]和吉富罗非鱼[53]血液中AKP活性均与饲料脂肪水平呈正相关;梭鱼肝脏SOD活性随着饲料脂肪水平的升高呈先上升后下降的趋势[62];镜鲤肝脏SOD和LZM活性随饲料脂肪水平的升高先升高后降低[63]。上述研究结果均与本试验结果类似。以肝脏SOD活性为判据时,幼鱼和养成阶段斜带石斑鱼对饲料中脂肪的需要量分别为16.57%和14.74%,结合生长性能指标表明,当饲料脂肪水平满足斜带石斑鱼最佳生长时,其免疫力并不是最高,满足最佳免疫力的饲料脂肪含量高于其生长对脂肪的需要。
鱼类(特别是无胃鱼类)消化酶活性的高低可以反映其对饲料的消化能力。饲料成分对鱼类消化酶活性的影响具有复杂性和效应的多样性[64]。饲料脂肪水平对消化酶活性影响的研究结果[65-67]差异较大。消化酶为底物诱导酶,在本试验中,随着饲料脂肪水平的升高,2个阶段斜带石斑鱼肠道脂肪酶活性均逐渐上升,进一步证明了这一结论。对厚唇弱棘
[40]和方斑东风螺(Babylonia areo⁃ late)[66]的研究也得到了类似的结果。随着饲料脂肪水平的升高,胭脂鱼肠道蛋白酶活性逐渐降低,淀粉酶活性先降低后稳定[55],与本试验结果类似,可能是当饲料脂肪水平升高后,诱导了脂肪酶的分泌而影响了蛋白酶的分泌,饲料中碳水化合物水平逐渐降低,淀粉酶活性也随底物的减少而降低。
4 结 论
在本试验条件下,饲料中适宜水平的脂肪可以改善幼鱼和养成阶段斜带石斑鱼的生长性能,且对体成分、生化指标和消化代谢酶活性有一定影响;以SGR、FCR和PER为评价指标,幼鱼和养成阶段的斜带石斑鱼对饲料中脂肪的需要量均在11%~13%内。
参考文献:
[1] 艾春香,李少菁,王贵忠,等.石斑鱼的营养需求及其饲料的研制[J].海洋水产研究,2004,25(6):86-92.
[2] MIAO S,TANG H C.Bioeconomic analysis of impro⁃ving management productivity regarding grouper Epi⁃nephelus malabaricus farming in Taiwan[J].Aquacul⁃ture,2002,211(1/2/3/4):151-169.
[3] 宋理平.宝石鲈营养需求的研究[D].博士学位论文.济南:山东师范大学,2009:72-78.
[4] DU Z Y,LIU Y J,TIAN L X,et al.Effect of dietary lipid level on growth,feed utilization and body compo⁃sition by juvenile grass carp(Ctenopharyngodon idel⁃la)[J].Aquaculture Nutrition,2005,11(2):139-146.
[5] NG W K,ABDULLAH N,DE SILVA S S.The dieta⁃ry protein requirement of the Malaysian mahseer,Tor tambroides(Bleeker),and the lack of protein-sparing action by dietary lipid[J].Aquaculture,2008,284(1/2/3/4):201-206.
[6] DIAS J,ALVAREZ M J,DIEZ A,et a1.Regulation of hepatic lipogenesis by dietary protein/energy in juven⁃ile European seabass(Dicentrarchus labrax)[J].Aq⁃uaculture,1998,161(1/2/3/4):169-186.
[7] TORRISSEN O J,HARDY R W,SHEARER K D,et al.Effects of dietary canthaxanthin level and lipid level on apparent digestibility coefficients for canthaxanthin in rainbow trout(Oncorhynchus mykiss)[J].Aqua⁃culture,1990,88(3/4):351-362.
[8] LUO Z,LIU Y J,MAI K S,et al.Effect of dietary lip⁃id level on growth performance,feed utilization and body composition of grouper Epinephelus coioides ju⁃veniles fed isonitrogenous diets in floating netcages [J].Aquaculture International,2005,13(3):257-269.
[9] LIN Y H,SHIAU S Y.Dietary lipid requirement of grouper,Epinephelus malabaricus,and effects on im⁃mune responses[J].Aquaculture,2003,225(1/2/3/4):243-250.
[10] 王庆奎,陈成勋,邢克智,等.饵料中蛋白质、糖类、脂类对点带石斑鱼生长的影响[J].饲料工业,2010,31(14):7-9.
[11] TUAN L A,WILLIAMS K C.Optimum dietary pro⁃ tein and lipid specifications for juvenile malabar grouper(Epinephelus malabaricus)[J].Aquaculture,2007,267(1/2/3/4):129-138.
[12] 马平.添加油脂影响石斑鱼幼鱼内脏脂肪蓄积的试验[J].台湾海峡,1996,15(增刊):55-58.
[13] YOSHII K,TAKAKUWA F,NGUYEN H P,et al.Effect of dietary lipid level on growth performance and feed utilization of juvenile kelp grouper Epinephelus bruneus[J].Fisheries Science,2010,76(1):139-145.
[14] 周立红,胡家才,陈学豪.青石斑鱼人工配合饵料中脂肪适宜含量的研究[J].厦门水产学院学报,1995,17(2):13-17.
[15] HORWITZ W.Official methods of analysis of AOAC International[M].16th ed.Gaithersburg:AOAC Inter⁃national,1995.
[16] ELLIS A E.Lysozyme assays[M]//STOLEN J S,FLETCHER T C,ANDERSON D P,et al.Techniques in fish immunology.Fair Haven,NJ:SOS Publica⁃tions,1990:101-103.
[17] 冯健,贾刚.饵料中不同脂肪水平诱导红姑鱼脂肪肝病的研究[J].水生生物学报,2005,29(1):61-64.
[18] 韩光明,王爱民,徐跑,等.饲料中脂肪水平对吉富罗非鱼幼鱼成活率、肌肉成分及消化酶活性的影响[J].上海海洋大学学报,2010,19(4):469-474.
[19] 蒋阳阳,李向飞,刘文斌,等.不同蛋白质和脂肪水平对1龄团头鲂生长性能和体组成的影响[J].水生生物学报,2012,36(5):826-836.
[20] YIGIT M,KOSHIO S,TESHIMA S,et al.Dietary protein and energy requirements of juvenile Japanese flounder,Paralichthys olivaceus[J].Journal of Ap⁃plied Sciences,2004,4(3):486-492.
[21] PAGE J W,ANDREWS J W.Interactions of dietary levels of protein and energy on channel catfish(Icta⁃lurus punctatus)[J].The Journal of Nutrition,1973,103(9):1339-1346.
[22] LEE D J,PUTNAM G B.The response of rainbow trout of varying protein⁃energy ratios in a test diet[J].The Journal of Nutrition,1973,103(6):916-922.
[23] CHATZIFOTIS S,PANAGIOTIDOU M,PAPAIO⁃ANNOU N,et al.Effect of dietary lipid levels on growth,feed utilization,body composition and serum metabolites of meagre(Argyrosomus regius)juven⁃iles[J].Aquaculture,2010,307(1/2):65-70.
[24] LÔPEZ L M,DURAZO E,VIANA M T,et al.Effect of dietary lipid levels on performance,body composi⁃tion and fatty acid profile of juvenile white seabass,Atractoscion nobilis[J].Aquaculture,2009,289(1/2):101-105.
[25] 宋理平,韩勃,王爱英,等.脂肪水平对淡水黑鲷生长及体成分的影响[J].长江大学学报:自然科学版,2010,7(1):27-31.
[26] LEE S M,JEON I G,LEE J Y.Effects of digestible protein and lipid levels in practical diets on growth,protein utilization and body composition of juvenile rockfish(Sebastes schlegeli)[J].Aquaculture,2002,211(1/2/3/4):227-239.
[27] ESPINÔS F J,TOMÁS A,PÉREZ L M,et al.Growth of dentex fingerlings(Dentex dentex)fed diets con⁃taining different levels of protein and lipid[J].Aqua⁃culture,2003,218(1/2/3/4):479-490.
[28] PEI Z,XIE S,LEI W,et al.Comparative study on the effect of dietary lipid level on growth and feed utiliza⁃tion for gibel carp(Carassius auratus gibelio)and Chinese longsnout catfish(Leiocassis longirostris Günther)[J].Aquaculture Nutrition,2004,10(4):209-216.
[29] KIKUCHI K,FURUTA T,IWATA N,et al.Effect of dietary lipid levels on the growth,feed utilization,body composition and blood characteristics of tiger puffer Takifugu rubripes[J].Aquaculture,2009,298 (1/2):111-117.
[30] 张春暖,王爱民,刘文斌,等.饲料脂肪水平对梭鱼生长、营养物质消化及体组成的影响[J].江苏农业学报,2012,28(5):1088-1095.
[31] 张文兵,谢小军,付世建,等.南方鲇的营养学研究:饲料的最适蛋白质含量[J].水生生物学报,2000,24(6):603-609.
[32] NANTON D,LALL S P,KIM J D,et al.Effect of di⁃etary lipid on growth and biochemical composition of juvenile haddock,Melanogrammus aeglefinus[J].Pro⁃ceeding of World Aquaculture,2001,195(3/4):311-319.
[33] 何吉祥,崔凯,徐晓英,等.异育银鲫幼鱼对蛋白质、脂肪及碳水化合物需求量的研究[J].安徽农业大学学报,2014,41(1):30-37.
[34] CATACUTAN M R,COLOSO R M.Growth of juven⁃ile Asian seabass,Lates calcarifer,fed varying carbo⁃hydrate and lipid levels[J].Aquaculture,1997,149 (1/2):137-144.
[35] WANG J T,LIU Y J,TIAN L X,et al.Effect of dieta⁃ry lipid level on growth performance,lipid deposition,hepatic lipogenesis in juvenile cobia(Rachycentron canadum)[J].Aquaculture,2005,249(1/2/3/4):439-447.
[36] BISWAS B K,JI S C,BISWAS A K,et al.Dietary protein and lipid requirements for the Pacific bluefin tuna Thunnus orientalis juvenile[J].Aquaculture,2009,288(1/2):114-119.
[37] 宋理平,韩勃,冒树泉,等.脂肪水平对厚唇弱棘鯻生长及肠道脂肪酶活性的影响[J].广东海洋大学学报,2010,30(1):13-17.
[38] 方玲,梁旭方,李贵生.鱼类肥胖基因及脂肪蓄积调控机理研究[J].水利渔业,2004,24(4):15-16.
[39] 甘晖,李坚明,冯广朋,等.饲料脂肪水平对奥尼罗非鱼幼鱼生长和血浆生化指标的影响[J].上海海洋大学学报,2009,18(1):35-41.
[40] 段彪,向枭,周兴华,等.齐口裂腹鱼饲料中适宜脂肪需要量的研究[J].动物营养学报,2007,19(3):232-236.
[41] 胡显琼.团头鲂鱼种阶段脂肪(能量)蛋白比和脂肪需要量的研究[D].硕士学位论文.苏州:苏州大学,2012:12-35.
[42] 赵巧娥,朱邦科,沈凡,等.饲料脂肪水平对鳡幼鱼生长、体成分及血清生化指标的影响[J].华中农业大学学报,2012,31(3):357-363.
[43] 韩勃.淡水黑鲷对脂肪和碳水化合物需求量的研究[D].硕士学位论文.上海:上海海洋大学,2010.
[44] 梁拥军,孙砚胜,苏建通,等.饲料脂肪水平对锦鲤幼鱼生长和血液生化指标的影响[J].淡水渔业,2012,42(5):49-53.
[45] 陈斌,彭淇,梁文,等.长吻鮠幼鱼日粮中常量营养物质适宜需求量的研究[J].大连海洋大学学报,2013,28(2):179-184.
[46] GAYLORD T G,GATLINⅢD M.Dietary lipid level but not L⁃carnitine affects growth performance of hy⁃brid striped bass(Morone chrysops♀×M.saxatilis)[J].Aquaculture,2000,190(3/4):237-246.
[47] 涂永芹,韩冬,朱晓鸣,等.饲料中不同蛋白、脂肪水平对春鲤生长、饲料利用和体成分的影响[J].水生生物学报,2012,36(5):843-850.
[48] GHANAWI J,ROY L,DAVIS D A,et al.Effects of dietary lipid levels on growth performance of marbled spinefoot rabbitfish Siganus rivulatus[J].Aquacul⁃ture,2011,310(3/4):395-400.
[49] REGOST C,ARZEL J,CARDINAL M,et al.Dietary lipid level,hepatic lipogenesis and flesh quality in tur⁃bot(Psetta maxima)[J].Aquaculture,2001,193(3/4):291-309.
[50] SHEARER K D.Factors affecting the proximate com⁃position of cultured fishes with emphasis on salmonids[J].Aquaculture,1994,119(1):63-88.
[51] BOND C E.Circulation,respiration,and the gas blad⁃der[M]//BOND C E.Biology of fishes.London:W.B.Saunders Company Press,1979:347-374.
[52] 徐奇友,许治冲,王常安,等.不同温度下饲料脂肪水平对松浦镜鲤幼鱼肝脏游离脂肪酸、血清生化及肝脏组织结构的影响[J].东北农业大学学报,2012,43(9):118-126.
[53] 王爱民,韩光明,封功能,等.饲料脂肪水平对吉富罗非鱼生产性能、营养物质消化及血液生化指标的影响[J].水生生物学报,2011,35(1):80-87.
[54] KJÆR M A,VEGUSDAL A,BERGE G M,et al.Characterisation of lipid transport in Atlantic cod(Ga⁃dus morhua)when fasted and fed high or low fat diets [J].Aquaculture,2009,288(3/4):325-336.
[55] 王朝明,罗莉,张桂众,等.饲料脂肪水平对胭脂鱼生长性能、肠道消化酶活性和脂肪代谢的影响[J].动物营养学报,2010,22(4):969-976.
[56] DEPLANO M,CONNES R,DIAZ J P,et al.Intestinal steatosis in the farm⁃reared sea bass Dicentrarchus la⁃brax[J].Diseases of Aquatic Organisms,1989,6(2):121-130.
[57] 王爱英,韩勃,宋理平,等.不同脂肪水平对厚唇弱棘鯻血液生化指标的影响[J].浙江海洋学院学报:自然科学版,2010,29(3):222-226.
[58] CHOI S Y,GOLDBERG I J,CURTISS L K,et al.In⁃teraction between ApoB and hepatic lipase mediates the uptake of ApoB⁃containing lipoproteins[J].The Journal of Biological Chemistry,1998,273(32):20456-20462.
[59] AUWERX J,LEROY P,SCHOONJANS K.Lipopro⁃tein lipase:recent contributions from molecular biolo⁃gy[J].Critical Reviews in Clinical Laboratory Sci⁃ences,1992,29(3/4):243-268.
[60] SCOTT R A,CORNELIUS S G,MERSMANN H J.Effects of age on lipogenesis and lipolysis in lean and obese swine[J].Journal of Animal Science,1981,52 (3):505-511.
[61] DIAS J,RUEDA⁃JASSO R,PANSERAT S,et al.Effect of dietary carbohydrate⁃to⁃lipid ratios on growth,lipid deposition and metabolic hepatic en⁃zymes in juvenile Senegalese sole(Solea senegalen⁃sis,Kaup)[J].Aquaculture Research,2004,35(12):1122-1130.
[62] 张春暖,王爱民,刘文斌,等.饲料脂肪水平对梭鱼脂肪沉积、脂肪代谢酶及抗氧化酶活性的影响[J].中国水产科学,2013,20(1):108-115.
[63] 许治冲,刘晖,徐奇友,等.温度和饲料脂肪水平对松浦镜鲤免疫及抗氧化能力的影响[J].大连海洋大学学报,2012,27(5):429-435.
[64] 黎军胜,李建林,吴婷婷.饲料成分与环境温度对奥尼罗非鱼消化酶活性的影响[J].中国水产科学,2004,11(6):585-588.
[65] 王吉桥,耿加振,姜玉声,等.饲料中脂肪含量对七彩神仙鱼幼鱼生长和消化的影响[J].水产学杂志,2009,22(1):24-30.
[66] ZHOU Q C,ZHOU J B,CHI S Y,et al.Effect of diet⁃ary lipid level on growth performance,feed utilization and digestive enzyme of juvenile ivory shell,Babyloni⁃a areolate[J].Aquaculture,2007,272(1/2/3/4):535-540.
(编辑 菅景颖)
[67] MORAIS S,CABALLERO M J,CONCEIÇÃO L E,et al.Dietary neutral lipid level and source in Senegal⁃ese sole(Solea senegalensis)larvae:effect on growth,lipid metabolism and digestive capacity[J].Comparative Biochemistry and Physiology⁃Part B:Bi⁃ochemistry and Molecular Biology,2006,144(1):57-69.
Dietary Lipid Requirements of Orange⁃Spotted Grouper(Epinephelus coioides)in Juvenile and Grow Out Stages
DONG Xiaohui YANG Junjiang TAN Beiping∗YANG Qihui CHI Shuyan LIU Hongyu
(Laboratory of Aquatic Animal Nutrition and Feed,Fisheries College,Guangdong Ocean University,Zhanjiang 524025,China)
∗Corresponding author,professor,E⁃mail:bptan@126.com
Abstract:The present study was performed to investigate the dietary lipid requirements of grouper in two growth stages(juvenile and grow out stages).Five isonitrogenous diets were formulated with five lipid levels (7.07%,9.92%,12.92%,15.95%and 19.04%),which were regulated by fish oil.Fish with the body weight of 9.1 g(juvenile stage)were fed the 5 diets for 8 weeks,and fish with the body weight of 102.6 g (grow out stage)were fed the 5 diets for 10 weeks.In the same growth stage,each diet had 3 replicates,and each replicate in juvenile and grow out stages had 25 and 20 fish,respectively.The results showed as follows:1)with the dietary lipid level increasing,the weight gain rate(WGR),specific growth rate(SGR),protein efficiency rate(PER),condition factor(CF)and viscerasomatic index(VSI)of fish in juvenile and grow out stages were firstly increased and then decreased,while the feed conversion ratio(FCR)showed an opposite trend,and all of them obtained the extreme when dietary lipid level was 12.92%.2)With the dietary lipid lev⁃el increasing,the content of crude protein in whole body of fish in juvenile and grow out stages was gradually decreased,the content of crude lipid in whole body and muscle was gradually increased,and the content of moisture in whole body and muscle had no significant difference(P>0.05),while the other indices in whole body and muscle had no regular changes.3)With the dietary lipid level increasing,the contents of plasma total protein(TP)and low density lipoprotein(LDLC)of fish in juvenile and grow out stages were gradually de⁃creased,while the content of plasma high density lipoprotein(HDLC)was gradually increased.The contents of plasma triglyceride(TG)and total cholesterol(CHOL)of fish in juvenile and grow out stages had linear or curvilinear relationships with dietary lipid level,repectively.4)With the dietary lipid level increasing,the ac⁃tivities of liver hepaticlipase(HL),lipoprotein lipase(LPL)and malic dehydrogenase(MDH)of fish in ju⁃venile and grow out stages were gradually decreased,while the content of lactate dehydrogenase(LDH)was gradually increased.5)With the dietary lipid level increasing,the activity of liver acid phosphatase(ACP)of fish in juvenile stage had no significant change(P>0.05),while the activity of liver ACP of fish in grow out stage was gradually decreased,and the activity of liver superoxide dismutase(SOD)of fish in juvenile and grow out stages was firstly increased and then decreased.The activities of liver alkaline phosphatase(AKP)and lysozyme(LZM)of fish in juvenile and grow out stages exhibited positive correlations with dietary lipid level,respectively.6)With the dietary lipid level increasing,the activities of gastrointestinal pepsin and amyl⁃ase of fish in juvenile and grow out stages were gradually decreased,while the activity of gastrointestinal lipase was gradually increased.In conclusion,suitable dietary lipid level can improve the growth performance and af⁃fect the body composition,biochemical indices and digestive and metabolism enzyme activities of orange⁃spot⁃ted grouper in juvenile and grow out stages.Using SGR,FCR and PER as evaluation indices,the dietary lipid requirements of orange⁃spotted grouper in juvenile and grow out stages are all in the range of 11%to 13%.[Chinese Journal of Animal Nutrition,2015,27(1):133⁃146]
Key words:orange⁃spotted grouper(Epinephelus coioides);lipid;growth performance;biochemical indices;digestive enzyme
通信作者:∗谭北平,教授,博士生导师,E⁃mail:bptan@126.com
作者简介:董晓慧(1970—),女,黑龙江穆棱人,教授,博士,研究方向为水产动物营养与饲料。E⁃mail:dongxiaohui2003@163.com
基金项目:公益性行业(农业)科研专项(201003020);国家重点基础研究发展计划(2014CB138600);广东省珠江学者资助项目(2011)
收稿日期:2014-07-21
doi:10.3969/j.issn.1006⁃267x.2015.01.017
文章编号:1006⁃267X(2015)01⁃0133⁃14
文献标识码:A
中图分类号:S963
