含水量对黄精种子贮藏生理的影响
2016-01-15李吟平程秋香席鹏洲王宏迪张跃进张小燕
李吟平, 程秋香, 席鹏洲, 王宏迪, 张跃进, 张小燕
(1.西北农林科技大学生命科学学院, 陕西 杨凌712100;2.西北农林科技大学农学院, 陕西 杨凌712100)
黄精(学名:Polygonatum sibiricumRed),又名: 鸡头黄精、爪子参、老虎姜、鸡爪参。系百合科黄精属植物,集药用、美容、食用以及观赏价值于一身[1]。黄精种类繁多,作为药材使用的为黄精(Polygonatum sibiricumRed)、多花黄精(Polygonatum cyrtonema Hua)和滇黄精(Polygonatum kingianumColl),始载于《名医别录》[2]。
黄精在现行的人工栽培中多采用块茎进行无性繁殖,不仅会导致药材本身的浪费,也会对药材的品质造成巨大影响,更会使其后代退化越来越严重。所以,利用黄精实生种子进行繁殖是解决以上问题的有效途径[3]。目前,对黄精种子萌发特性、破眠方法以及繁育方式等方面研究的报道较多,但对其种子贮藏生理的研究未见报道。种子含水量和贮藏温度是决定种子在贮藏期间活力保持的关键因素[4]。Harrington早在1973年就概括出了种子寿命与种子含水量及贮藏温度间的规则,即Harrington通则:种子在5%~14%的含水量范围内,每降低1个百分点,种子寿命就会延长一倍,贮藏温度在0~50℃之间每降低5℃,种子寿命也会延长一倍[5]。当含水量相同时,贮藏温度越高,种子活力降低越快,种子寿命也越短[6]。本实验旨在研究黄精种子在不同含水量条件下,随着贮藏时间的延长其生理生化的变化及含水量对种子活力的影响,以寻求黄精种子常温贮藏条件下最佳种子含水量,为黄精种质资源保存与利用提供科学依据。
1 材料与方法
1.1 材 料
本实验所用黄精种子于2014年11月采自陕西省汉中市略阳县乌龙洞镇步长集团黄精规范化种植基地。采收后经堆积发酵、揉搓漂洗去皮后所得种子。待种子自然风干后挑选籽粒饱满、无破损、无病虫害的种子用于实验。
1.2 方 法
1.2.1 种子含水量的调整
黄精种子自然晾干后的含水量根据国际种子检验规程,采用低温烘干法进行测定。所测得的自然含水量为10%。本实验所用种子含水量分别为:15%、10%、7%和3%。将不同含水量的黄精种子贮藏在同一温度条件下,即室温条件下。
3%和7%含水量种子的获得:准确称取2份100 g黄精种子,用2层纱布包裹,放入盛有变色硅胶的干燥器中,每日更换硅胶。待种子重量减少为96.3g时,种子含水量为7%,拿出一份种子放入聚乙烯袋中进行密封保存;另一份种子继续干燥,待种子重量减轻到92.7g时即为3%含水量的种子,密封保存方法同上。
15%含水量种子的获得:称取100g的黄精种子,将其放置在70%~80%的湿度、25℃的环境下每天测其重量,待种子重量达到103.5g时即为15%含水量的种子。
从2015年3月4日开始,各处理的种子均贮藏5个月,每月3号取样测定各项指标。
1.2.2 指标测定
1)过氧化氢酶CAT、超氧化物歧化酶SOD、过氧化物酶POD活性的的测定方法参照路文静主编《植物生理学实验教程》进行测定[7]。
2)相对电导率的测定:取黄精种子50粒,3次重复,称重,用去离子水冲洗5次,置于250mL的锥形瓶中,设置空白对照,在每个样品瓶中(包括对照)加入去离子水200mL,用保鲜膜封口,放入20℃恒温箱中24h,挑出未吸胀种子,晾干后称重,用同一样品最初的重量减去未吸胀种子重量,用电导仪测定种子浸出液电导率,减去空白对照的电导率即为样品的电导率。
电导率[μS/(cm·g)]=(样品电导率-对照值)/样品重量。
3)MDA(丙二醛)含量的测定:参考高俊凤主编《植物生理学实验指导》丙二醛含量测定的方法进行测定[8]。
4)可溶性糖含量的测定:参考路文静主编《植物生理学实验教程》,蒽酮比色法测定可溶性糖含量[7]。
5)可溶性蛋白含量的测定:参考高俊凤主编《植物生理学实验指导》,考马斯亮蓝法测定可溶性蛋白含量[8]。
6)粗脂肪含量的测定:参考高俊凤主编《植物生理学实验指导》,植物组织中粗脂肪含量的测定[8]。
7)发芽率的测定:取籽粒饱满无损伤的黄精种子120粒,用3%的H2O2浸泡种子15min,蒸馏水冲洗3次,再用40℃温水浸泡30h,40粒种子一皿,3次重复。所用培养皿铺2层滤纸,适量浇水,黑暗培养60 d,培养箱温度控制在(25±1)℃,隔天观察,并记录发芽数[3]。其中3%含水量的种子在此实验前需进行种子缓湿处理,缓湿方法:黄精种子在80%RH(相对湿度)条件下缓湿5d(配制浓度为27.3%的硫酸,放入干燥器底部,种子放置在干燥器中的白瓷板上,密封干燥器,创造80%的 RH)[9]。
种子发芽率的计算公式:发芽率(%)=发芽的种子数/供检测的种子数×100%。
1.3 数据统计与分析
用DPS 2006和EXCEL 2007对实验结果进行统计和分析,采用方差分析中Duncan’s对实验数据的差异显著性进行估算。
2 实验结果与分析
2.1 含水量对黄精种子过氧化氢酶(CAT)活性的影响
CAT是植物组织中普遍存在的重要保护酶之一,其主要作用是清除细胞代谢过程中产生的H2O2,避免过多的H2O2的积累对细胞造成氧化损伤[4]。其活性是判定种子活力的一项重要指标。如图1所示,不同含水量的黄精种子在贮藏5个月期间,CAT活性先下降再上升再下降,此现象可能与种子的生理后熟有关,陆秀君等研究表明,种子在后熟期间过氧化物酶、过氧化氢酶活性会升高[10]。在贮藏3个月之后,黄精种子CAT活性开始大幅降低,其中15%含水量的种子CAT活性降低最快,3%降低最慢。从下降趋势来看,10%和15%含水量的种子降低趋势较大,3%和7%含水量的种子降低幅度较小。从图1可以看出,黄精种子在贮藏期间,含水量越高的种子CAT活性越低并且降低越快。
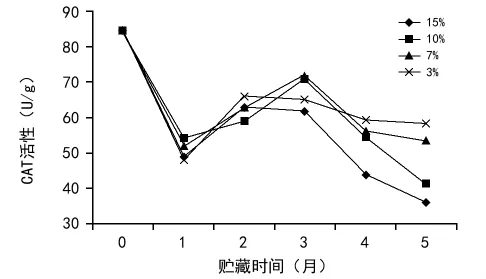
图1 含水量对黄精种子过氧化氢酶(CAT)活性的影响
2.2 含水量对黄精种子超氧化物歧化酶(SOD)活性的影响
SOD是生物体内普遍存在的一种参与氧代谢的含金属酶,与植物衰老及抗逆性紧密相关,是植物重要的保护酶之一。在种子贮藏期间,该酶活性的指标是确定种子活力的一个重要标志。由图2可以看出,不同含水量的黄精种子在贮藏期间SOD活性均有不同程度的下降,3%含水量的种子SOD活性始终较其他含水量种子高而且活力下降幅度很小,15%含水量的种子SOD活力下降速度最快。10%和15%含水量的种子从贮藏第4个月开始,SOD活性有持续快速下降的趋势。这表明低含水量贮藏的黄精种子可通过增强清除自由基的能力,减少膜损伤程度。
2.3 含水量对黄精种子过氧化物酶(POD)活性的影响
POD是植物体内普遍存在的一种酶,其活性较高,参与植物细胞内氧化还原反应,能有效清除细胞内的H2O2,是植物体内的一种保护酶。由图3可看出,不同含水量的黄精种子在贮藏过程中POD活性存在一定差异。在贮藏3个月的时候,3%和7%含水量的种子POD活性达到最大值。随着贮藏时间的延长,种子POD活性均下降,含水量越高,种子POD活性下降越快。3%含水量的黄精种子贮藏5个月后POD活性下降较贮藏前只有很小的变化。
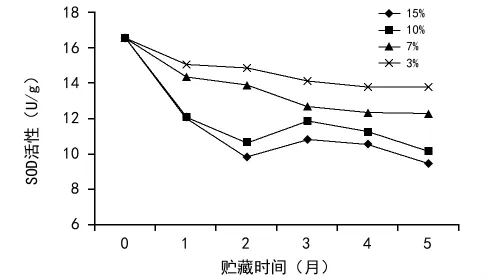
图2 含水量对黄精种子超氧化物歧化酶(SOD)活性的影响
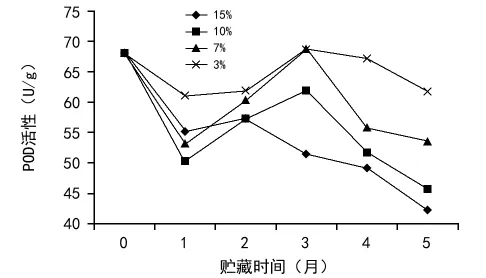
图3 含水量对黄精种子过氧化物酶(POD)活性的影响
2.4 含水量对黄精种子浸出液相对电导率的影响
种子活力与电导率之间的关系最早由Hihbard发现并提出,他对小麦和玉米等农作物的电导率做了最早的研究。它也是表示种子活力高低的一项重要指标[11]。不同含水量的黄精种子在贮藏期间种子浸出液相对电导率变化总体上均表现出逐渐升高的趋势。如图4所示,10%和15%含水量的种子相对电导率持续上升,15%上升幅度最大;3%和7%的种子相对电导率升幅较慢,且分别在贮藏3个月和4个月以后逐渐下降,这表明低含水量的种子细胞膜结构相对较稳定,膜系统的受损程度较轻。
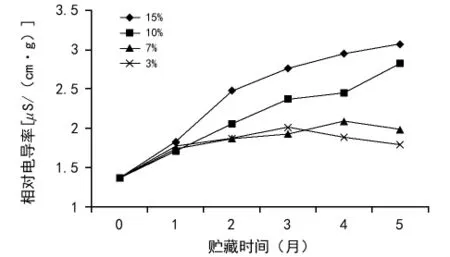
图4 含水量对黄精种子浸出液相对电导率的影响
2.5 含水量对黄精种子丙二醛(MDA)含量的影响
MDA是植物组织活性氧积累诱发的膜脂过氧化最重要的产物之一,因此可以通过测定MDA的含量来了解膜脂过氧化程度的高低。MDA含量是种子劣变程度的一个重要指标。不同含水量的黄精种子在贮藏期间MDA含量的变化如图5所示,由图5可看出,种子的MDA含量呈现不断升高的趋势,含水量越高的种子,MDA含量上升的越快。15%含水量的种子MDA含量最高并且上升幅度最大,3%含水量的种子MDA含量最低,上升幅度最小。因此,种子含水量越高,在贮藏期间膜脂过氧化程度也越高,种子劣变越快。
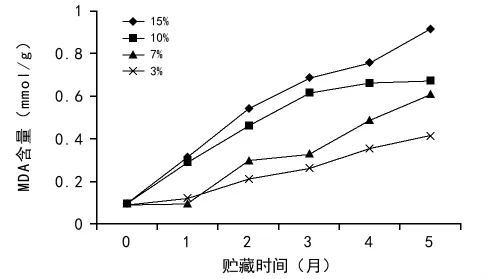
图5 含水量对黄精种子丙二醛(MDA)含量的影响
2.6 含水量对黄精种子发芽率的影响
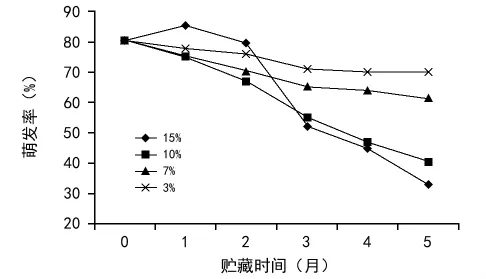
图6 含水量对黄精种子发芽率的影响
发芽率是衡量种子活力的最重要的指标。郑光华[12]曾经将种子活力定义为种子的健壮度,其中最重要的一项就是种子迅速萌发的发芽潜力。不同含水量的黄精种子在贮藏期间发芽率的变化如图6所示,由图6可看出,贮藏5个月后,不同含水量的黄精种子发芽率均下降,15%含水量的种子在贮藏第1个月时发芽率达到最高,这可能与黄精种子自身生物学特性有关,在贮藏初期,含水量较高时种子内部代谢比较活跃,同时降低了种子中的内源抑制物质的活性,所以在开始贮藏期间其发芽率较其他种子高。贮藏5个月后,3%含水量的黄精种子仍能保持高于70%的发芽率,15%含水量的种子发芽率降低到40%以下,可见,低含水量有利于黄精种子保持较高的发芽能力。
2.7 含水量对黄精种子可溶性糖含量的影响
种子贮藏物质是维持种子活力和种子寿命的营养基础。种子在贮藏过程中,其贮藏物质会经历一个动态的变化过程,这与种子的自身的代谢活动密切相关[13]。而贮藏物质的含量变化与贮藏的条件也有很大的关系。不同含水量黄精种子在贮藏期间可溶性糖、可溶性蛋白及粗脂肪含量均有不同程度的变化。
可溶性糖是种子在贮藏过程中呼吸代谢的最主要的底物[14],其含量在种子贮藏过程中的变化很复杂。由图7可看出:4种不同含水量的种子可溶性糖含量在贮藏期间,15%和10%含水量种子可溶性糖含量先升高再降低,在贮藏第3个月时可溶性糖含量达到最高,7%和3%含水量的种子可溶性糖含量先降低后升高,但是降低和升高幅度都很小,这说明,含水量低的种子在贮藏过程中呼吸代谢活动弱。15%含水量种子的可溶性糖含量显著高于其他含水量的种子,7%和3%含水量的种子可溶性含量差异不显著。
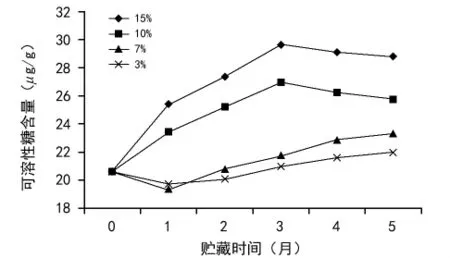
图7 含水量对黄精种子可溶性糖含量的影响
2.8 含水量对黄精种子可溶性蛋白的影响
种子的活力与蛋白合成有关,随着贮藏时间的延长,蛋白质和酶的结构发生变化,蛋白质的合成减少,种子活力降低。种子的贮藏蛋白含量与脱水敏感性和环境胁迫有关,如人工老化和贮藏温度等[15-16]。可溶性蛋白含量变化:在贮藏期内,随着贮藏时间的延长,不同含水量黄精种子的蛋白质含量均呈下降趋势,含水量越低,下降幅度越小(图8)。15%和10%含水量种子下降幅度较快,3%含水量的种子可溶性蛋白含量降低最慢,含量略高于7%的种子。在同一时期,总的表现是:随含水量的降低,黄精种子蛋白质含量逐渐增加。表明低含水量能够保持黄精种子中蛋白质和酶结构的稳定性,进而延长种子寿命。

图8 含水量对黄精种子可溶性蛋白的影响
2.9 含水量对黄精种子粗脂肪含量的影响
脂肪是种子主要的贮藏物质之一。种子萌发时,脂肪在脂肪酶的作用下分解成为甘油和脂肪酸,进一步转化为糖类供胚利用[17]。种子中的不饱和脂肪酸的氧化会形成自由基,引起膜脂过氧化反应,并且产生丙二醛,进一步对膜系统造成损伤,导致种子活力下降[16]。由图9可看出,在贮藏期内,不同含水量的黄精种子粗脂肪含量均降低。从贮藏第3个月开始,15%和10%含水量的种子粗脂肪含量明显低于7%和3%含水量的种子。15%含水量的种子粗脂肪含量低于10%的种子。3%和7%含水量的种子在贮藏5个月内粗脂肪都能保持较高的含量。
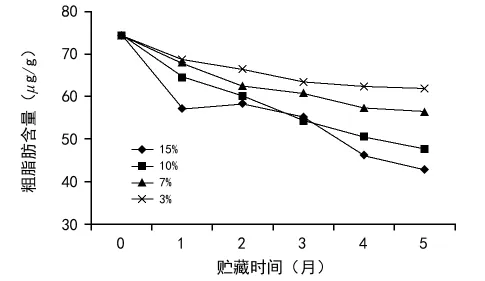
图9 含水量对黄精种子粗脂肪含量的影响
3 结论与讨论
3%含水量的黄精种子在贮藏过程中各抗氧化酶(CAT、SOD、POD)能保持较高的活性,并且自身代谢缓慢,对贮藏物质利用量小,产生自由基量小,MDA含量低,对种子的细胞膜系统有很好的保护,种子老化劣变进程缓慢,使种子能保持较高的活力。
种子的优劣是植株健壮与否的首要条件,种子从收获到播种都要经过或长或短的贮藏期,贮藏条件直接影响种子的生活力[18]。通常,种子在贮藏过程中,种子活力会随着贮藏时间的延长而逐渐下降,但是由于不同的含水量的影响,种子活力会呈现不同的变化。膜系统的破坏损伤是种子发生劣变的根本原因[19]。
超干贮藏是种子贮藏领域的一个重要方法,早在1991年就被列入国家“八五”重点攻关项目[6]。超干贮藏就是将种子含水量降至5%以下,密封后室温贮藏。近年来,种子超干贮藏生理的报道很多,包括红花、油松、当归、新麦草、水稻等不同类型的种子,均表明将种子超干处理可以有效保持种子活力,减缓种子劣变进程[20-24]。本研究将黄精种子含水量降至3%,随着贮藏时间的延长,其活力未有明显的降低,抗氧化酶活性(包括CAT、SOD、POD)明显高于7%、10%和15%含水量处理的黄精种子,MDA含量和相对电导率低且上升缓慢。15%含水量的种子相对3%、7%和10%含水量的种子抗氧化酶活性下降迅速,MDA含量和电导率上升最快。这说明高含水量的黄精种子膜系统破坏很严重,加快种子劣变进程,也会导致种子发芽率的下降。3%含水量的黄精种子在贮藏5个月后发芽率为72.5%,而15%含水量的黄精种子发芽率为33.2%,远远小于3%含水量的种子。另外,3%含水量的黄精种子可溶性糖含量相对稳定,可溶性蛋白含量和粗脂肪含量下降速度较其他含水量种子慢。这是因为含水量越低的种子,其内部代谢活动越缓慢,对种子的营养物质的消耗也越少,产生的自由基少,膜系统能得到很好的保护,种子劣变也越缓慢。
[1]周建金,罗晓锋,叶炜,等.多花黄精种子繁殖技术的研究[J].种子,2013,32(1):111-113.
[2]侯慧.黄精化学成分及药理作用研究探讨[J].黑龙江科技信息,2014(7):78.
[3]王剑龙,常晖,周仔莉,等.黄精种子萌发过程中发育解剖学研究[J].西北植物学报,2013,33(8):1 584-1 588.
[4]谢楠楠,骆文坚,姜琴,等.温度与含水量对金钱松种子贮藏的影响[J].江西农业大学学报,2011,33(6):1 100-1 106.
[5]汪晓峰,景新明,郑光华.含水量对种子贮藏寿命的影响[J].植物学报,2001,43(6):551-557.
[6]张玉凤,董经纬,蒋菊生,等.种子贮藏研究进展[J].安徽农业科学,2007,35(19):5 855-5 856.
[7]路文静,李奕松.植物生理学实验教程[M].北京:中国林业出版社,2012.
[8]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[9]孙爱清,高荣岐,尹燕枰,等.不同类型种子超干贮藏的最佳含水量范围[J].种子,2009,28(8):31-35.
[10]陆秀君,刘月津,陈晓旭,等.天女木兰种子后熟期间的生理生化变化[J].北京林业大学学报,2009,31(6):164-168.
[11]Ching,Te May.Adenosine Triphosphate Content and Seed Vigor[J].Plant Physiology.1973,51(2):400-402.
[12]郑光华.我国种子生理研究工作概况[J].植物学通报,1983(1):12-16.
[13]徐亮,包维楷,何永华.种子贮藏物质变化及其贮藏生理[J].种子,2003,22(5):60-63.
[14]Basha,Sheikh M.Soluble sugar composition of peanut seed[J].Journal of Agricultural and Food Chemistry,1992,40(5):780.
[15]刘箭,陆旺金,傅家瑞.黄皮种子发育、萌动和脱水胁迫时蛋白的合成[J].中山大学学报,1998,37(3):128-130.
[16]齐宁,刘忠堂,韩玉章,等.大豆种子脂肪蛋白质含量与萌发期耐冷性关系初探[J].中国油料,1990(3):39-41.
[17]王占红,蒋花,王瑾,等.不同沙藏处理对黄精种子内贮藏物质及萌发的影响[J].种子,2012,31(2):91-93.
[18]刘毓侠,王铁固.种子活力研究进展[J].玉米科学,2012,20(4):90-94.
[19]刘国贞,吴福海,宋华东,等.种子劣变机理研究进展[J].山东省农业管理干部学院学报,2007,23(1):159-160.
[20]胡家恕,朱诚,曾广文,等.超干红花种子抗老化作用及其机理[J].植物生理学报,1999,25(2):171-177.
[21]李庆梅,侯龙鱼,段新芳,等.油松种子超干贮藏生理生化特征的研究[J].林业科学研究,2009,22(1):124-128.
[22]王引权,赵勇,安培坤,等.不同含水量当归种子贮藏过程中生理生化特征研究[J].中国中药杂志,2012,37(2):181-185.
[23]刘大林,刘芳,高洪文,等.超干贮藏新麦草种子若干生理生化特征的研究[J].扬州大学学报,2011,32(1):35-41.
[24]胡承莲,胡小荣,辛萍萍.超干燥水稻种子贮藏研究[J].种子,1999,18(2):18-21.
