种子老化影响老芒麦种子醇溶蛋白遗传完整性的研究
2016-01-15王欣欣李鸿雁
王欣欣, 卢 萍, 李鸿雁, 黄 帆, 李 俊
(1.内蒙古师范大学生命科学与技术学院, 呼和浩特010022;2.中国农业科学院草原研究所, 内蒙古 呼和浩特010010)
老芒麦(Elymus sibiricus L.)别名西伯利亚披碱草,是禾本科(Gramineae)小麦族(Triticeae)披碱草属(Elymus)优质牧草[1]。主要分布在北半球温带地区,集中在东欧、西伯利亚、俄罗斯、中亚、西亚、蒙古、朝鲜、日本及印度,在我国野生老芒麦资源主要分布于东北、内蒙古、甘肃、宁夏、青海、新疆、四川、西藏、河北、山西、陕西、等省区[2]。老芒麦等野生披碱草属植物适应性强,具有耐盐、抗寒和抗旱等特性[3]。老芒麦植株叶量丰富,其粗蛋白含量高,适口性好,利于消化,可以青饲和放牧,也可制成干草,为牲畜所喜食[4]。
目前世界上已收集610万份植物种质资源,约90%以种子形式保存在低温种质库中[5-6]。种质库中种子的安全保存要确保种质在更新及贮存过程中维持其遗传完整性,开展种质遗传完整性的变化研究非常重要。
近年来,醇溶蛋白电泳技术广泛应用于牧草种质资源遗传完整性的研究分析,该技术简单易行、花费少,不需精密仪器,多态性较好,适合大规模检测老芒麦种质遗传完整性[7]。王芳等[8]采用醇溶蛋白电泳技术对20份大麦种质进行遗传完整性分析,发现某些大麦异质性种质的遗传完整性在繁殖更新过程中发生了变化。任守杰等[9]用醇溶蛋白电泳技术对20份小麦种质遗传完整性进行分析,发现小麦更新时,较高发芽率是维持异质性种质遗传完整性的关键因素。目前有关利用醇溶蛋白标记技术检测老芒麦种质资源遗传完整性方面的研究少有报道。本研究用A-PAGE酸性聚丙烯酰胺凝胶电泳技术,对3种老化处理条件下、4份老芒麦材料的16份种子醇溶蛋白进行分析,旨在从蛋白水平上探讨其遗传完整性变化,以期为牧草种质资源的安全保存和种子的繁殖更新标准提供参考。
1 材料与方法
1.1 供试材料
供试材料由中国农业科学院草原研究所国家牧草种质中期库提供,种质材料在2012年7月收获,保存于中期库,贮存温度(4±2)℃。

表1 试验材料及来源
1.2 老化方法
采用Delouche等提出的高温(40℃)高湿(100%RH)老化法[10]对种子进行处理,具体如下:滤纸置于干燥器中间白瓷板上,干燥器底部盛无菌水,将待处理种子以单层铺于滤纸上,保证处理条件一致,盖严干燥器,置40℃老化箱内进行高温高湿老化处理,使其发芽率分别达到80%、50%和30%左右。
1.3 种子发芽率测定
参照牧草种子检验规程[11]中老芒麦的标准发芽条件对材料进行发芽实验,发芽床铺2层滤纸,每天光照8h、黑暗16h,温度设为25℃和15℃,第5天统计发芽势,第12天统计发芽率,取平均值(见表2)。
1.4 研究方法
1.4.1 样品提取
每份材料各取30粒种子,采用半粒种子法,方法如下:将种子横切,带胚端发芽,若发芽则提取另外半粒种子进行贮藏蛋白分析;不发芽者剔除。取与发芽相对半粒种子0.2g,将样品磨碎,放入1.5mL离心管中,按1mg加入6μL的比例加入样品提取液(提前配好:25mL乙二醇+0.05g甲基绿,用无离子水定容至100mL,-4℃低温保存),在振荡器振荡混匀,于室温下浸提过夜,使用前10 000r/min离心10min,取上清液点样。
1.4.2 A-PAGE分析
参照国际种子检查协会ISTA标准程序(1986年)进行种子醇溶蛋白提取[12]。取适量凝胶溶液,按凝胶溶液1mL加入1μL 10%过硫酸铵,1μL TEMED,迅速摇匀。灌胶,插好样品梳,让其在5~10 min内聚合。醇溶蛋白的进样量为10~15μL,将电压调至200V,电泳20min,电泳在4℃冰箱中进行,将电压调至500V,待甲基绿沿指示剂迁移至底板2cm处,再将电压调为400V,指示剂迁移至凝胶前沿时,结束电泳。凝胶加1%考马斯亮蓝5mL,加10%三氯乙酸200mL染色过夜。在7%醋酸中保存,拍照。
1.5 数据处理
按条带有无分别赋值,有记为1,无记为0,计算相似系数S=2Nab/(Na+Nb)×100%(Na,Nb,Nab分别代表a、b和ab的酶带数),再应用POP-GENE 32软件进行醇溶蛋白电泳谱带差异和遗传多样性指数的统计分析[13-14]。采用 NTSYSpc 2.1软件进行聚类 分析[15-16]。
2 结果与分析
2.1 人工老化后老芒麦种子的相对发芽率
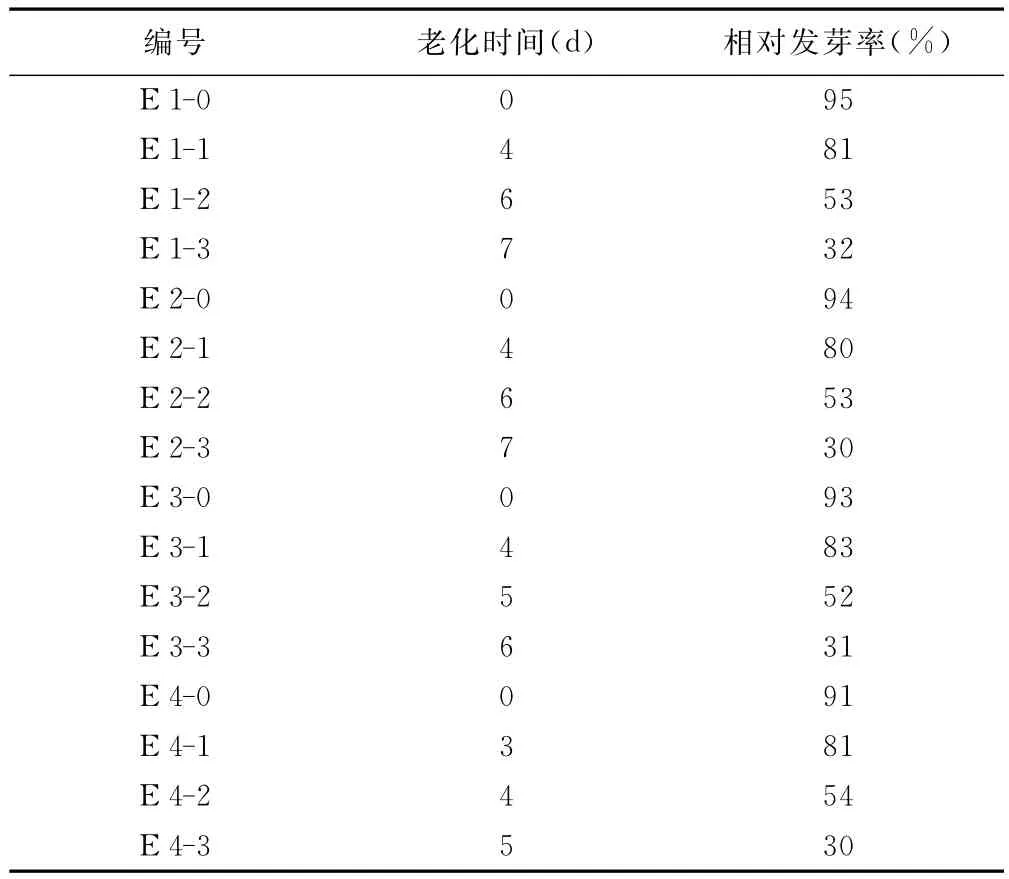
表2 人工老化处理对老芒麦种子相对发芽率的影响
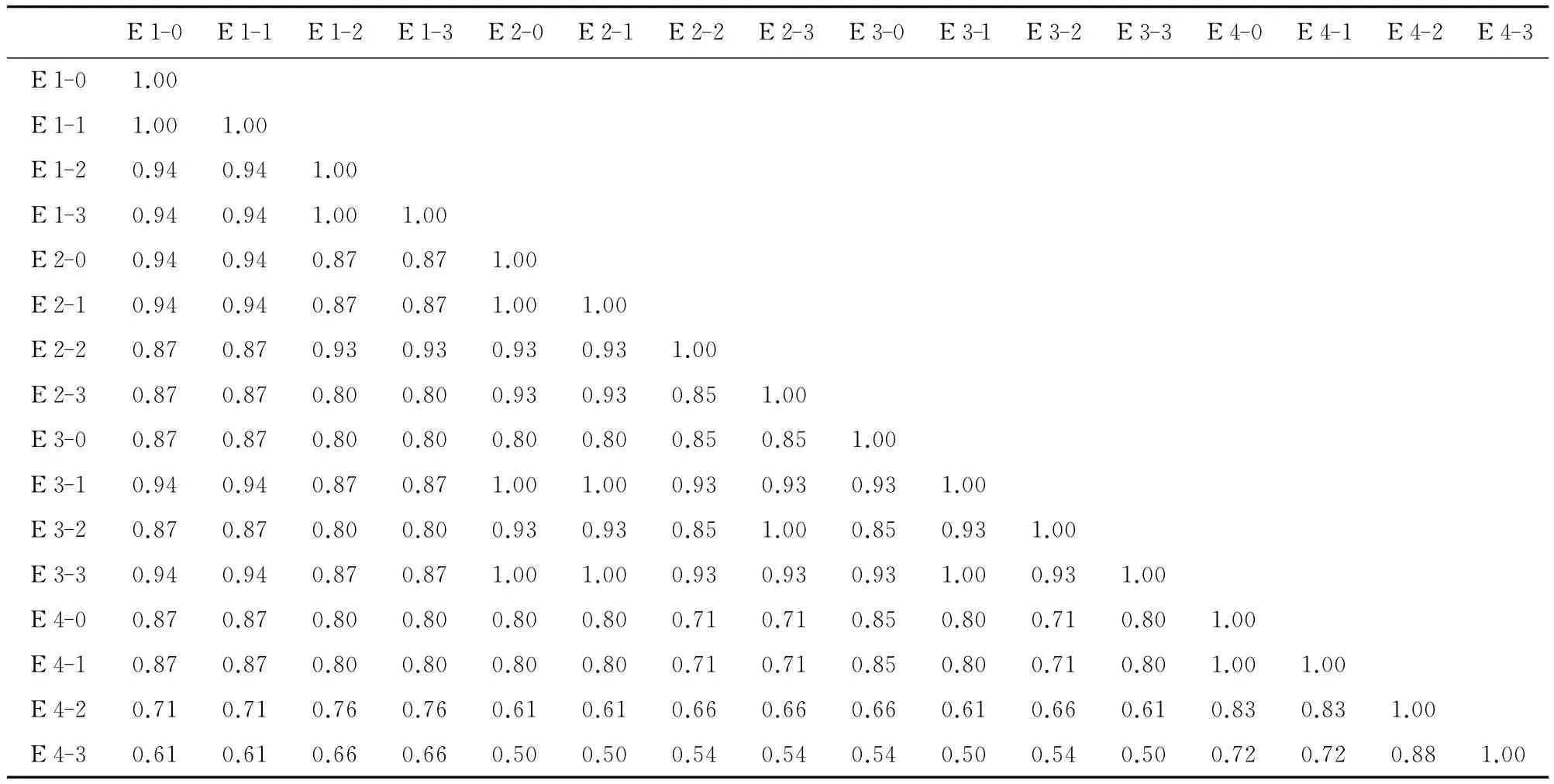
表3 16份老芒麦种质醇溶蛋白相似性系数
2.2 醇溶蛋白谱带分析
16份种质材料共检测出18条醇溶蛋白条带,均为多态性条带(见图1)。每1份材料具有其特有的醇溶蛋白指纹图谱,其中E 1条带最多,为9条,老化后发芽率降至30%的E 4条带最少,为4条,平均每份种质检测到7.3条。依照蛋白质的分子量由小到大,迁移率由快到慢将醇溶蛋白电泳图谱分为4个区,即α、β、γ和ω区。随高温高湿老化时间延长,种子生活力不断下降。4个种质以3种老化条件处理后,各分区中谱带数目有的不同。
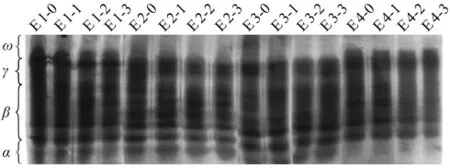
图1 老芒麦种子醇溶蛋白电泳图谱
当老化处理使发芽率降至50%左右时,醇溶蛋白图谱颜色逐渐变浅,随着老化时间进一步延长,发芽率降到30%左右,α、β区的醇溶蛋白有的谱带表现为消失。
2.3 醇溶蛋白相似性系数
老芒麦醇溶蛋白条带相似性系数见表3,老化处理后E 1的4个材料的种质相似性系数在0.94和1.00间;E 2的4个材料的相似性系数在0.85和1.00间;E 3的相似性系数在0.85与1.00间;E 4的相似性系数在0.72和1.00间,其中 E 1-0和 E 1-1,E 1-2和E 1-3,E 2-0 和 E 2-1,E 2-0和 E 3-1,E 2-1和 E 3-1,E 2-3和 E 3-2,E 2-0和 E 3-3,E 2-1和 E 3-3,E 3-1和E 3-3,E 4-0和E 4-1材料间的相似系数为1.00,说明亲缘关系最近;E 2-0和E 4-3,E 2-1和E 4-3,E 3-1和E 4-3,E 3-3和E 4-3材料间的相似系数最小,为0.50,说明亲缘关系相对远些;老化后发芽率降至50%左右后,相似系数较未老化的种质发生很大变化,种质间存在较大的遗传差异,遗传组成上发生了变化。
2.4 醇溶蛋白遗传参数分析
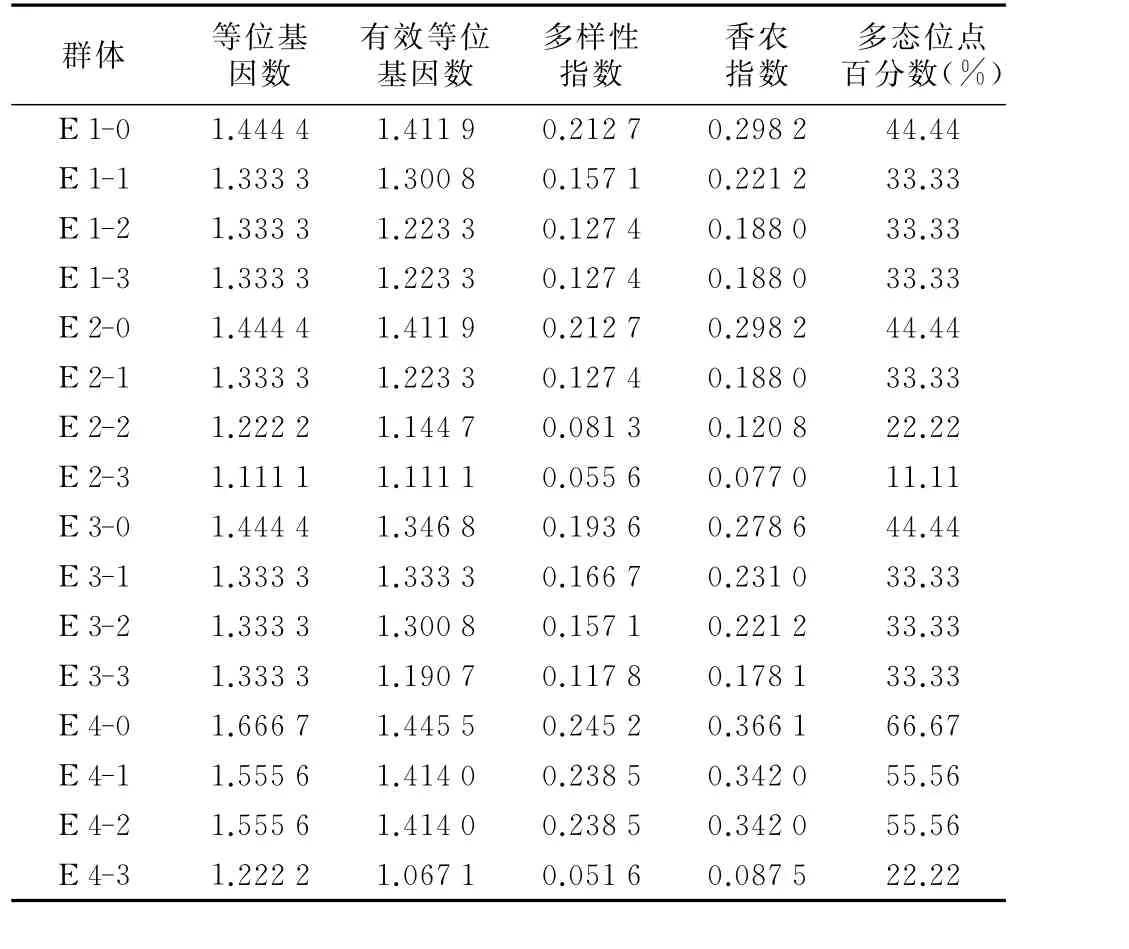
表4 老芒麦材料间的等位基因数、有效等位基因数、多样性指数、香农指数
从表4可以看出,4份老芒麦种质4个不同发芽率群体的等位基因数、有效等位基因数、Nei’s基因多样性、Shannon多样性指数、多态性位点百分数这5个指标均随着发芽率的下降而呈现下降的趋势,这初步说明随老化程度的加大,低发芽率的老芒麦种质对其遗传完整性产生不利的影响。
2.5 聚类分析
老芒麦醇溶蛋白聚类分析结果见图2,将材料划分为三大类,其中第1类包括 E 4-2和 E 4-3号材料,来自E 4发芽率为54%和30%的2个梯度种质;第2类包括 E 4-0和E 4-1号材料,来自E 4发芽率91%和81%的2个梯度种质;第3类包括E 1-0、E 1-1、E 1-2、E 1-3、E 2-0、E 2-1、E 3-1、E 3-3、E 2-2、E 2-3、E 3-2和E 3-0号材料,其中E 1-0、E 1-1、E 1-2、E 1-3号材料为E 1种质,E 2-0、E 2-1、E 2-2、E 2-3号材料为E 2种质,E 3-0、E 3-1、E 3-2、E 3-3为E 3种质。由此看出,来源相同的种质材料部分聚在一起,呈现出规律性,即同一种质不同的老化处理材料先聚一起,如来自E 1和E 4的材料各自聚为一类。但E 2和E 3的材料出现交叉,原因可能与老化后的种质遗传完整性改变有关。
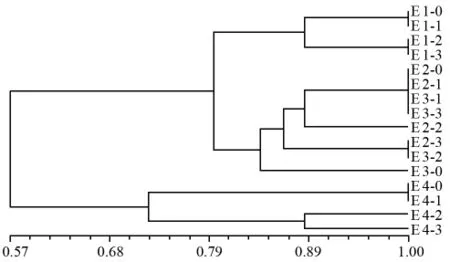
图2 基于醇溶蛋白图谱的老芒麦种质材料聚类图
E 4的4个材料间聚类分析见图3,划分为两大类,发芽率为91%的群体(对照)和81%的群体为一类;发芽率54%的群体和30%的群体聚为一大类。说明老化后群体内的某些醇溶蛋白基因序列可能改变或消失,同时表明低发芽率种质资源不利于遗传完整性的保持。
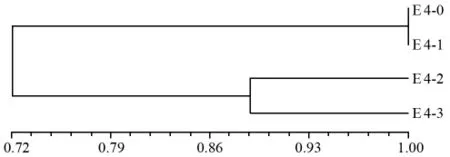
图3 03658老芒麦基于种子醇溶蛋白的聚类图
3 讨 论
谭富娟等对燕麦种子贮存后遗传完整性的研究分析发现,不同贮存年代种子的酯酶、淀粉酶、过氧化物酶、同工酶和醇溶蛋白图谱中陈旧材料的条带数明显减少、颜色变浅[17]。张晗等对大麦地方品种普乃干木进行醇溶蛋白谱带分析,发现发芽率降到34%时,白带型Ⅲ生物型随之消失[18]。本研究发现,经高温高湿老化处理后,老芒麦种子发芽率降至50%左右时种子醇溶蛋白图谱有条带颜色变浅,有的消失,同一种质不同老化处理、不同发芽率材料间的相似系数出现变化,与上述研究的结论相同。
人工老化处理的低发芽率种质群体的等位基因数、有效等位基因数、Nei’s基因多样性、Shannon多样性指数、多态性位点百分数的参数值,较对照种质的数值有所下降,说明老化后种子活力降低,某些醇溶蛋白基因的DNA序列改变或丢失,对其遗传完整性维持产生不利影响。这与任守杰[9]、张晗[19]和王小丽[20]等对20份小麦种质、不同发芽率水平玉米和扁蓿豆的研究结果相似。
聚类分析发现,低发芽率E 4种质(54%的群体和30%群体)聚为一类,发芽率为91%的群体(对照)和81%的群体为一类,种质老化后群体内出现遗传变异,某些序列可能改变或丢失,老化后无法聚在一起;同一种质E 1和E 4不同的老化处理的材料,先聚一起,也有部分材料有分支,可能受到老化处理的影响使其发生了突变。另外,老芒麦是常异花授粉植物,杂交使基因型发生了改变。
醇溶蛋白标记是检测植物多态性较好的技术手段,只能反映基因编码区的部分变异,今后可以结合其它标记技术,如形态学标记、细胞学标记及DNA分子标记(AFLP、SNP、SSR、ISSR)等进行全面分析,以求准确反映种子老化对其遗传完整性的影响。
[1]陈默君,贾慎修.中国饲用植物[M].北京:中国农业出版社,2002:121-122.
[2]郭本兆,王世金,李健华.大麦属的属间亲缘和属下分类的研究[J].西北植物学报,1986,6(1):23-31.
[3]Megulre P E,Dvorak J.High salt tolerance potential in wheat grasses[J].Crop Science,1981,21:102-105.
[4]吴勤.老芒麦改良干草原草地的效果分析[J].宁夏农林科技,1992(4):35-36.
[5]严学兵.披碱草属植物遗传多样性研究[D].北京:中国农业大学,2005.
[6]陈叔平.种质资源低温保存原理和技术[M].北京:中国农业科技出版社,1995:177-218.
[7]齐冰洁,刘景辉,高聚林,等.燕麦种质资源醇溶蛋白遗传多样性研究[J].麦类作物学报,2010,30(3):427-430.
[8]王芳,卢新雄,马晓岗,等.基于醇溶蛋白的20份大麦种质资源遗传完整性分析[J].麦类作物学报,2007,27(4):607-612.
[9]任守杰,张志娥,陈晓玲,等.基于醇溶蛋白的20份小麦种质遗传完整性分析[J].植物遗传资源学报,2006,7(1):44-48.
[10]Delouehe J C,Baskin C C.Accelerated aging techniques for predicting the relative storability of seeds lot[J].Seed Sci Technol,1973,1(2):427-452.
[11]GB 2930-82,牧草种子检验规程[S].北京:中国标准出版社,2001.
[12]Draper S R.ISTA variety committee report of the working group for biochemical tests for cultivar identification 1983-1986[J].Seed Science and Technology,1987,15:431-434.
[13]Nakata M,Tanaka R.Species of Chrysanthemum in Japan in the study of chromosomes[M].Beijing(China):Acade-mia Sinica,1987:17-22.
[14]宣继萍,高鹤,刘建秀.中国假俭草居群遗传多样性研究ⅢRAPD分析[J].草业学报,2005,14(4):47-52.
[15]额尔敦嘎日迪,中田昇,李造哲.内蒙古干旱、半干旱地区野生扁蓿豆种子贮藏蛋白质的变异[J].中国草地学报,2006,28(2):52-55.
[16]闫伟红,徐柱,李临杭,等.冰草属植物醇溶蛋白遗传分析与评价[J].草地与草坪,2010,30(1):1-6.
[17]谭富娟,范传珠,马缘生,等.燕麦种子贮存后遗传完整性研究[J].种子,1997,16(5):9-12.
[18]张晗,卢新雄,张志娥,等.种子老化诱导小麦染色体畸变及大麦醇溶蛋白带型频率变化的研究[J].植物遗传资源学报,2004,5(1):56-61.
[19]张晗,卢新雄,张志娥,等.种子老化对玉米种质资源遗传完整性变化的影响[J].植物遗传资源学报,2005,6(3):271-275.
[20]王小丽,李志勇,李鸿雁,等.种子老化对扁蓿豆种质遗传完整性变化的影响[J].中国草地学报,2010,32(6):52-57.
各类文献规范数据选项表
