不同浓度DMSO对Min6胰岛细胞活力和ROS产生的影响
2016-01-11张红,张丽,张燕等
不同浓度DMSO对Min6胰岛细胞活力和ROS产生的影响
张红1, 张丽2, 张燕3, 张之4
(新疆医科大学1附属中医医院药学部;2基础医学院组织胚胎学教研室, 乌鲁木齐830011;
3兰州军区乌鲁木齐总医院, 乌鲁木齐830000;4新疆医科大学基础医学院药理学教研室, 乌鲁木齐830011)
摘要:目的观察不同浓度二甲基亚砜(DMSO)对Min6胰岛细胞活力和细胞活性氧族(ROS)产生的影响。方法无菌洁净环境下培养Min6胰岛细胞株,细胞良好生长状态时,分为正常对照组(DMSO含量为0%)及DMSO各浓度组,用不同浓度DMSO(0.005%、0.012 5%、0.05%、0.125%、0.25%)干预Min6 胰岛细胞48 h,采用细胞增殖和毒性检测试剂盒(Cell Counting Kit-8,CCK8法)检测细胞活力,采用2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)探针法检测ROS的产生水平。结果与正常对照组比较(不含DMSO),0.005%、0.012 5%、0.05%、0.125%,0.25% DMSO组细胞活力均降低;0.005%、0.012 5%、0.05%、0.125% DMSO组间细胞活力差别不大,0.25%DMSO组细胞活力进一步下降,同时ROS产生明显增加。结论Min6细胞对DMSO敏感,DMSO浓度水平对细胞活力、ROS水平有一定影响,建议相关实验时注意各组DMSO 含量本身齐同可比,以免影响结果判断。
关键词:DMSO; 胰岛细胞; 细胞活力; 活性氧族
中图分类号:R33文献标识码:A
doi:10.3969/j.issn.1009-5551.2015.04.012
[收稿日期:2014-06-25]
基金项目:新疆名医名方与特色方剂学实验室开放项目(XJDX0910-2011-8)
作者简介:孙芸(1976-),女,硕士,副教授,研究方向:中药及其制剂分析与质量控制。
基金项目:新疆维吾尔自治区重点实验室医学动物模型研究实验室开放课题(XJDX1103-2012-10)
作者简介:魏琴(1980-),女,在读硕士,实验师,研究方向:免疫学。
The effects of DMSO on cell viability and reactive oxygen species
production in Min6 islet cell
ZHANG Hong1, ZHANG Li2, ZHANG Yan3, ZHANG Yanzhi4
(1DepartmentofPharmacy,TraditionalChineseMedicineHospital,2DepartmentofHistoembryology,
XinjiangMedicalUniversity,Urumqi830011,China;3UrumqiGeneralHospitalofLanzhou
MilitaryAreaCommand,Urumqi830000,China;4DepartmentofPharmacology,
XinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTo observe the effects of dimethyl sulfoxide on Min6 islet cell viability and Reactive Oxygen Species Production (ROS). MethodsMin6 islet cell was cultured under sterile clean environment condition, then interfered by DMSO of different concentration, Cell Counting Kit-8 was adopted to detect the cell viability, DCFH-DA probe was used to detect the Production of ROS. ResultsCompared with 0% DMSO group , Min6 cell viability decreased in group containing DMSO 0.005%, 0.0125%, 0.05%, 0.125%, 0.25%, there was little difference of cell viability between groups containing 0.005%, 0.0125%, 0.05%, 0.125% DMSO. Cell viability decreased further in 0.25% DMSO group,at the the same time ROS production increased. ConclusionMin6 cell sensitive to DMSO,different concentration of DMSO may have different influence on cell viability and intracellular ROS level. it is suggested that to keep the same concentration of DMSO in different group or wrong conclusion may be get.
Key words: DMSO; Islet cell; Cell Viability; Reactive Oxygen Species
糖尿病已经成为21世纪的流行病[1],胰岛细胞是在细胞水平对相关药物作用进行研究的有力工具,二甲基亚砜(dimethyl sulfoxide,DMSO)是细胞冻存的保护剂[2],也是活细胞培养实验中常用的试药溶解剂,但不同浓度DMSO本身对培养的细胞会产生截然不同的影响,因此可能成为影响实验结果的重要因素之一。本课题组在培养Min6胰岛细胞进行相关实验时遇到类似问题,但DMSO本身对胰岛细胞的影响鲜有文献报道。为了帮助排除实验干扰,本研究探讨不同浓度DMSO对培养的Min6胰岛细胞活力和细胞活性氧族(ROS)的影响,旨在为相关领域实验提供一定的参考依据。
1材料与方法
1.1主要试药及仪器Min6胰岛细胞株(ATCC)由中南大学刘峰教授惠赠,二甲基亚砜、四甲基偶氮唑蓝(Sigma aldrich公司),DMEM培养基、胎牛血清、β-巯基乙醇、胰蛋白酶(Gibico by Life Technology),Cell Counting Kit(Yeasen ),活性氧族(reactive oxygen species,ROS)检测试剂盒(碧云天),超净工作台(中国苏州净化设备公司),CO2细胞培养箱(美国 INNOVA 公司),全自动酶标仪(美国 Bio-RAD 公司),HAIR低温冰箱(Hair公司),超纯水机(美国Millipore),高压蒸汽灭菌器(上海申安医疗器械厂)。
1.2实验方法
1.2.1细胞培养及传代Min6小鼠胰岛细胞用DMEM 培养基(含15%胎牛血清、100 U/mL青霉素和 100 μg/mL链霉素、1 μL/mLβ-巯基乙醇),37℃、5%CO2恒温培养箱中培养[3-4],隔夜更换培养液,之后2~3 d换液。细胞生长至底面覆盖率约达到70%时,弃培养基,用PBS洗涤1次,每皿加入 1 mL胰酶消化液,消化4~5 min,显微镜下观察,发现胞质回缩、细胞间隙增大后,立即终止消化。然后加入DMEM 培养基 4 mL终止消化,用移液器反复轻轻吹打使细胞团分散成均匀细胞混悬液,分皿培养。
1.2.2分组及DMSO干预细胞状态良好时分为正常对照组(既DMSO含量0%组)及DMSO各浓度组,分别为0.005%、0.0125%、0.05%、0.125%、0.25%浓度组,各组干预时间均为48 h。
1.2.3胰岛细胞活力测定培养良好的胰岛细胞铺96孔培养板,过夜更换培养液后,按上述浓度进行干预,每组设3个复孔,并设不含细胞只含培养液的空白调零孔。干预48 h后,采用CCK8法检测细胞活力[5-6], 在电子耦合试剂存在的情况下,WST-8 可以被线粒体内的脱氢酶还原生成高度水溶性的橙黄色的甲臜产物,颜色的深浅间接反映活细胞数量,与细胞的增殖活力成正比,与细胞毒性成反比,在450 nm波长处测定其光吸收值。
1.2.4细胞活性氧族水平测定各组干预完成后,给各组细胞装载20 μM DCFH-DA(2′,7′-二氯荧光黄双乙酸盐)探针,继续在 CO2培养箱 37℃孵育30 min后尽快洗涤细胞降低背景,在激发波长488 nm左右处检测DCFH氧化物-DCF发出的绿色荧光,测定细胞内ROS水平[7-9]。

2结果
2.1Min6胰岛细胞的一般情况显微镜下可以观察到,用胰酶消化液消化的胰岛细胞,胞质回缩,细胞间隙增大,成类圆形,见图1;分皿培养后Min6细胞贴壁生长,呈多角、类瓦块状,融合聚集生长,见图2。
图1 刚消化的Min6胰岛细胞

图2 生长融合的Min6胰岛细胞
2.2细胞活力测定结果与正常对照组比较(含0%DMSO),0.005%、0.0125%、0.05%、0.125%、0.25% DMSO组细胞活力均明显下降(P<0.01,P<0.05);与0.005% DMSO组比较,0.0125%、0.05%、0.125%DMSO组细胞活力未见明显差别,而0.25%DMSO组细胞活力明显下降(P<0.05),显示不同浓度DMSO对细胞活力有不同影响,见表1、图3。
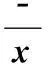

组别DMSO浓度/%细胞活力/%ROS正常对照组0 1007.97±0.440.005%DMSO组0.00586.1±0.06#7.48±0.350.0125%DMSO组0.012581.5±2.69#6.45±0.30#*0.05%DMSO组0.0581.3±3.16#5.67±0.27#*0.125%DMSO组0.12581.5±2.69#5.42±0.03#*0.25%DMSO组0.2578.8±0.70#*6.55±0.19#*△
注:与正常对照组比较,#P<0.05; 与0.005% DMSO组比较,*P<0.05; 与0.125% DMSO组比较,△P<0.05。

图3 不同浓度DMSO对Min6胰岛细胞活力的影响
2.3细胞ROS水平测定结果与正常对照组比较,0.0125%、0.05%、0.125%、0.25%DMSO组细胞内ROS的产生下降(P<0.01);与0.005%DMSO组比较,0.0125%、0.05%、0.125%、0.25%DMSO组ROS产生减少(P<0.01);与0.125% DMSO组比较,0.25%DMSO组细胞内ROS产生增加(P<0.01),见表1、图4 。
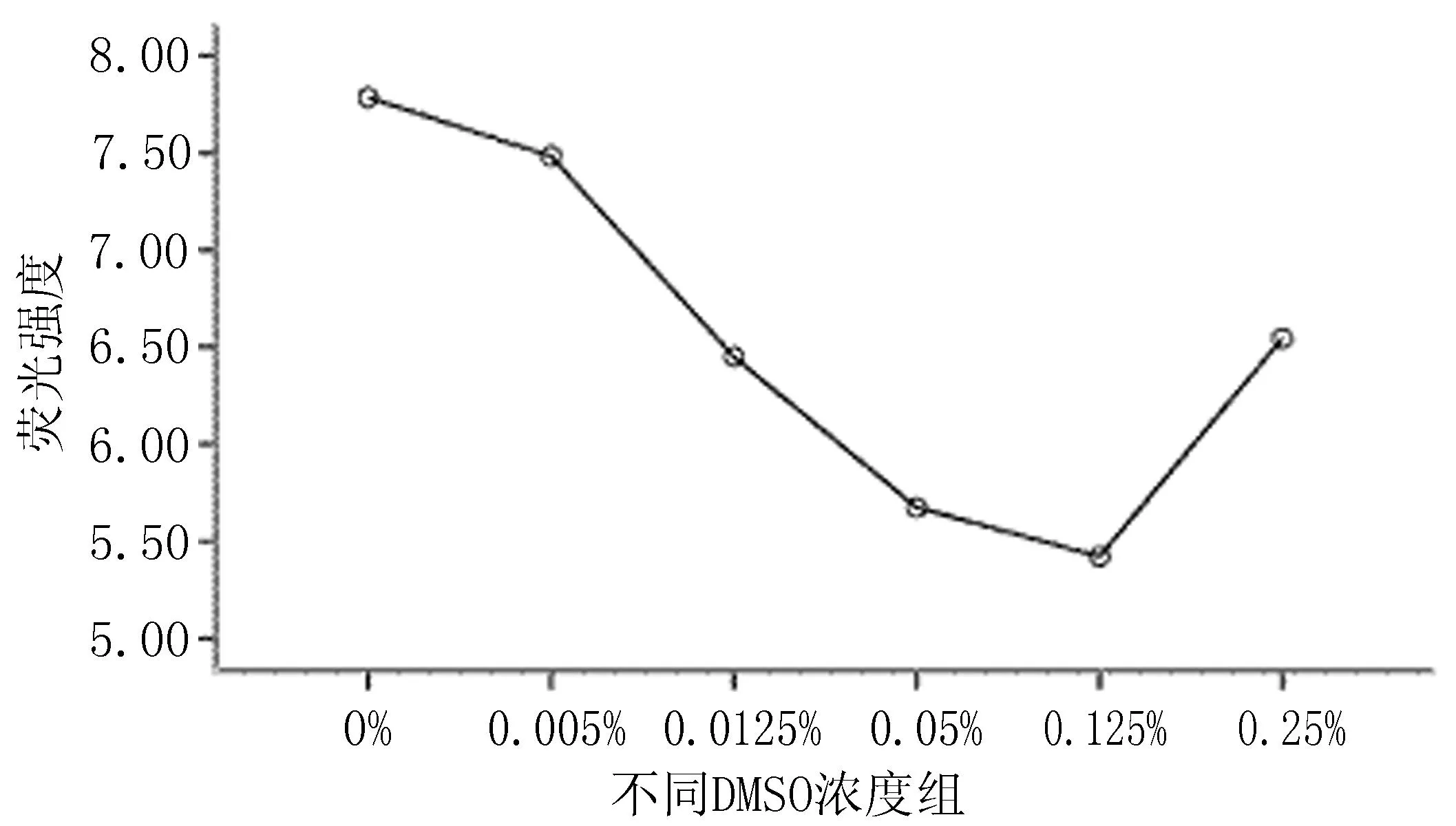
图4 不同浓度DMSO对Min6胰岛细胞内ROS产生的影响
3讨论
DMSO作为重要的药物溶解剂用于细胞培养实验,但不同细胞对DMSO的敏感性差异甚大,如研究报道DMSO终浓度<2%时对PC12细胞活力无影响,但浓度>4%时有明显细胞毒性[10]。而对于小鼠骨髓基质细胞(BMSC),DMSO浓度为0.5%~1.0%时就有明显的生长抑制作用[11]。可见DMSO对不同细胞的影响浓度差异很大,不能从其对一种细胞的影响结果推及另一种细胞。
国外相关文献报道胰岛细胞常用的DMSO终浓度一般不超过0.2%[12-13],但原因不详。本实验研究显示,0.005%浓度的DMSO就可能对Min6胰岛细胞产生明显影响,与不含DMSO的培养组比较,含DMSO各浓度组的细胞活力均有降低(DMSO浓度组范围0.005%~0.25%),DMSO浓度<0.125%的各组之间(0.005%、0.012 5%、0.05%、0.125% )细胞活力维持在一个相对稳定的平台,各组间细胞活力相差不大,而浓度> 0.125%时0.25% DMSO组细胞活力进一步下降,同时细胞内ROS水平产生明显增加,说明Min6胰岛细胞对DMSO很敏感,这与胰岛细胞内还原系统相对弱、易受到氧化应激损伤的特点是相对应的,而0.1%~0.2% DMSO浓度可能是影响胰岛细胞活力的重要转折点。
最近甚至有研究表明DMSO本身有一定抗炎、清除ROS、抑制自发性糖尿病等作用[14],因此在实验中应当充分重视DMSO溶剂本身的作用,建议相关实验中最好保持各组DMSO含量齐同可比,以免影响实验结果的正确判断。
参考文献:
[1]Ginter E, Simko V. Type 2 diabetes mellituspandemic in 21st century[J]. Adv Exp Med Biol, 2012, 771:42-50.
[2]袁慧敏,张旭成,王 贺, 等.不同冷冻保护剂对黑熊成纤维细胞冷冻效果的影响[J].江苏农业科学,2011,3(1):242-243.
[3]Yamato E, Tashiro F, Miyazaki J.Microarray analysis of novel candidate genes responsible for glucose-stimulated insulin secretion in mouse pancreatic β cell line MIN6[J].PLoS One,2013,8(4): e61211.
[4]Chen YC, Fueger PT, Wang Z. Depletion of PAK1 enhances ubiquitin-mediated survivin degradation in pancreatic β-cells[J].Islets,2013,5(1):22-28.
[5]Chen ZF1, Li YB, Han JY, et al. Liraglutide prevents high glucose level induced insulinoma cells apoptosis by targeting autophagy[J].Chin Med J (Engl), 2013,126(5):937-941.
[6]Jing Yin J, Bo Li Y, Ming Cao M, et al.Liraglutide Improves the Survival of INS-1 Cells by Promoting Macroautophagy[J].Int J Endocrinol Metab,2013,11(3):184-190.
[7]Grankvist N1, Amable L, Honkanen RE, et al. Serine/threonine protein phosphatase 5 regulates glucose homeostasis in vivo and apoptosis signalling in mouse pancreatic islets and clonal MIN6 cells[J]. Diabetologia, 2012,55(7):2005-2015.
[8]Xiuli Lu,,Jianli Liu, Xiangyu Cao, et al. Native low density lipoprotein induces pancreatic β cell apoptosis through generating excess reactive oxygen species[J]. Lipids Health Dis,2011,10: 123.
[9]Kushibiki T, Hirasawa T, Okawa S, et al. Blue laser irradiation generates intracellular reactive oxygen species in various types of cells[J]. Photomed Laser Surg,2013,31(3):95-104.
[10]吴迪,巴哈尔古丽·卡哈尔,吴桂荣,等.溶媒二甲基亚砜对细胞生长与活力的影响研究[J].新疆医科大学学报,2010,33(5):489-491.
[11]韩大良,刘克清,郭少三,等.二甲亚砜、吐温80对小鼠骨髓来源细胞体外生长和活力影响的量效关系分析[J].中国实验血液学杂志,2008,16(2):377-380.
[12]Lansky EP, Newman RA.Punica granatum (pomegranate) and its potential for prevention and treatment of inflammation and cancer[J]. Ethnopharmacology,2007,109(2):177-206.
[13] Keller AC1, Ma J, Kavalier A, et al.Saponins from the traditional medicinal plant Momordica charantia stimulate insulin secretion in vitro[J]. Phytomedicine, 2011,19(1):32-37.
[14]Lin GJ, Sytwu HK, Yu JC, et al. Dimethyl sulfoxide inhibits spontaneous diabetes and autoimmune recurrence in non-obese diabetic mice by inducing differentiation of regulatory T cells[J].Toxicol Appl Pharmacol, 2015 ,282(2):207-214.
(本文编辑杨晨晨)
通信作者:安冬青,女,教授,博士生导师,研究方向:心血管疾病的中医药诊治,E-mail: andongqing3@gmail.com。
通信作者:丁剑冰,女,博士,教授,博士生导师,研究方向:感染免疫,E-mail:djbing002@ sina.com。
