Livin 及PTEN 基因在慢性萎缩性胃炎伴肠化黏膜中的表达
2015-12-31陈吉,崔琴
陈 吉,崔 琴
内蒙古包钢医院消化科,内蒙古 包头014010
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)伴有不完全型肠上皮化生和/或中重度不典型增生被视为癌前病变。凋亡抑制蛋白(inhibitor of apoptosis protein family,IAPs)家族是由Crook 等[1]首先发现的,因其在凋亡抵抗中作用显著而日益受到重视。Livin 是最近发现的IAPs 中的新成员[2],因该基因在此家族中抗凋亡活性最强,所以受到当今国内外学者的重视[3-4]。抑癌基因张力蛋白类物(phosphatase tensin homologue,PTEN)是Li 等[5]发现的第1 个具有磷酸酶活性的抑癌基因,在调控细胞生长、分化和凋亡平衡等过程中起重要作用[6],其出现突变、缺失和调控异常,可促使细胞凋亡减弱,从而促进肿瘤的发生、发展。本研究拟检测Livin 及PTEN 在CAG 伴肠化黏膜组织中的基因和蛋白的表达情况,探讨其在CAG 伴肠化癌变过程中的作用,并为CAG 伴肠化早期癌变的发病过程提供临床诊断依据。
1 资料与方法
1.1 资料收集 收集2009 年11 月-2010 年11 月在内蒙古包钢医院内窥镜室接受胃镜检查的有上消化道症状的患者,所有患者术前均未经化疗及放疗,并经病理和内窥镜结合确诊为CAG 伴肠化者35 例,男15例,女20 例,年龄38 ~68 岁,平均年龄(56.38 ±7.70)岁;胃癌患者30 例,男17 例,女13 例,平均年龄(61.87 ±2.74)岁;慢性浅表性胃炎(chrohic super-ficial gastritis,CSG)30 例,男12 例,女18 例,平均年龄(40.63±7.00)岁。所取标本一半用多聚甲醛固定24 h后石蜡包埋,另一半先置液氮中冷冻,后移至-80 ℃冰箱冻存。所取组织新鲜,患者知情同意。
1.2 试剂及仪器 TRIzol 购自美国Invitrogen 公司,Real-time PCR 试剂购自ABI 公司,特异性引物和探针(Taq-Man 探针、FAM 标记)由杭州赫贝公司合成。兔抗人Livin 多克隆抗体购自武汉博士德生物公司,鼠抗人PTEN 单克隆抗体(即用型)购自福州迈新生物技术有限公司,兔抗人Actin 多克隆抗体购自Santa Cruz公司(USA)。PVDF 膜购自Roch 公司(USA),Prime 7300 荧光定量PCR 仪(购自美国ABI 公司)。免疫组化(SP)试剂盒购自福州迈欣生物技术公司。
1.3 方法
1.3.1 实时荧光定量PCR (RT-PCR):按照说明书提取CSG、CAG 伴肠化、胃癌组织中总RNA。核酸定量仪测定总RNA 含量和纯度,紫外分光光度计测定A260/280 在1.8 ~2.0,经15 g/L 琼脂糖凝胶电泳鉴定RNA 完整性良好。取总RNA 2 μg 作为模板,按照逆转录试剂盒说明书步骤将其逆转录为cDNA。置于-20 ℃长期保存。引物序列如下,Livin 上游5'-TGACCTGGAGAGAGGACCCA-3',下游3'-GTCCAGGACAGGCAGAGAGG-5';PTEN 上 游 5'-AGGGGCATCAGCTACCGCCA-3',下 游3'-TGGCTGTCATGTCTGGGAGCCT-5';β-actin 上 游: 5'-AGCGGGAAATCGTGCGTG-3',下 游:3'-CAGGGTACATGGTGGTGCC-5'。按照PCR 试剂盒说明书步骤进行反应95 ℃预变性10 min,随后进行40 个循环的PCR 扩增反应(95 ℃变性15 s,60 ℃退火与延伸1 min),最后融解曲线的反应条件为95 ℃15 s,60 ℃1 min,95 ℃15 s,60 ℃15 s。计算公式为:2-ΔΔct。
1.3.2 Western blotting 法检测蛋白在胃黏膜不同分组中的表达:将100 mg 新鲜组织提取的总蛋白用考马斯亮蓝试剂盒定量。取50 μg 蛋白上样到SDSPAGE 凝胶,50 V 电泳30 min,100V 继续电泳1.5 ~2 h。将凝胶上的蛋白电转移至NC 膜,以5%脱脂奶粉4 ℃封闭过夜,分别加一抗(兔抗人Livin 多克隆抗体1∶500,兔抗人Actin 多克隆抗1∶500;鼠抗人PTEN 单克隆抗体1∶500),37 ℃孵育2 h,0.1% TBST 液漂洗PVDF 膜3 ×10 min,取出PVDF 膜加入二抗(辣根过氧化物酶标记的兔抗鼠二抗1∶1 000),37 ℃孵育2 h,TBST 洗膜后加入ECL 试剂,曝光,显影,定影,对X 光底片拍照保存。
1.3.3 免疫组化检测蛋白表达:所有标本石蜡切片均经二甲苯脱蜡,梯度乙醇水化,抗原修复,滴加过氧化物酶阻断液,室温下孵育10 min,磷酸盐缓冲液(PBS)冲洗,滴加一抗,室温下孵育60 min,PBS 冲洗,滴加聚合物增强剂,室温下孵育10 min,滴加酶标抗鼠/兔聚合物,室温下孵育10 min,二氨基联苯胺(DAB)显色,苏木素复染,脱水,透明,封片,光镜下观察并摄片。以PBS 代替一抗作为阴性对照;阳性对照片以福州迈新生物技术开发有限公司所赠样片为准。Livin、PTEN染色阳性信号呈黄色或棕黄色颗粒,定位于细胞的胞浆内,PBS 代替一抗作为阴性对照。采用半定量积分法判定结果[7],每张切片随机选5 个高倍视野观察,计数100 个细胞,阳性细胞数≤5%为0 分,6%~25%为1 分,26% ~50%为2 分,51% ~75%为3 分,>75%为4 分;根据免疫阳性细胞染色程度,不着色为0 分,浅黄色为1 分,棕黄色为2 分,棕褐色为3 分。综合评分由两类积分相乘,0 ~1 分为阴性(-),2 ~4 分为弱阳性(+),5 ~8 分为阳性(+ +),9 ~12 分为强阳性(+ + +)。将(+)、(+ +)、(+ + +)归为阳性组计算阳性率。
1.4 统计学方法 采用SPSS 16.0 统计软件包进行处理。多组定量资料比较采用单因素方差分析,组间两两比较采用LSD-t 检验,各组计数资料采用χ2检验,所有数据均经正态检验及方差齐性检验,两组数据之间的相关性采用Pearson 相关分析,P <0.05为差异有统计学意义。
2 结果
2.1 RT-PCR 检测结果
2.1.1 Livin mRNA 在胃组织不同黏膜中的表达:胃黏膜不同组织中总RNA 的吸光度比值(A260/A280)均为1.8 ~2.0。Livin mRNA 在CSG 组织中无表达,在CAG 伴肠化、胃癌组织中表达量分别为6. 012 ±0.312、6.283 ±0.319,其在CAG 伴肠化、胃癌组织中的表达量均高于CSG 组织(t =2.545,P =0.014;t =3.083,P=0.013),但CAG 伴肠化组织与胃癌组织中Livin mRNA 的表达量比较,差异无统计学意义(t =1.485,P=0.135)。
2.1.2 PTEN mRNA 在胃黏膜不同组织中的表达:PTEN mRNA 在CSG、CAG 伴肠化、胃癌组织中的表达量分别为1. 898 ± 0. 151、0. 698 ± 0. 241、0. 610 ±0.221,CAG 伴肠化组织中PTEN mRNA 表达分别与CSG 组、胃癌组相比,差异均有统计学意义(t=4.321,P=0.001;t=3.007,P=0.041)。
2.2 Western blotting 检测结果
2.2.1 Livin 蛋白检测:Western blotting 检测Livin 蛋白在31 kDa 处出现条带(见图1)。Livin 蛋白在CSG组织中无表达,在CAG 伴肠化、胃癌组织中表达量分别为6.210 ±0.181、6.383 ±0.171,其在CAG 伴肠化、胃癌组织中相对表达量均高于CSG(t =2.031,P =0.016;t=2.023,P=0.018),但CAG 伴肠化组织与胃癌组织中Livin 蛋白的表达量比较,差异无统计学意义(t=1.684,P=0.201)。

图1 Western blotting 检测Livin 蛋白在胃黏膜不同组织中的表达 1:CSG 2:CAG 伴肠化;3:胃癌Fig 1 Expression of Livin protein in different tissues of gastric mucosa by Western blotting 1:CSG;2:CAG with intestinal metaplasia;3:gastric cancer
2.2.2 PTEN 蛋白检测:PTEN 蛋白在CSG、CAG 伴肠化、胃癌组织中表达量分别为1.920 ±0.232、0.701 ±0.121、0.610±0.122,CAG 伴肠化组织中PTEN 蛋白表达分别与CSG 组、胃癌组相比,差异均有统计学意义(t=4.029,P=0.001;t=3.123,P=0.040,见图2)。
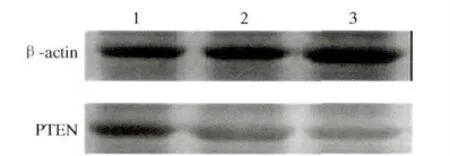
图2 Western blotting 检测PTEN 蛋白在胃黏膜不同组织中的表达 1:CSG;2:CAG 伴肠化;3:胃癌Fig 2 Expression of PTEN protein in different tissues of gastric mucosa by Western blotting 1:CSG;2:CAG with intestinal metaplasia;3:gastric cancer
2.3 免疫组化法检测结果
2.3.1 Livin 蛋白表达:Livin 在CSG 组织中未见Livin阳性表达。CAG 伴肠化组织中Livin 阳性表达率显著高于CSG 组,差异有统计学意义(χ2= 18. 19,P =0.00),与胃癌组比较,差异无统计学意义(χ2=2.87,P=0.09,见表1、图3)。

表1 Livin 在胃黏膜不同组织中的表达情况Tab 1 The expression of Livin protein in different tissues of gastric mucosa
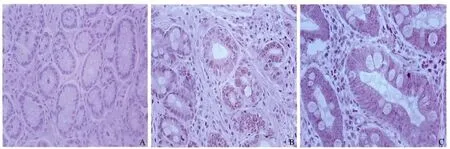
图3 Livin 在胃黏膜不同组织中的表达 A:CSG(200 ×);B:CAG 伴肠化(200 ×);C:胃癌(400 ×)Fig 3 Expression of Livin in different tissues of gastric mucosa A:CSG (200 ×);B:CAG with intestinal metaplasia (200 ×);C:gastric cancer (200 ×)
2.3.2 PTEN 蛋白表达:PTEN 定位于CAG 伴肠化、胃癌组织的细胞浆中,其免疫阳性产物为棕黄色。CAG 伴肠化组织中PTEN 表达分别与CSG、胃癌组相比,差异均有统计学意义(χ2=10.93,P =0.00;χ2=4.43,P=0.04,见表2,图4)。
2.4 Livin 与PTEN 相关性分析 在16 例Livin 阳性CAG 伴肠化组织中,PTEN 阳性者6 例,占37.5%,19例Livin 阴性CAG 伴肠化组织中,PTEN 阳性者16 例,占84.21%,呈负相关(rs= -0.48,P =0.01)。在20例Livin 阳性胃癌组织中,PTEN 阳性者4 例,占20%,10 例Livin 阴性胃癌组织中,PTEN 阳性者7 例,占70%,二者呈负相关(rs= -0.49,P=0.02)。

图4 PTEN 在胃黏膜不同组织的表达 A:CSG(200 ×);B:CAG 伴肠化(200 ×);C:胃癌(400 ×)Fig 4 Expression of PTEN in different tissues of gastric mucosa A:CSG (200 ×);B:CAG with intestinal metaplasia (200 ×);C:gastric cancer (400 ×)

表2 PTEN 在胃黏膜不同组织中的表达Tab 2 The expression of PTEN protein in different tissues of gastric mucosa
3 讨论
CAG 是我国消化道常见病、多发病,其组织学特点表现为固有腺体的萎缩,可伴有肠上皮化生或假幽门腺化生,黏膜肌层增厚,固有膜炎症。研究证实CAG 与胃癌尤其是肠型胃癌的发生率有着显著的关系,越来越受到医疗界的重视,成为目前国内外的研究热点[8]。1978 年WHO 将CAG 列为胃癌癌前状态[9],在其基础上伴有的不完全型肠上皮化生和/或中重度不典型增生则被视为癌前病变。国内外许多学者对CAG 进行时间不等的追踪随访观察,其癌变发生率高达10%[10]。CAG 伴肠化在人群中十分普遍,65 岁以上老年患者肠化率达90%以上[11],其在胃黏膜癌前病变中占有重要地位,如何早期评估其发生的危险性,并能为开展胃癌的干预和预防工作提供依据是目前国内外研究的热点。
多方研究证实适当的凋亡与机体的生长发育、内环境的稳定、器官形成[12]有着极大的关系。Livin 是新近发现的IAPs 家族的新成员,其高表达导致基因缺陷细胞的积聚和细胞恶性转化,促进肿瘤的发生、发展。研究发现它通过BIR 结构域介导选择性结合caspase-3/-7/-9 及Smac,从而阻断caspase 凋亡作用的发挥,从而达到抑制细胞凋亡[13]。有研究结果显示,Livin 蛋白在除胎盘外的正常成年人组织中低表达或不表达,而在泌尿系肿瘤[14]、胃癌[15]等多种恶性肿瘤中强表达,提示该基因抑制细胞凋亡的特性可能在肿瘤的发生、发展、预后中起重要作用。Hou 等[12]提出Livin 蛋白在良性胃黏膜病变组织中的表达趋势,有效预测胃癌癌前病变,有助于胃癌的早期诊断和癌前诊断,具有十分重要的临床意义。
目前对CAG 中Livin 蛋白的表达情况,及在CAG伴肠化癌变过程中的表达情况是否发生变化,报道也不一致。因此,本研究采用免疫组化、实时荧光定量PCR、Western blotting 对Livin 在CGG-CAG 伴肠上皮化生-胃癌中的表达水平进行检测,发现Livin 在不同的胃黏膜病变中表达不同,随着胃黏膜病变加重,其阳性表达率以及Livin mRNA、Livin 蛋白表达量逐渐增加。但Livin 在CSG 中未见阳性表达,其在CAG 伴肠化及胃癌组织中阳性表达率分别为45.71%、66.67%,与Li 等[5]的研究结果一致。Livin mRNA 在CSG 伴肠化、胃癌中的表达量依次增加,与Western blotting 检测结果一致,提示Livin 基因可能参与了CAG 伴肠化癌变的发生、发展。在CAG 伴肠化—癌变过程中,Livin蛋白在CAG 伴肠化和胃癌组织中表达呈上调状态,且CAG 伴肠化和胃癌组织间无显著性差异,二者表达一致,提示Livin 作为凋亡抑制蛋白随着胃黏膜病变的加重,其抗凋亡能力逐渐增强,其可能在胃癌癌前病变即已发挥关键作用,它在胃癌发生的早期阶段发挥重要作用,对胃癌的早期诊断提供参考,如能在此阶段控制Livin 蛋白的表达,可阻止其向癌变方向发展。本研究通过对不同胃黏膜病变中Livin 蛋白表达的差异进行观察、分析,了解其是否与CAG 伴肠化癌变的发生有关,从而为下一步采取的治疗措施提供指导。因此,早期针对CAG 伴肠化患者治疗对胃癌的Ⅰ级预防有着举足轻重的作用。
PTEN 是研究者用代表性差别分析法于1997 年在原发性乳腺癌中分离到的一种新的基因,其在细胞的生长发育、凋亡、迁移、信号传递等方面起着重要的调控作用,被命名为:与张力蛋白同源、第10 号染色体丢失的磷酸酶基因(phosphatase and tensin hmmlogy deletd on ten,PTEN)。它是迄今为止发现的第1 个具有磷酸酶活性的强有力的抑癌基因,在肿瘤组织中频繁发生突变,其自发现起就受到众多学者的关注,已成为近年肿瘤学研究的热点,是继p53 后又一具有重要意义的抑癌基因[16]。
本研究发现,PTEN 在CAG 伴肠化癌变过程中,其阳性表达率在逐渐降低。PTEN mRNA 在CAG 伴肠化、胃癌中的相对表达量也呈递减趋势,与Western blotting 检测结果一致,提示PTEN 基因可能参与了CAG 伴肠化癌变的发生、发展,这与大多学者报道一致,提示PTEN 表达缺失与胃癌的发生有着密切的关系。如果在CAG 伴肠化-胃癌此阶段控制PTEN 蛋白的缺失,可阻止其向癌变方向发展。PTEN 在CAG伴肠化与胃癌组比较差异均有统计学意义,提示PTEN 表达的缺失,减弱了对胃癌细胞增殖的抑制和癌细胞凋亡的发生,从而引起肿瘤细胞恶性生长,促进胃癌的发生、发展,其机制可能与诱导细胞凋亡,促进血管形成,抑制细胞生长、铺展和局部黏附等因素有关。因此,检测PTEN 蛋白对鉴别CAG 伴肠化和胃癌具有重要的价值。
凋亡抑制蛋白Livin 与抑癌基因PTEN 均参与细胞凋亡,研究证实,二者在胃癌中的作用途径一致,但生物学效应截然相反,且二者的相关性未在CAG 中进行研究。本研究发现,在CAG 伴肠化、胃癌组织中Livin 与PTEN 表达呈负相关,提示Livin 蛋白上调、PTEN 蛋白下调可能与CAG 伴肠化癌变的发生密切相关。其可能机制:Livin 是受PI3K/Akt 细胞信号转导途径的调控实现抑制细胞凋亡。PTEN 是PI3K/Akt通路的上游基因,当组织正常时,其可通过阻断Akt 及其下游激酶活性,进而诱导细胞凋亡[17],当组织发生恶变,PTEN 表达下调或缺失时,其对PI3K/Akt 通路的抑制作用减弱,使Livin 蛋白高表达,从而抑制细胞凋亡,然而,PI3K/Akt 信号途径对Livin 的具体调控机制目前尚未阐明,仍需进一步深入研究。
本研究证实,如果对Livin 及PTEN 基因在CAG伴肠化患者中进行监测,将有助于筛选出胃癌高危患者,如能通过检测早期分子事件,可提高胃癌的早期检出率,同时还可为胃癌的预防、预后评价及治疗提供潜在的分子标志,为将来胃癌的分子治疗的应用提供重要的理论依据。对CAG 伴肠化患者进行常规检查,对其阳性的病例应密切随访,必要时进行积极治疗,有效预防胃癌发生。
[1] Crook NE,Clem RJ,Miller LK. An apoptosis-inhibiting baculovirus gene with a zinc finger-like motif[J]. Virol,1993,67(3):21-68.
[2] Hu AQ,Liu HY,Gao LJ. Expression of livin in ovarian cancer cells and its significance [J]. Chin J Clin Lab Sci,2011,29 (3):202-204.胡安群,刘海燕,高玲娟. livin 基因在卵巢癌细胞中的表达及其意义[J]. 临床检验杂志,2011,29(3):202-204.
[3] Yagihashi A,Asanuma K,Kobayashi D,et al. Detection of autoantibodies to livin and survivin in Sera from lung cancer patients [J].Lung Cancer,2005,48(2):217-221.
[4] Gazzaniga P,Gradilone A,Giuliani L,et al. Expression and prognostic significance of LIVIN,SURVIVIN and other apoptosis related genes in the progression of superficial bladder cancer [J]. Ann Oncol,2003,14(1):85-90.
[5] Li J,Yen C,Liaw D,Podsypanina K,et al. PTEN,a putative protein tyrosine phosphatase gene mutated in human brain,breast and prostate cancer[J]. Science,1997,275(5308):1943-1947.
[6] Gao SF,Li DG,Cui JC,et al. Multi-stage expression and correlation of Cyclin D1 and PTEN in gastric mucosa cancer[J]. Chinese Journal of Gerontology,2010,30(5):592-593.高绍芳,李佃贵,崔健从,等. Cyclin D1 和PTEN 在胃黏膜癌变多阶段中的表达及相关性[J]. 中国老年学杂志,2010,30(5):592-593.
[7] Yagihashi A,Asanuma K,Tsuji N,et al. Detection of anti-livin antibody in gastrointestinal cancer patients[J]. Clin Chem,2003,49(7):1206-1208.
[8] Genta RM. Atrophy and atrophic gastritis:one step beyond the Sydney[J].Ital J gastroenterol Hepatol,1998,30 (Suppl 3):5273-5275.
[9] Sun YH,Sun LH,Huang WB,et al. Exprssion of PCNA,EGF and VEGF in chronic atrophic gastritis and their clinical significance[J].Shandong Medical Journal,2008,48(40):4-6.孙永红,孙良华,黄文波,等. 慢性萎缩性胃炎患者胃黏膜上皮细胞中PCNA、EGF、VEGF 的表达及意义[J]. 山东医药,2008,48(40):4-6.
[10] Zheng Q,Shi R. Atrophic gastritis,intestinal intraepithelial neoplasia,mucosa and gastric cancer[J]. J Clin Intern Med,2009,26(11):734-736.郑青,施尧. 萎缩性胃炎、肠化、黏膜上皮内瘤变和胃癌[J]. 临床内科杂志,2009,26(11):734-736.
[12] Hou YJ,Li Y,Guo SH,et al. Expression of inhibitor of apoptosis protein Livin in gastric cancer and adjacent non-cancerous tissue[J].World J Gastroenterol,2010,18(12):1196-1200.
[13] Li CX,Feng ZB. Expression of livin and smac and their relationship with cell apoptosis and proliferation in hept℃arcinoma[J]. J Clini Hepatol,2010,26(5):536-539.李长新,冯震博. Livin、Smac 在肝癌中的表达及与凋亡、增殖的关系[J]. 临床肝胆病杂志,2010,26(5):536-539.
[14] Song JW,Ge B. Progress in Research of Livin in urological Mallgnancy[J]. Medical Recapitulate,2010,16(14):2137-2139.宋建文,葛波. Livin 在泌尿系肿瘤中的研究进展[J]. 医学综述,2010,16(14):2137-2139.
[15] Zhao Y,Deng X,Wang Q. Expression of Livin Smac/DIABLO and PTEN and their relationships with human gastric adenocarcinoma[J].World Chinese Journal of Digestology,2009,17(13):1303-1311.赵毅,邓鑫,王强. Livin、Smac/DIABLO 和PTEN 在胃癌组织中的表达及其与胃癌的相关性[J]. 世界华人消化杂志,2009,17(13):1303-1311.
[16] Su LM,Zhu W,Wang CC. Progress in Research of tumor-suppressor genes PTEN[J]. Journal of Mudanjiang Medical University,2010,31(2):77-78.
[17] Jiang BH,Liu LZ. P13K/PTEN signaling in angiogenesis and tumorigenesis[J]. Adv Cancer Res,2009,102:19-65.
